В настоящее время в России, как и во всем мире, наблюдается рост неблагоприятных факторов, существенно ухудшающих экологическое состояние окружающей среды. Отрицательное влияние на семенники, прежде всего, на спермотогенную функцию, оказывает электромагнитное облучение сверхвысоких (миллиметровых) частот, видимо за счет усиления свободнорадикальных процессов [3,4]. Химические факторы оказывают заметное негативное влияние на инкреторную функцию семенников. В этой связи уместно упомянуть предметы бытовой химии, и гербициды [6]. Природный газ как примышленный токсикант в условиях его постоянного воздействия на живой организм вызывает повышение числа клеток Лейдига отросчатой формы с ядром неправильной формы. Указанный факт говорит в пользу значительного напряжения инкреторной функции семенников, что в перспективе может привести к необратимому нарушению их функционального состояния [2]. Все эти, на первый взгляд, совершенно разрозненные виды воздействий, объединяет механизм ответа организма в виде оксидативного стресса [4,5.]. Развитие окислительного стресса является следствием дисбаланса между систематическим проявлением активизированных кислородных метаболитов (АКМ) и способностью биологических систем дезактивировать АКМ и восстанавливать возникающие повреждения. В исследованиях влияния неблагоприятных факторов на репродуктивную систему значимую роль играют конформационные изменения белков репродуктивной системы причиной которых могут быть выше перечисленные воздействия, а проявлением как изменение функции органа или системы [2,6], в частности снижение репродуктивной функции, так и изменение конкретных физико-химических свойств белков [1].
Целью нашей работы стало исследование эстеразной активности в репродуктивной системе самцов крыс, и снижение термолабильности этих ферментов, как показателя изменений их третичной структуры под влиянием некоторых стрессогенных факторов.
Методы исследования.
Экспериментальная часть исследования включала в себя 418 самцов белых крыс линии Wistar средней массой 225 ± 15,0 г, содержащихся в стандартных условиях вивария. Во избежание влияния сезонных различий в реакциях на экспериментальные воздействия все исследования проводились в осеннее-зимний период года. Эксперименты на животных осуществлялись в соответствии с требованиями Женевской конвенции (1985). Декапитацию животных осуществляли под эфирным наркозом. Проводимый эксперимент включал в себя 5 серий животных по 75 в каждой серии.
1-я серия опытов предусматривала исследование токсических эффектов серводородсодержащего газа Астраханского газоконденсатного месторождения. Животные были подвергнуты воздействию в дозе 10 мг/м3 (по H2S) в течение 60 дней по 240 минут ежедневно;
2-я серия опытов предусматривала исследование эффектов низкоинтенсивного микроволнового излучения (МВИ) Животные были подвергнуты воздействию микроволнового излучения с частотой 42 ГГц (λ = 7,1 мм) в течение 14 и 30 дней по 30 минут ежедневно с помощью генератора монохроматических волн «Явь-1-7,1» (Россия);
3-я серия опытов предусматривала исследование влияния пищевого стресса (дефицит нутриентов) на репродуктивную систему самцов крыс. Животных содержали на дистиллированной воде и отмоченном рисе в количестве 5 г/100 г массы тела животного в сутки в течение 30 дней.
4-я серия опытов предусматривала исследование на репродуктивную систему самцов крыс влияния иммобилизационного стресса. Животных помещали в пластиковые пеналы на 240 минут ежедневно в течение 30 дней.
5-я серия животных контрольная группа. Все серии выполнялись параллельно в один период времени.
Объектом нашего исследования был белковый экстракт эпидидимисов и семенников интактных белых крыс и крыс, подвергавшихся воздействию стрессогенных факторов.
Экстракты готовили на трис-глициновом буфере рН = 7.8 в соотношении вес/объем 1\4, после трехкратного замораживания оттаивания и центрифугирования при 10000g 30 мин., пробы замораживали и хранили при -240С до исследования.
Общая эстеразная активность измерялась по гидролизу 1,0 мМ раствора альфа-нафтилацетата на 0,05М трис-глициновом буфере рН=7,8 за 30 мин при 370С. Хромогеном служил раствор прочного синего РР. Оптическая плотность измерялась при 500 нм. За единицу активности принимали количество фермента которое отщепляет 1.0 мкмоль альфа-нафтола в минуту при 370С.
Исследование термолабильности проводили путем прогрева аликвот (0,4 мл) семенной плазмы человека в термостатируемых ячейках микротермостата М-208 от 40°С до 80°С в течение 20 мин при каждой температуре.
Результаты. Экстракт ткани эпидидимисов и семенников интактных крыс содержит очень высокий уровень эстеразной активности. По нашим данным в тесте расщепления альфа-нафтилацетата она составляет в среднем 1161,5±59,0 ЕД. Прогрев экстрактов эпидидимисов и придатков крыс при 50,00С в течении 20 мин приводит к снижению средней эстеразной активности до 755,0±89,0 ЕД, что составляет 65% от нативной активности. При 550С средняя эстеразная активность снижается до 459,9±68,0 ЕД, что составляет 39,6% от нативной активности. Прогрев экстрактов эпидидимисов и придатков крыс контрольной группы при 60,00С в течении 20 мин приводит к снижению средней эстеразной активности до 221,85±73,0 ЕД, что составляет 19,1% от нативной активности.
И прогрев при 650С в течении 30 мин приводит к снижению средней эстеразной активности до 6,97±3,1 ЕД, что составляет 0,6% от нативной активности. Наблюдается ясно выраженная термолябильность общей эстеразной активности экстрактов эпидидимисов и придатков крыс контрольной группы ( рис1).
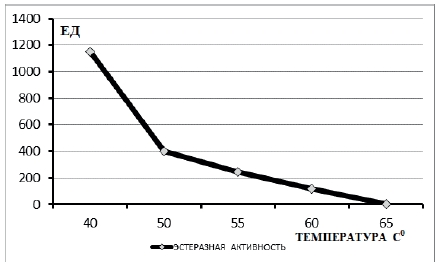
Рис.1 Динамика эстеразной активности экстрактов эпидидимисов и придатков крыс контрольной группы в зависимости от температуры
Аналогичные измерения проведенные с образцами экстрактов эпидидимисов и придатков крыс из опытных групп выявили другую закономерность.
В экстрактах эпидидимисов и придатков крыс 1 серии, подвергнутых химическому стрессу воздействием сероводородсодержащего газа динамика эстеразной активности выглядела следующим образом. Исходная эстеразная активность была достоверно ниже и составила в среднем 907,4±23,5ЕД\мл (при n=23,Р≤0,01). Прогрев экстрактов эпидидимисов и придатков крыс при 500С в течении 20 мин приводит к снижению средней эстеразной активности до 834,8±19,0 ЕД, (при n=23) что составляет 92% от нативной активности. При 550С средняя эстеразная активность снижается до 816,75±22,8 ЕД, что составляет 90,0% от нативной активности. Прогрев экстрактов эпидидимисов и придатков крыс этой группы при 600С в течении 20 мин приводит к снижению средней эстеразной активности до 536,3±33,8 ЕД, что составляет 59,1% от нативной активности. Прогрев при 650С приводит к снижению средней эстеразной активности до 114,9±9,1 ЕД, что составляет 12,7% от нативной активности. При 700С эстеразная активность не регистрируется .
В экстрактах эпидидимисов и придатков крыс 2 серии, подвергнутых физическому стрессу воздействием низкоинтенсивного микроволнового излучения динамика эстеразной активности выглядела следующим образом. Исходная эстеразная активность была на уровне контрольной группы и составила в среднем 1063,5±37,5ЕД\мл (при n=21,Р≥0,5). Прогрев экстрактов эпидидимисов и придатков крыс при 500С в течении 20 мин практически не приводит к снижению средней эстеразной активности и составляет 1042,23±28,0 ЕД, (при n=21) что составляет 98% от исходной активности. При 550С средняя эстеразная активность снижается только до 1020,96±38,8 ЕД, что составляет 96,0% от исходной активности. Прогрев экстрактов эпидидимисов и придатков крыс этой группы при 600С в течении 20 мин показывает среднюю эстеразную активность 867,8 ±20,4 ЕД, что составляет 81,6% от исходной активности. Прогрев при 650С не изменяет среднюю эстеразную активность, она составляет 865,4±12,7 ЕД, или 81,4% от исходной активности. При 700С эстеразная активность в этой серии даже недостоверно повышается до 878,0 ± 34,7 ЕД. А прогрев до 800С приводит к снижению до 175,46±18,3 ЕД или 16,5% от исходной активности.
В экстрактах эпидидимисов и придатков крыс 3 серии, подвергнутых пищевому стрессу воздействием недостатка питания динамика эстеразной активности выглядела следующим образом. Исходная эстеразная активность была достоверно ниже и составила в среднем 880,1±14,5 ЕД\мл (при n=19,Р≤0,01). Прогрев экстрактов эпидидимисов и придатков крыс при 500С в течении 20 мин практически не приводит к снижению средней эстеразной активности и составляет 856,34±198,1 ЕД, (при n=19) что составляет 97,3% от исходной активности. При 550С средняя эстеразная активность снижается только до 827,3±26,8 ЕД, что составляет 94,0% от исходной активности. Прогрев экстрактов эпидидимисов и придатков крыс этой группы при 600С в течении 20 мин показывает резкий спад средней эстеразной активности до 277,2±20,4 ЕД, что составляет 31,5% от исходной активности. При прогреве до 650С продолжает снижаться средняя эстеразная активность, она составляет 71,3±6,7 ЕД, или 8,1% от исходной активности. При 700С эстеразная активность в этой серии не регистрируется.
В экстрактах эпидидимисов и придатков крыс 4 серии, подвергнутых иммобилизационному стрессу динамика эстеразной активности выглядела следующим образом. Исходная эстеразная активность была достоверно ниже и составила в среднем 948,1±34,5 ЕД\мл (при n=24,Р≤0,01). Прогрев экстрактов эпидидимисов и придатков крыс при 500С в течении 20 мин приводит к снижению средней эстеразной активности до 708,8±49,0 ЕД, что составляет 75% от исходной активности. При 550С средняя эстеразная активность снижается до 297,7±41,3 ЕД, что составляет 31,4% от исходной активности. Прогрев экстрактов эпидидимисов и придатков крыс этой группы при 600С в течении 20 мин приводит к снижению средней эстеразной активности до 117,9±73,0 ЕД, что составляет 11,2% от исходной активности. А прогрев при 650С в течении 30 мин приводит к снижению средней эстеразной активности до 32,24±5,1 ЕД, что составляет 3,4% от нативной активности. При 700С эстеразная активность в этой серии не регистрируется.
В таблице 1. Приведены данные динамики температурной зависимости эстеразной активности в исследованных группах с воздействием различных стрессогенных факторов отнесенные к исходной эстеразной активности в контрольной группе. Это позволило оценить не только изменение чувствительности изучаемого фермента к температуре, но и выявить тенденцию изменения эстеразной активности при воздействии разных стрессогенных факторов. Так из таблицы 1 следует, что алиментарный стресс снижает практически на четверть исходную активность эстеразы в репродуктивной системе самцов крыс, что, видимо, объясняется компенсаторным снижением метаболизма при голодании. В дальнейшем динамика температурной устойчивости эстеразы репродуктивной системы самцов крыс достоверно не отличается от динамики термоустойчивости в контрольной группе.
Таблица 1
Динамика эстеразной активности в зависимости от температуры. (уровень активности эстеразы выражен в % к активности в контрольной группе при 400 С)
|
Температура С0 |
Серии экспериментальных животных |
||||
|
контроль |
Серия 1 |
Серия 2 |
Серия 3 |
Серия 4 |
|
|
40 |
100% |
78,1% |
91,56% |
75,8% |
81,63% |
|
50 |
65% |
71,9% |
89,73% |
73,73% |
61,0% |
|
55 |
39,6% |
70.3% |
87,9% |
71,23% |
25,63% |
|
60 |
19,1% |
46,17% |
74,71% |
23,87% |
10,15% |
|
65 |
0,6% |
9,9% |
74,5% |
6,14% |
2,78% |
|
70 |
0 |
0 |
75,6% |
0 |
0 |
|
80 |
0 |
0 |
15,1% |
0 |
0 |
Наиболее выраженные изменения термоустойчивости проявляет эстераза в группе подверженной воздействию микроволнового излучения (серия 2). Исходная активность эстеразы при 400С практически не отличается от контрольной группы. Микроволновое излучение не влияет на активность этого фермента, но при исследовании термолябильности выясняется, что именно этот стрессогенный фактор в наибольшей степени изменяет устойчивость эстеразы к температуре. Из таблицы 1 следует, что только воздействие микроволнового излучения приводит к тому, что эстеразная активность репродуктивной системы самцов крыс сохраняется до 800С. А при 65 градусах она теряет только около 20% своей активности. Возможных механизмов этого процесса несколько, но наиболее часто такие явления объясняют стабилизацией третичной структуры фермента под влиянием микроволнового излучения в случае отсутствия резонансных колебаний в структуре белка[3].
Иммобилизационный стресс не приводит по нашим данным также как алиментарный к конформационным изменениям в молекуле эстераз репродуктивной системы самцов крыс, наблюдается снижение исходной активности как реакция на стрессогенный фактор и в дальнейшем динамика падения активности под влиянием температурной инактивации совпадает с динамикой в контрольной группе не показывая достоверных отклонений .
Следует отметить, что полученные данные об увеличении термостабильности эстераз репродуктивной системы самцов крыс дополняют механизм развития окислительного стресса являясь доказательством глубоких структурных изменений белков в организмах и системах, подверженных влиянию стрессогенных факторов. Конформационные изменения белков репродуктивной системы могут быть частью патологических изменений, приводящих к бесплодию или снижению фертильности [3].
Библиографическая ссылка
Узбякова Р.Р., Николаев А.А. ВЛИЯНИЕ СТРЕССОГЕННЫХ ФАКТОРОВ НА КОНФОРМАЦИОННЫЕ СВОЙСТВА БЕЛКОВ РЕПРОДУКТИВНОЙ СИСТЕМЫ САМЦОВ КРЫС // Международный журнал прикладных и фундаментальных исследований. 2016. № 12-6. С. 1013-1017;URL: https://applied-research.ru/ru/article/view?id=10977 (дата обращения: 08.01.2026).

