Алюминат меди CuAlO2 является полупроводником, прозрачным для видимого света. Нелегированный CuAlO2 обладает p-типом проводимости. В настоящее время значительный прогресс достигнут в синтезе и изучении прозрачных полупроводниковых оксидов с n-типом проводимости, таких как ZnO, In2O3 [1,2]. Технология синтеза этих материалов в виде тонких плёнок и объёмных образцов хорошо отработана, а достигнутые сочетания прозрачности и подвижности обуславливают их широкое применение. В то же время прозрачные полупроводники p-типа значительно менее изучены, что в значительной степени обусловлено трудностью их синтеза [1,3]. В частности несмотря на значительное количество работ по изучению алюмината меди [4,5] вопрос о влиянии метода и условий синтеза на электропроводность и прозрачность требует дальнейшего изучения. В связи с этим отработка методики синтеза алюмината меди и изучение зависимости его свойств от исходных материалов и условий синтеза является актуальной задачей.
Целью настоящей работы являлось получение керамики CuAlO2 из оксидов меди CuO и Cu2O и изучение ее структуры и свойств.
Материалы и методы исследования
Синтез CuAlO2 проводили двумя способами из различных исходных веществ – CuO и Cu2O согласно реакциям
2CuO + Al2O3 = 2 CuAlO2 + 1/2O2; (1)
Cu2O + 2 AlOOH = 2 CuAlO2 + H2O. (2)
Порошковые смеси исходных веществ тщательно перетирали, прессовали в таблетки и отжигали в трубчатой печи с несколькими промежуточными перемолами, повторным прессованием таблеток и их отжигами. Особенностью первого процесса является то, что для получения целевого продукта CuAlO2 (содержащего CuI) в качестве исходного вещества брали CuO (содержащий CuII ), и это превращение реализуется выше 1040оС на воздухе (в нашем случае – при 1100оС), что не требует создания защитной атмосферы при синтезе, однако требует внимательного отношения к охлаждению образца после отжига, когда возможно окисление CuI > CuII. Особенностью второго процесса является то, что и исходный реактив, и целевой продукт содержат CuI , и такая реакция может проходить быстрее первой, однако, она требует изоляции от окружающей среды в ходе нагрева и охлаждения образца во избежание окисления кислородом воздуха. Мы проводили эту реакцию в трубчатом реакторе в тока аргона при 1100оС, также с промежуточными перемолами, повторным прессованием таблеток и их отжигами.
Кристаллическая структура синтезированных образцов определялась методом рентгенофазового анализа в процессе синтеза для получения однофазных образцов. Микроструктура образцов была дополнительно изучена методом сканирующей электронной микроскопии. Пористость синтезированной керамики определена гравиметрическим методом. Кроме этого для контроля фазового состава были измерены спектры комбинационного рассеяния света. Для исключения эффекта разогрева образцов лазерным излучением при измерениях спектра КРС интенсивность лазерного излучения ослаблялась до уровня, при котором уменьшение интенсивности в два раза не приводило к сдвигу основных максимумов в спектрах в пределах разрешающей способности спектрометра. Для обнаружения парамагнитных дефектов были измерены спектры электронного парамагнитного резонанса (ЭПР). Электропроводность синтезированных образцов была измерена четырёхконтактным методом. Тип проводимости был определён по знаку коэффициента Зеебека. Для исследования устойчивости синтезированной керамики к окислению меди были измерены термограммы.
Результаты исследования и их обсуждение
Фазовый состав и микроструктура исследованных образцов
На рентгеновских дифрактограммах синтезированных образцов керамики образцов (рис. 1), полученных первым способом, долгое время присутствуют следы исходного CuO, и получить чистую, без примесей, рентгенограмму CuAlO2 удается лишь по достижении суммарного времени отжига 100 ч (4 х 25 ч с промежуточными перетираниями и закалкой на воздухе). При синтезе керамики вторым способом однофазное состояние достигается быстрее – за 30 ч (3•10 ч с промежуточными перемолами).
В итоге, по обеим методикам были получены спеченные керамические таблетки, содержащие, согласно РФА, единственную фазу CuAlO2 , однако, различавшиеся по внешнему виду и свойствам. Образец, полученный по второй методике из Cu2O, был светло-серого цвета, тогда как полученный по первой методике из CuO, имел более темный серый оттенок.
Микрофотографии скола керамики, полученные методом сканирующей электронной микроскопии (СЭМ) показывают, что полученная керамика (CL_6) однородна, размер зерен составляет 0.5 – 2 мкм, присутствуют небольшие поры, максимальный размер которых достигает 2 мкм на поверхности таблетки и до 1 мкм в объеме (рис. 1, врезка).
Термогравиметрическое изучение устойчивости CuAlO2 к окислению
Отдельным важным вопросом является устойчивость CuAlO2, как соединения одновалентной меди, к окислению. Согласно фазовой диаграмме, можно было бы ожидать, что при температурах 300–1000°С на воздухе это соединение будет окисляться. Для проверки этого предположения была снята термограмма на воздухе при нагреве со скоростью 10°/мин в интервале температур 40 – 1100°С (рис. 2).
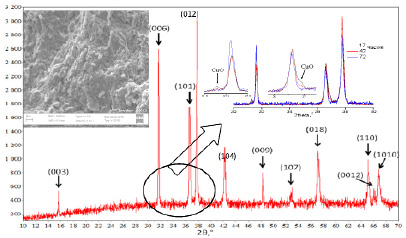
Рис. 1. Рентгенограмма однофазного CuAlO2, соответствует карточке PCPDF_35-1401. На врезке справа: медленное исчезновение рефлексов CuO при отжигах 17, 42, 72 часов на воздухе. На врезке слева: микроструктура скола керамической таблетки (изображение СЭМ)
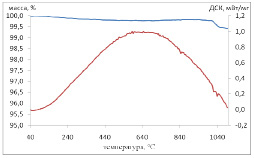
Рис. 2. ДСК-термограмма порошка CuAlO2 (CL_4) на воздухе, скорость нагрева 10°/мин (верхняя кривая – изменение массы, нижняя – ДСК-сигнал)
Из термограммы видно, что во всем интервале температур не наблюдается увеличения массы образца, наоборот, происходит очень слабая потеря массы: 40 – 640°С уменьшение на 0,224 %, 650 – 880°С увеличение на 0,06 % и быстрая потеря веса (0,3 %) в интервале 1015 – 1050°С. Если бы происходило окисление CuAlO2 по реакциям:
2CuAlO2 + ½ O2 = 2CuO + Al2O3
или
2CuAlO2 + ½O2 = CuAl2O4 + CuO,
то наблюдался бы набор массы 6,5 %. Поскольку никакого набора массы не наблюдается, то следует сделать вывод, что соединение CuAlO2 довольно устойчиво к окислению на воздухе в условиях проведенного эксперимента при температуре 20-1000°С, что было также подтверждено методом рентгеновской дифракции: посторонние фазы не появились. Вероятно, это объясняется кинетической устойчивостью соединения. Скачкообразное уменьшение массы на 0,3 % при 1015°С, по-видимому, объясняется связанной с плавлением диссоциацией присутствующей в образце примеси CuO = Cu2O + O2.
Оптические свойства CuAlO2
Спектры поглощения керамических образцов CuAlO2, синтезированных из CuO и Cu2O представлены на рис. 3. Образец CuAlO2, полученный из CuO, значительно сильнее поглощает в видимой области, чем образец из Cu2O. Особенности соответствующие краю межзонного поглощения наблюдаются при энергии фотонов (3,4-3.5 эВ) что согласуется с литературными данными [5]. Поглощение в видимом диапазоне образца, синтезированного из CuO указывает на большую концентрацию дефектов в керамике, синтезированной из CuO и большой разброс энергий одноэлектронных состояний в запрещённой зоне, обусловленный дефектами.
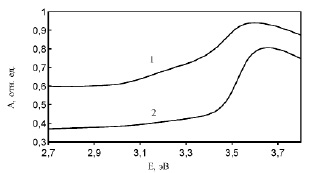
Рис. 3. Спектры поглощения образцов CuAlO2, полученных из: 1 – CuO, 2 – Cu2O
Спектры комбинационного рассеяния света и ЭПР
Спектры комбинационного рассеяния образцов синтезированных из CuO и Сu2O имеют различия в областях 200-300 и 350-700 см-1, хотя и тот, и другой содержат характерные для CuAlO2 интенсивные пики при 417 и 765 см-1, соответствующие оптическим модам Eg и А1g. (рис.4). Другие наблюдаемые в спектрах КРС максимумы могут быть обусловлены дефектами и особенностями микроструктуры, которые частично снимают запрет на процессы неупругого рассеяние света на фононах, запрещённые правилами отбора в кристаллах [6,7].
В записанном при комнатной температуре ЭПР-спектре образца CuAlO2 (рис.4, врезка) синтезированного из CuO, наблюдается интенсивная широкая линия с g-фактором близким к 1,5, похожая на линии наблюдавшиеся в [8] и объясненные парамагнитными дефектами, состоящими из ионов Cu2+, связанных обменным взаимодействием через ионы кислорода [9]. Для образца CuAlO2 из Cu2O такой ЭПР-сигнал отсутствует. Рассчитанное значение концентрации парамагнитных центров в керамике, синтезированной из CuO, составило 3.2•1019 спин/г, или 0.65 % от всех атомов меди.
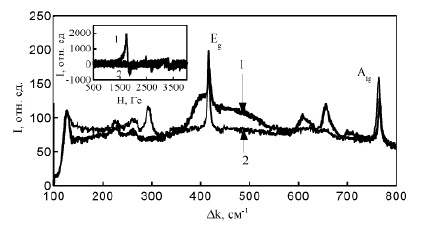
Рис. 4. Спектры комбинационного рассеяния света CuAlO2: 1 – полученный из CuO, 2 – полученный из Cu2O. Врезка: ЭПР спектры образцов CuAlO2: 1 – из CuO; 2 – из Cu2O
Электропроводность
Для всех образцов p-тип проводимости был подтверждён положительным знаком коэффициента Зеебека при помощи термического зонда. Величина коэффициента Зеебека составила 400-800 мкВ/К в температурном интервале 240-320 К для образца керамики CuAlO2, синтезированного из CuO.
Температурные зависимости удельного сопротивления образцов синтезированных из CuO и Cu2O показана на рис. 5. Во всём исследованном диапазоне температур они описывается активационным законом
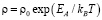 ,
,
где EA – энергия активации; kB – постоянная Больцмана; T – температура, ρ0 – предэкспоненциальный множитель. Энергии активации указаны на рис. 5. Для образца, синтезированного из Cu2O энергия активации (0.21 эВ) близка к литературным данным [3,4], при этом ее величина значительно меньше ширины запрещенной зоны в CuAlO2, что указывает на то, что активация дырок происходит с дефектного уровня.
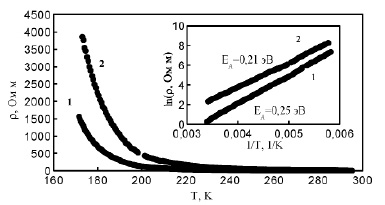
Рис. 5. Температурные зависимости сопротивления образцов керамики CuAlO2, синтезированных из: 1 – CuO, и 2 – Cu2O
Удельное сопротивление образца, синтезированного из CuO меньше, чем образца, синтезированного из Cu2O, что указывает на большую концентрацию акцепторов. В то же время энергия активации для образцов керамики, синтезированной из CuO (0,25 эВ) больше чем в образцах керамики, синтезированной из Cu2O. Это указывает на больший разброс энергий акцепторных уровней в образце полученном из CuO, что согласуется с данными оптического поглощения.
Заключение и выводы
Из оксидов меди с различной валентностью синтезированы керамические образцы CuAlO2. Сканирующая электронная микроскопия показала, что керамика является плотной и содержит лишь небольшое количество пор микрометрового размера. Хотя, согласно данным РФА, образцы являются однофазными и соответствуют рентгеновскому стандарту CuAlO2 PCPDF 35-1401, образцы, полученные из CuO и из Cu2O, различаются по внешнему виду и свойствам. Керамика CuAlO2 из CuO имеет более темный серый цвет; в спектрах поглощения наблюдается большее поглощение в видимом диапазоне, что указывает на большую концентрацию дефектов; в спектрах комбинационного рассеяния света присутствуют посторонние пики; в этих образцах также наблюдается сигнал ЭПР (g≈1.5), которого нет в керамике CuAlO2 из Cu2O, имеющей светло-серый цвет. Таким образом, синтезировать CuAlO2 предпочтительно по второй методике из Cu2O в токе аргона: синтез проходит быстрее, а образцы не содержат малых примесей CuO, невидимых на рентгенограмме. Ширина запрещённой зоны оценена по спектрам оптического поглощения. Дырочный тип проводимости подтверждён знаком коэффициента Зеебека. Температурная зависимость электропроводности образцов описывается активационным законом. При этом удельное сопротивление образцов, синтезированных из CuO, ниже, а энергия активации выше, чем у образцов CuAlO2, синтезированных из Cu2O.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований проект № 15-03-07408а.
Библиографическая ссылка
Кульбачинский В.А., Кытин В.Г., Кондратьева Д.Ю., Григорьев А.Н., Каменев А.А., Амеличев В.А., Корсаков И.Е. СТРУКТУРА И СВОЙСТВА ПОЛУПРОВОДНИКОВОЙ КЕРАМИКИ CUALO2, СИНТЕЗИРОВАННОЙ ИЗ ПРЕКУРСОРОВ С РАЗЛИЧНОЙ ВАЛЕНТНОСТЬЮ МЕДИ // Международный журнал прикладных и фундаментальных исследований. 2017. № 1-2. С. 223-227;URL: https://applied-research.ru/ru/article/view?id=11172 (дата обращения: 27.01.2026).

