Сперматогенез является динамичным процессом, реализация которого напрямую связана с численностью населения в России и мире. Нормальное течение основных стадий обеспечивается многофакторной регуляцией, как со стороны самих гамет, так и элементами микроокружения и биохимической реанжировки. Семейство инсулиноподобных факторов роста (ИФР, IGF), по структуре и функциям похожих на инсулин, включает в себя несколько представителей [1, 2, 3]. Они являются эндокринными, аутокринными и паракринными регуляторами процессов пролиферации и дифференцировки клеток. ИФР увеличивают транспорт аминокислот и глюкозы в цитоплазму, запускают каскад фосфорилирования белков и ингибируют внутриклеточные протеиназы. ИФР1 (IGF-I) синтезируется в гепатоцитах [3]. Инсулин, андрогены, эстрогены повышают секрецию IGF-I печенью, а глюкокортикоиды её снижают [4]. IGF-I оказывает влияние на развитие организма на протяжении всей жизни, но его уровень в крови не постоянный: наиболее низкий уровень синтеза IGF-I отмечается в детстве и в старости, а самый высокий – во время подросткового периода жизни [4, 5, 6].
IGF-I и его рецепторы обладают широким спектром действия на мужские половые клетки, в первую очередь – стимулируют пролиферацию, стимулируют стероидогенез и этапы половой дифференцировки сперматогоний в первичные сперматоциты [7, 8, 9], его концентрация прямо коррелирует с числом сперматоцитов, находящихся на стадии пахитены [10]. У человека именно эти сперматоциты продуцируют больше всего IGF-I, который стимулирует синтез ДНК в делящихся митозом гамет. IGF-I также обнаружен в клетках Лейдига. Миоидные клетки вырабатывают производные инсулиноподобного фактора роста, которые, в свою очередь, влияют на клетки Лейдига [11, 12, 13].
Однако в настоящее время мало изучена роль в сперматогенезе универсального ростового фактора – ИФР1 у мужчин пожилого возраста, а также, возможное участие в патогенезе Сертоли-клеточного синдрома и его вариантов и гипосперматогенезе. Количество мужчин, страдающих бесплодием с каждым годом неуклонно возрастает [14, 15]. Поэтому разработка этиопатогенетической терапии является круциальной.
Цель исследования: получение новых морфофункциональных данных по чувствительности и специфичностиИФР1 в мужских половых клетках в нормальном сперматогенезе и при фокальном сперматогенезе (необструктивная азооспермия).
Материалы и методы исследования
Исследования проводились на кафедре патологической анатомии им. академика А.И. Струкова Первого МГМУ им. И.М. Сеченова и в Научном клиническом центре ОАО «РЖД», Москва, Россия.
Пациенты и материал. В качестве материала для исследования в работе использовались ткани яичек здоровых (контрольная группа) мужчин и биопсийный материал у лиц с патологией – идиопатическое бесплодие (клинически обоснованная азооспермия).
Работа выполнена в двух группах: I. – группа с условным контролем физиологического течения сперматогенеза, в семейном анамнезе – одно и более деторождений: А – мужчины 22–35 лет (28.5±6.5, n=10); Б. – мужчины 64–75 лет (69.5±5.5, n=10); II. – мужчины 22 – 35 лет с идиопатической азооспермией (28.5±6.5, n=50), бесплодие в браке более двух лет.Объект исследования: во всех группах – правые семенники (яички) – биоптаты.
Гормональный анализ мужчин, страдающих бесплодием.Анализ крови забирался строго натощак из локтевой вены. Количественное содержание гормонов проводили по методикам и протоколам после тестирования и утверждены для данной биохимической лаборатории. У всех мужчин уровни гормонов ФСГ, ЛГ и тестостерона в сыворотке крови в пределах возрастной физиологической нормы.
Спермограмма. Значения эякулята оценивались согласно протоколу Всемирной организации здравоохранения [14]. После чего, была сформирована группа мужчин, учитывая следующие критерии: азооспермия и ФСГ ≥11.0 мЕд/мл.
Лабораторная цитогенетическая и молекулярно-генетическая диагностика (исследование кариотипа, анализ крови на наличие микроделеций AZF локуса Y-хромосомы). Кариотип: 46, ХY; Y – микроделеции отсутствуют.
Физикальные данные. Все пациенты, страдающие бесплодием, являются молодыми людьми в возрасте 22 – 35–ти лет; соматически здоровы, без вредных привычек; инфекционные заболевания, влияющие на сперматогенез (в том числе, эпидемический паротит), а также врожденные аномалии развития яичек у пациентов отсутствовали.
Тестикулярная оценка (биопсия). Биопсия яичка была выполнена с целью выявления причины азооспермии, определения степени поражения сперматогенеза и исключения обструкции выводных семенных протоков. Биоптаты оценивали с использованием метода, описанного S. Johnsen, с изменениями, внесенными J. Aafjes и соавт. [16].
Морфологическое исследование. Фрагменты яичек (1,0×1,0 см) фиксировали в забуференном HCl 10 % формалине (рН=7,2; от 5 до 24 часов); дегидратировали в батарее спиртов восходящей концентрации и заливали в парафин. Срезы аутоптатов и биоптатов яичек, толщиной 4–6 ×10–6 м, помещали на обычные, а для иммуногистохимического исследования (ИГХ) – на специальные адгезивные предметные стёкла SuperFrostPlus (хх), депарафинировали согласно принятой стандартной методике. Впоследствии, срезы (≈5 μm) либо окрашивали гематоксилином и эозином (H&E) для гистологического исследования или использовали для ИГХ.
Иммуногистохимический метод (ИГХ). После депарафинизации и регидратации парафиновых срезов проводили ИГХ-исследование по стандартному протоколу в автоматическом режиме в иммуногистостейнере Bond-Max («Leica», Великобритания) на выявление ИФР1 в структурах яичек. В качестве первичных антител использовали моноклональные антитела к ИФР1 (табл. 1). Вторичные антитела – компании «Leica Biosystems Newcastle Ltd», Великобритания. Для данного маркёра выполнялись контрольные исследования с целью исключения псевдопозитивных и псевдонегативных результатов. Титр антител подбирали с использованием раствора для разведения антител (antibodydiluents). Разведение 1:100; срезов на стекле – по два. Разведения для всех видоспецифичных вторичных антител составили 1: 100. Срезов на стекле – по два. Ядра клеток докрашивали гематоксилином Mayer; промывали под проточной водой; дегидратировали (спирт 96 %) 2 раза по 10 минут; срезы подвергали деградации и заключали в гель «Aquatex»® (aqueousmountingagent, «AndwinScience», Франция).
Иммуногистохимическое исследование
|
Антитело (фирменное название) |
Ig класс (фирма) |
Специфичность и характеристика |
|
Rabbit polyclonalAntibody Insulin-like Growth Factors-I |
IgG1 Santa Cruz Biotechnology |
Цитоплазматический антиген; показатель пролиферативной митотической активности клеток; аутокринный/паракринный стимулятор роста. |
Интенсивность окрашивания срезов оценивали согласно рекомендациям [17] и с использованием цветовой шкалы детекции: «–» – отсутствие экспрессии, «+» – слабая экспрессия, «++» – умеренная экспрессия, «+++» – выраженная экспрессия (высокоинтенсивная иммунопероксидазная реакция).
Визуализацию биопсийного материала выполняли на светооптическом микроскопе «Carl Zeiss Lab.A1» (Carl Zeiss, Германия), совмещённом с видеокамерой «AxioCam ERc5s» (Carl Zeiss Microscopy GmbH, Германия) и программным обеспечением ZEN Lite.
Статистический анализ. Полученные данные статистически обрабатывали с использованием программного пакета SPSS 7.5 forWindows (IBMAnalytics, США). Для сравнения двух выборок использовали t-критерий с уровнем значимости p <0,05.
Результаты исследования и их обсуждение
Гистология яичек мужчин I-й группы. В обеих контрольных подгруппах – нормальный сперматогенез (MJS= 10 баллов).
Гистология яичек мужчин II-й группы (n=50). У мужчин в биоптатах визуализируются следующие морфологические картины: субтотальной аплазии мужских половых клеток (n=41);Сертоли-клеточного синдрома (n=9); тубулярная атрофия канальцев (n=6), а также выраженная гиперплазия клеток Лейдига.
Данные иммуногистохимического исследования. Иммунологическая реакция антител к IGF-I в мужских половых клетках и элементах микроокружения распределилась следующем образом (по группам): I – в обеих подгруппах при выявлении IGF-I наиболее ярко маркируются все половые клетки («++») и соматические клетки интерстициальной ткани («+»), а также эндотелий кровеносных сосудов («+»).Уровень (степень) экспрессии IGF-I снижается в процессе сперматогенеза от сперматогоний («+++») до сперматозоидов («++»). Отсутствие реакции к IGF-I наблюдается в клетках Сертоли и клетках миоидного слоя стенки семенного канальца у молодых мужчин, но слабое иммуномечение в клетках Сертоли («±») у пожилых. II – слабый уровень положительной экспрессии к IGF-I отмечен в единичных клетках Сертоли («+») и в цитоплазме некоторых сохранившихся сперматогоний («±») (рисунок, в).
Статистическая обработка данных.Содержание инсулиноподобного фактора роста-1 при необструктивной азооспермии у мужчин 22 – 35 лет снижено на 8.8 % (7.0±0.22) по сравнению с таковой возрастной группой в контроле (62.0±0.33 %) и на 5,7 % у пожилых мужчин (40.0±0.33 %). Возможно, речь идёт о нарушении паракринной регуляции синтеза инсулиноподобного фактора роста 1.
а б в
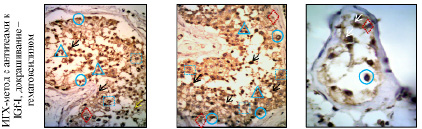
Структуры яичка в норме (а, б) и при патологическом сперматогенезе (в): а – 22–35 лет; б – 64–75 лет; в – мужчины 22–35 лет, фокальный сперматогенез (блок созревания, MJS= 3 балла); О – сперматогонии;  – сперматоцит I; Δ – сперматоцит II; ◊ – клетки Сертоли; ↑ – IGF-I. Увеличение: а, б ×400; в ×1000
– сперматоцит I; Δ – сперматоцит II; ◊ – клетки Сертоли; ↑ – IGF-I. Увеличение: а, б ×400; в ×1000
Крайне важной представляется роль инсулиноподобного фактора роста 1 (IGF-I) в сперматогенезе, селекции мужских половых клеток и элементов микроокружения извитых семенных канальцев, компонентов гемато-тестикулярного барьера [18].
Инсулиноподобные факторы роста обладают широким спектром митогенных и метаболических эффектов[5, 10].
При выявлении маркёра IGF-I в контрольной группе наиболее ярко маркируются половые и в меньшей степени соматические клетки семенного извитого канальца, а также его микроокружения. При идиопатическом бесплодии определяется слабая экспрессия IGF± в сперматогониях и в клетках Сертоли.
Активное выявление исследованного фактора роста (ИФР1) как в соматических, так и в герминальных элементах гонад подтверждает его функциональную необходимость в региональном механизме ауто- и паракринной регуляции текущих процессов в яичке и семенных канальцах в частности. Отсутствие специфического маркирования стромы свидетельствует о её вспомогательной роли в этих процессах.
Данные проведённых качественных реакций экспрессии ИФР1 в совокупности с результатами количественных анализов можно трактовать как нарушение аутокринной и паракринной регуляции мужских половых клеток при идиопатической азооспермии, что возможно, является наиболее значимым в патогенезе данной формы бесплодия. Особо следует подчеркнуть о включение компенсаторных механизмов со стороны местных регуляторов с целью подавления патологически идущего сперматогенеза.
Заключение
Зарегистрированное снижение активности экспрессии инсулиноподобного фактора роста-1 в группе идиопатического бесплодия, представляется закономерным в связи с универсальностью его роли в процессе морфогенеза в целом.
Благодарности: пациентам, участвующим в клиническом исследовании (кровь на гормоны и биоптаты); эту статью посвящаем научному руководителю и наставнику – академикуРАН, д.м.н., профессору О.В. Волковой, как дань её огромному вкладу в развитие отечественной эмбриологии и репродуктологии.
Библиографическая ссылка
Демяшкин Г.А., Филиппов Е.Е. МОРФОФУНКЦИОНАЛЬНАЯ ХАРАКТЕРИСТИКА ИНСУЛИНОПОДОБНОГО ФАКТОРА РОСТА 1 В НОРМАЛЬНОМ СПЕРМАТОГЕНЕЗЕ И ПРИ ИДИОПАТИЧЕСКОМ БЕСПЛОДИИ // Международный журнал прикладных и фундаментальных исследований. 2017. № 1-2. С. 236-239;URL: https://applied-research.ru/ru/article/view?id=11175 (дата обращения: 07.03.2026).

