Пастереллез (лат. – Pasteurellosis; геморрагическая септицемия) – это опасное заболевание сельскохозяйственных и диких животных, ведущий за собой большой падеж численности животных, характеризующаяся септическими явлениями, крупозным воспалением легких, плевритом, отеками в различных областях тела. Болезнь распространена во всех странах мира и восприимчивы все виды домашних млекопитающих и птицы. Наиболее чувствительны буйволы, крупный рогатый скот, кролики и куры. Высокую устойчивость к пастереллезу имеют лошади и плотоядные. Большое значение в эпизоотологии болезни имеет пастереллоносительство, которое в неблагополучных хозяйствах среди крупного рогатого скота достигает 70 %, овец – 50, свиней – 45, кроликов более – 50 и среди кур – от 35 до 50 %. Экономический ущерб от пастереллеза складывается из потерь от падежа, вынужденного убоя больных животных и затрат на проведение профилактических и оздоровительных мероприятий [7].
Объективным способом борьбы с инфекционными заболеваниями является специфическая профилактика. С целью профилактики бактериальных инфекций сельскохозяйственных животных используется огромное количество биологических препаратов. Несмотря на широкое многообразие зарубежных и отечественных производителей вакцин, на данном этапе развития науки проблема эпизоотического благополучия хозяйств остается актуальной [9].
В настоящее время возрастает интерес к использованию в качестве профилактических средств против пастереллеза сельскохозяйственных животных и птиц живых вакцин, приготовленных из «рационально аттенуированных» штаммов бактерий. Повреждение генов, кодирующих патогенные детерминанты, приведет к получению аттенуированного штамма P. multocida. Во многих литературных источниках приводится альтернативный метод, обусловленный введением определенных ауксотрофных мутаций в ген AroA вирулентных штаммов пастерелл, что делает их авирулентными. Функция данного гена существенна для роста бактерий in vivo и для развития инфекционного процесса. На основе данного метода создан ряд коммерческих препаратов для профилактики пастереллеза КРС, буйволов и кур [12, 10]. При введении модифицированных таким образом пастерелл, в организме будут нарабатываться антитела защищающие животного от заражения вирулентными вариантами P. multocida. Кроме того, разрабатываются другие методы связанные с нарушением функций генов ompH, ОRF-15, которые значительно снижают вирулентность родительских штаммов P. multocida [5].
При появлении патологических процессов, гематологические, биохимические и иммунологические показатели крови изменяются. Большую роль в патогенезе пастереллез играют эндо и экзотоксины возбудителя, способные вызывать стойкие изменения в крови больных животных и одним из видов иммунной реакции характеризующих поствакцинальный иммунитет является гуморальный [8]. Также после вакцинации у животных изменяется интенсивность обменных процессов, что отражается на показателях крови и сыворотки крови. Кровь основной показатель гомеостаза организма, это связано с многократными и сложными функциями крови. По некоторым литературным данным [2, 4, 11] гематологический анализ позволяет судить о ходе инфекционного процесса, появлении осложнений и дает возможность предсказать исход заболевания. Поэтому важным тестом является определение превентивных свойств сывороток крови животных подвергшихся иммунизации.
Исходя из вышесказанных, целью нашей работы было изучение изменений со стороны крови у овец и коз при введении генетически аттенуированного мутанта Р. multocida Aro/A, для дальнейшего применения в разработке вакцины против пастереллеза.
Материалы и методы исследований
В работе использовали генетически мутированный штамм P. multocida Aro/A, облагающиеся стабильными биологическими свойствами и слабой вирулентностью, относящийся к сероварианту В [3].
Исследования проводили на МРС (три овцы и три козы) 12-18 месячного возраста весом 18-20 кг, которые предварительно были протестированы на возможное пастереллоносительство путем исследования сывороток крови в ИФА..
Микробную массу получили путем выращивания пастерелл на агаре (АСМА) при температуре 37 °С в течение 24-36 час. Из выросшей культуры P. multocida Aro/A готовили с физиологическим раствором (рН 7,4) иммунизирующую дозу путем серийных десятикратных разведений. Количество микробных клеток в бактериальных суспензиях определяли по стандарту мутности (10 Ед. ГИСК им. Тарасевича).
Животным вводили подкожно в подмышечную область в дозе 2,5×107 м.к. После вакцинации наблюдали за клиническим состоянием животных, измеряли температуру тела и учитывали местные поствакцинальные реакции.
Для гематологических исследований использовали анализатор фирмы ABACUS JUNIOR Vet, производства Германия. Кровь для исследования забирали в вакуутайнеры содержащие ЭДТА. Затем в течение одного часа определяли: число лейкоцитов, палочкоядерных и сегментоядерных нейтрофилов, моноцитов, лимфоцитов, CD4+ Т-хелп., CD8+Т-супр., CD3+ Т-лимф., CD20+В-лимф.
Для изучения влияния P. multocida Aro/A на гематологические и иммунологические показатели крови животных опытных и контрольных групп была отобрана цельная кровь и сыворотка крови до иммунизации, затем через 7, 14, 21, 28 и 42 сутки после вакцинации.
Результаты исследования и их обсуждение
По результатам исследования иммунного фона сывороток крови у не иммунизированных овец и коз показало что, они не имеют специфических антител к возбудителю пастереллеза.
Результаты изучения влияния иммунизации животных штаммом P. multocida Aro/A на иммунологические и гематологические показатели крови животных представлены на рис. 1 и в ниже представленной таблице.
При введении живых микробных клеток невосприимчивость животных к P. multocida Aro/A возникало через 7-10 суток, что соответствует с данными литературы [6]. Представленные данные на рис. 1 свидетельствуют о том, что рост антител в сыворотках крови иммунизированных животных отмечался на 14 сутки после вакцинации, также активность в ИФА составляло 1:3200. В контрольной группе изменение в титрах антител не наблюдалось. Среднее значение сывороток крови животных на наличие специфических антител к антигенам P.multocida Aro/A представлены в рис. 1.
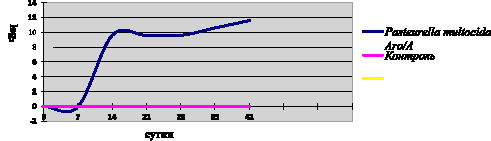
Рис. 1. Оценка иммунногенной активности штамма P. multocida Aro/A в ИФА
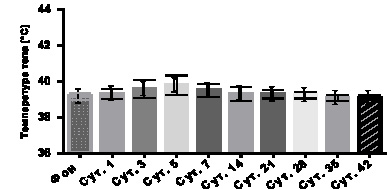
Рис. 2. Результаты термометрии после иммунизации мелкого рогатого скота штаммом P. multocida Aro/A
Общее состояние животных было удовлетворительное, отклонений со стороны работы пищеварительной, сердечно-сосудистой системы и органов дыхания выявлено не было, снижение аппетита не наблюдалось, животные хорошо принимали корм и воду. На месте введения наблюдалось небольшое покраснение, которое исчезло в течение двух суток.
Организм животного обладает высокой степенью саморегуляции для поддержания стабильной жизнедеятельности и физиологических показателей в пределах нормы. Отклонения температуры от нормы свидетельствуют о серьезных нарушениях в биохимических и биофизических процессах организма животного. На рис. 2, показаны результаты ежедневной ректальной термометрии животных.
Как видно из данных рис. 2, в контрольной группе и в группе иммунизированных животных резких отклонений от нормы не отмечено. Разница температуры тела между фоном и после иммунизации животных составило между (0,2 – 0,8) °С, пик термометрии достигало 40,1 °С. Последующие пять дней к концу эксперимента температура тела иммунизированных животных нормализовалась до пределов физиологической нормы.
Изменение картины периферической крови отражает функциональное сдвиги в различных органах и системах организма, поэтому ее изучение имеет важное значение для расшифровки иммуногенеза. В результате исследования периферической крови после иммунизации на 7 сутки наблюдалось увеличение количество лейкоцитов 8,0 ± 0,5 по сравнению с фоновым показателем. Динамика лейкоцитов на 14 сутки исследования показало увеличение, что составило 12,5 ± 2,0 %, а на 21 сутки исследования – 10,0 ± 2,0 % по сравнению с данными полученными на 7 сутки исследования. Количество палочкоядерных нейтрофилов (незрелых форм) увеличивается с 3,0 ± 1,0 % до 5,5 ± 1,0 %, при этом количество сегментоядерных (зрелых форм) нейтрофилов у животных уменьшается от 50,0 ± 6,0 % до 26,0 ± 2,0 % (таблица).
Результаты гематологического показателя периферической крови
|
Показатели |
Фон |
Сроки наблюдения (сутки) |
||||
|
7 |
14 |
21 |
28 |
42 |
||
|
Лейкоциты, % |
6,0-12,0 |
8,0 ± 0,5 |
12,5 ± 2,0 |
10,0 ± 2,0 |
5,0 ± 2,0 |
6,0 ± 2,0 |
|
Нейтрофилы п/я, % |
0,5-4,0 |
3,0 ± 1,0 |
5,0 ± 1,0 |
4,0 ± 1,0 |
5,5 ± 1,0 |
5,0 ± 1,0 |
|
Нейтрофилы с/я, % |
28,0-56,0 |
50,0 ± 6,0 |
36,0 ± 2,0 |
36,0 ± 2,0 |
34,0 ± 2,0 |
26,0 ± 2,0 |
|
Моноциты, % |
2,5-6,0 |
2,5 ± 1,0 |
4,0 ± 1,0 |
3,0 ± 2,0 |
1,5 ± 1,0 |
2,0 ± 1,0 |
|
Лимфоциты, % |
32,0-68,5 |
28,0 ± 8,0 |
24,0 ± 6,0 |
67,0 ± 2,0 |
42,0 ± 2,0 |
30,0 ± 1,0 |
|
CD4+ Т-хелп., % |
24,0 ± 1,0 |
25,0 ± 0,2 |
25,0 ± 2,0 |
24,5 ± 0,5 |
20,0 ± 1,0 |
20,0 ± 1,0 |
|
D8+ Т- супр., % |
28,0 ± 0,03 |
20,0 ± 0,20 |
17,0 ± 1,0 |
22,0 ± 1,0 |
22,0 ± 0,03 |
20,0 ± 2,0 |
|
CD3+ Т-лимф., % |
49,0 ± 0,50 |
53,0 ± 2,0 |
50,0 ± 0,01 |
54,0 ± 1,0 |
54,0 ± 1,00 |
55,0 ± 0,10 |
|
CD20+В-лимф., % |
8,0 ± 1,0 |
7,5,0 ± 1,0 |
8,0 ± 0,5 |
9,0 ± 1,0 |
8,0 ± 1,00 |
6,0 ± 1,00 |
Отмечается повышение лимфоцитов, что составляет 67,0 ± 10,0 %, этот показатель был два раза выше, чем у животных в контрольной группе. Число лимфоцитов у животных в контрольной группе составляло 32,0-6,5 %, на 7 и 14 сутки снизилось с 32,0 ± 68,5 % до 24,0 ± 6,0 % и наблюдается существенное повышение уровня количеств лимфоцитов в крови (67,0 ± 2,0) на 21 сутки. На 28-42 сутки количество палочкоядерных нейтрофилов увеличилось, а количество сегментоядерных нейтрофилов продолжало снижаться. Все гематологические показатели крови на 42 сутки были в пределах физиологической нормы, кроме лейкоцитов, лимфоцитов и моноцитов.
В результате эксперимента наблюдалось снижение лейкоцитов, моноцитов, лимфоцитов, CD4+ Т-хелперов и CD20+В-лимфоцитов.
Заключение
Анализируя данные полученные в ходе эксперимента при применении P. multocida Aro/A на мелких рогатых скотах установлена динамика: накопление титра антител в ИФА с 14 суток 1:800 до 42 суток 1:3200 и наблюдается увеличение количество лейкоцитов, моноцитов, лимфоцитов, CD3+ Т-лимф, CD20+В-лимф. в крови иммунизированных животных, которое достигает своего максимума к 14-21-му дню опыта. Данные показатели крови по нашим исследованиям были близки к показателям крови, полученным зарубежными исследователями [6]. У вакцинированных животных к концу срока наблюдения регистрировали увеличение в крови лимфоцитов (лимфоцитоз) и моноцитов (моноцитоз), что говорит о формировании противопастереллезного иммунитета у иммунизированных животных и показывает, что штамм P. multocida Aro/A вызывает потенциально протективный эффект в крови у животных и можно использовать при разработке вакцины против пастереллеза.
Резюмируя вышеуказанное следует, отметить, что при иммунизации овец и коз штаммом P. multocida Aro/A наблюдается активация как гуморального, так и клеточного иммунитета.
Библиографическая ссылка
Алиева А.Б., Нурпейсова А.С., Кайсенов Д.Н., Кошеметов Ж.К., Сугирбаева Г.Д., Касенов М.М., Далбаев Н.К., Баракбаев К.Б. ДИНАМИКА ИЗМЕНЕНИЯ ПОКАЗАТЕЛЕЙ КРОВИ У МЕЛКОГО РОГАТОГО СКОТА ПРИ ИСПОЛЬЗОВАНИИ ГЕНЕТИЧЕСКИ АТТЕНУИРОВАННОГО ШТАММА PASTEURELLA MULTOCIDA ARO/A // Международный журнал прикладных и фундаментальных исследований. 2017. № 4-3. С. 539-542;URL: https://applied-research.ru/ru/article/view?id=11510 (дата обращения: 16.02.2026).

