Физико-химические характеристики, отражающие имманентные свойства системы H2O-NH3-NH4Cl-ZnO, лежат в основе технологии извлечения соединений тяжелых цветных металлов, в частности цинка, из промышленных отходов черной и цветной металлургии, химической промышленности, производства вискозного волокна, пигментов, полиграфического производства методом аммиачно-аммонийного экстрагирования [3, 4, 5]. Актуальность работ по созданию технологии комплексной переработки отвалов шлаков, огарков, шламов определяется потенциальной ценностью отходов как вторичного сырья для цветной и черной металлургии, лакокрасочной промышленности, цементной и строительной индустрии, обеспечивающего ресурсосбережение, и возможностью улучшения экологической обстановки в районах хранения шлама, складирования отвалов огарка сернокислотного производства, свинцово-цинкового и других металлургических производств.
Цель исследования
Определение имманентных (внутренне присущих) характеристик комплексных растворов, образующихся при взаимодействии оксидов цинка с аммиачной водой, содержащей хлорид аммония, для разработки процесса утилизации промышленных отходов с получением оксида или металлического цинка.
Материалы и методы исследования
Химическое растворение оксида цинка в аммиачной воде, содержащей хлорид аммония, сопровождается образованием комплексных соединений, находящихся в растворе. Физико-химические свойства образовавшихся растворов, в частности: кислотность, плотность, вязкость, поверхностное натяжение, электропроводность изменяются в зависимости от количества молей растворенного оксида. Исходные растворы хлорида аммония в аммиачной воде готовили из аммиака водного квалификации «ЧДА» и аммония хлористого квалификации «ХЧ». Концентрацию исходных водных растворов аммиака рассчитывали по плотности [6] при температуре 293 К, плотность растворов измеряли пикнометром при термостатировании [2]. Растворение осуществляли в стеклянной емкости с плоским донышком, устанавливаемой на греющей поверхности магнитной мешалки модели ММ-5 с регулируемым числом оборотов перемешивающего цилиндрического магнита, запаянного в стекло. В емкость заливали 100 мл водного раствора с исходной концентрацией аммиака и хлорида аммония, включали мешалку и порциями по одному грамму, отмеренными с точностью до 4 знака, засыпали отсеянный через сито № 63 оксид цинка квалификации «ХЧ». Концентрацию растворенного оксида цинка оценивали по сумме навесок, внесенных в раствор, и определяли аналитически комплексонометрическим способом [1]. Изменение кислотности среды и температуру регистрировали с помощью прибора рН-150 МИ с электродом ЭСКЛ-06 М1 или ЭСК-106 и термодатчиком ТДЛ-1000.
Результаты исследования и их обсуждение
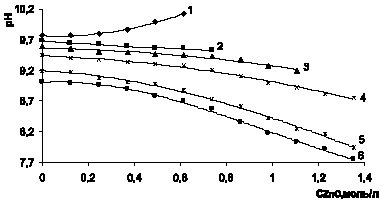
Рис. 1. Изменение рН в процессе растворения оксида цинка в аммиачно-аммонийном растворе 3,014 моль/л аммиака и хлорида аммония, моль/л: 1 – 0,93; 2 – 1,87; 3 – 2,80; 4 – 3,74; 5 – 4,67; 6 – 5,61
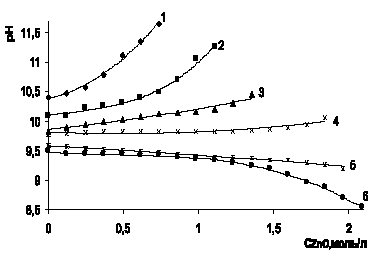
Рис. 2. Изменение рН в процессе растворения оксида цинка в аммиачно-аммонийном растворе для 5,71 моль/л аммиака при концентрации хлорида аммония, моль/л: 1 – 0,93; 2 – 1,87; 3 – 2,80; 4 – 3,74; 5 – 4,67; 6 – 5,61
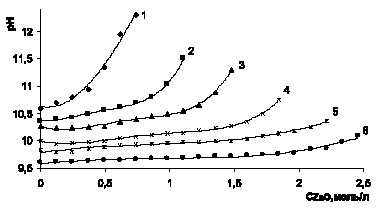
Рис. 3. Изменение рН в процессе растворения оксида цинка в аммиачно-аммонийном растворе для 8,56 моль/л аммиака при концентрации хлорида аммония, моль/л: 1 – 0,93; 2 – 1,87; 3 – 2,80; 4 – 3,74; 5 – 4,67; 6 – 5,61
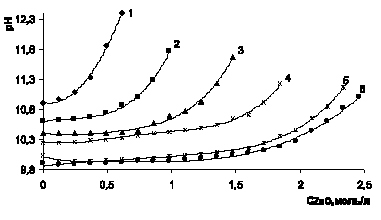
Рис. 4. Изменение рН в процессе растворения оксида цинка в аммиачно-аммонийном растворе для 11,4 моль/л аммиака при концентрации хлорида аммония, моль/л: 1 – 0,93; 2 – 1,87; 3 – 2,80; 4 – 3,74; 5 – 4,67; 6 – 5,61
Характер изменения рН – раствора в процессе образования аммина цинка в аммиачно-аммонийных растворах представлен на рис. 1–4, из которых следует, что исходный рН зависит от концентрации аммиака в аммиачной воде и количества растворенного хлорида аммония и соответствует расчетным значениям [1], определенным по формуле Гендерсона – Гассельбаха:
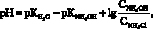 (1)
(1)
где КH2O – ионное произведение воды 1.10-14; КNH4OH – константа диссоциации гидрата аммиака, равная 1,76.10-5 при 293 К; СNH4OH – концентрация гидрата аммиака, моль/л; СNH4Cl – концентрация хлорида аммония, моль/л.
Количество внесенного оксида цинка определяет рН комплексного раствора в процессе взаимодействия:
ZnO + 2 NH4OH + 2 NH4Cl > > [Zn(NH3)4]Cl2 + 3 H2O. (2)
Из рис. 1 следует, что при концентрации хлорида аммония менее 1,87 моль/л кислотность раствора уменьшается и возрастает рН. Буферные свойства раствора, образованного слабым основанием и сильной кислотой, поддерживающие практически постоянный рН 9,7/9,5, проявляются при СNH4Cl = 1,87 моль/л, что соответствует отношению [NH3]:[NH4Cl] = 1,6:1. При более высокой концентрации хлорида аммония кислотность раствора при внесении оксида цинка увеличивается и рН становится меньше.
На рис. 2 для исходного раствора, содержащего 5,71 моль/л аммиака, постоянный рН раствора удерживается при концентрации хлорида аммония 3,74 моль/л, что соответствует соотношению молей аммиака и хлорида аммония 1,5:1. При большем исходном соотношении наблюдается рост рН, меньшем – возрастание кислотности и уменьшение рН.
В процессе растворения оксида цинка в 15 и 20 %-ном водно-аммиачном растворе (8,56 и 11,4 моль/л аммиака) изменение рН имеет сходный характер на всем интервале исследованной концентрации хлорида аммония от 0 до 5,61 моль/л (рис. 3, 4).
Устойчивое постоянство рН 9,75 – 9,8 в ходе растворения оксида цинка наблюдается в растворах с концентрацией 4,67; 5,61 моль/л хлорида аммония, до получения растворов, содержащих до 2 моль/л оксида цинка. При дальнейшем его растворении рН растет. Растворимость аммиачного комплекса зависит от растворимости гидроксида металла-комплексообразователя, диссоциации гидрата аммония на аммиак и воду, нестойкости аммиаката, гидролиза аммиака. Для указанных концентраций аммиака и хлорида аммония в исходном растворе соотношение 1,8:1 и 1,5:1 кривые 5 и 6 рис. 3 и 2,4:1 и 2,0:1 рис. 4.
При анализе протекающих процессов в соответствии с химическим уравнением 2, следует, что на моль дихлортетрааммина цинка требуется 1 моль оксида цинка, 2 моль аммиака и 2 моль хлорида аммония. Из рис. 1 (кривая 2) видно, что на растворенные 0,7 г-моль оксида цинка необходимы 1,4 моль аммиака, следовательно, избыток 1,6 моль аммиака и 0,47 моль хлорида аммония. Отношение аммиак: хлорид аммония растет (до 3,4), этим и объясняется рост рН раствора. При растворении больше 1 моль/л оксида цинка остаток аммиака 1 моль, хлорида аммония 1,74 моль, отношение 0,57, следовательно, рН снижается. На рис. 2 резкое снижение рН наблюдается после растворения 1,5 моль оксида цинка, остаток аммиака в этом случае 2,71 моль аммиака и 2,61 моль хлорида аммония, отношение приблизительно равно 1. Из рис. 3 видно, что на растворимость 1,5 моль оксида цинка расходуется по 3 моль аммиака и хлорида аммония, остаток аммиака 5,56 моль, хлорида аммония 0,74 моль, отношение 7,5, характеризует рост рН. Для растворения 2,5 моль оксида цинка остаток аммиака 3,56 моль, хлорида аммония 0,61 мол, отношение 5,8, что соответствует росту рН. Еще более интенсивный рост рН наблюдается на рис. 4 для раствора с исходной концентрацией аммиака 11,4 моль/л при отношении аммиака к хлориду аммония на момент растворения 2 г-моль на литр оксида цинка равном 7,0. Приведенные расчеты свидетельствуют, что оптимальные соотношения между аммиаком и хлоридом аммония в процессе растворения не сохраняются и целесообразно поддерживать [NH3]:[NH4Cl] = 1,5 ?2:1.
Поддержание оптимального соотношения количества аммиака и хлорида аммония в процессе растворения может быть осуществлено компенсацией израсходованного на образование тетрааммиаката хлорида аммония (рис. 5).
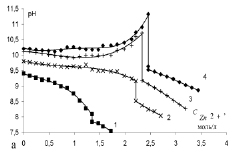
Рис. 5 Изменение рН аммиакатного раствора при растворении оксида цинка при донасыщении хлоридом аммония. Исходные концентрации аммиака, моль/л: 1 – 3,01; 2 – 5,83; 3 – 10,84; 4 – 12,52; хлорида аммония – 5,44 моль/л в пересчете на хлор-анион
Рис. 5 свидетельствует о положительном влиянии компенсации израсходованного хлорида аммония на образование комплексного соединения цинка. Количество добавляемого хлорида аммония рассчитывали, исходя из предположения протекания реакции по уравнению 2. На всех кривых при внесении хлорида аммония наблюдается скачок рН в сторону уменьшения, в результате растворимость оксида цинка значительно увеличивается в 1,4; 1,33; 1,28; 1,14 раза соответственно для кривых 4, 3, 2, 1. Это обусловлено тем, что катион аммония, образованный при диссоциации хлорида аммония, обладает, хотя и слабыми, но кислотными свойствами (рКа = 9,3). Образующийся при диссоциации иона аммония катион водорода способствует переходу оксида металла в гидроксид (рН водной суспензии оксида цинка 8,2 – 8,4), которые вступают в реакции комплексообразования с аммиаком:
Zn(OH)2(р-р) + 2NH3(р-р) - [Zn(NH3)2](OH)2(р-р). (3)
В дальнейшем, под действием хлорида аммония, происходит переход гидроксидных комплексов (по реакции 4) в хлоридные, термодинамически более устойчивые.
[Zn(NH3)2](OH)2 + 2NH4Cl - - [Zn(NH3)4](Cl)2 + 2H2O. (4)
Таким образом, при поддержании соотношения аммиак:хлорид аммония = 1,5:1 можно достичь растворимости оксида цинка более 3,5 моль/л (рис. 5 кривая 4) для концентрированного водно-аммиачного раствора 12,52 моль/л.
Выводы
1. Определены имманентные характеристики комплексных растворов, образующихся при взаимодействии оксидов цинка с аммиачной водой, содержащей хлорид аммония, для разработки процесса утилизации промышленных отходов с получением оксида или металлического цинка.
2. Определено влияние исходных концентраций аммиака и хлорида аммония на процесс растворения оксида цинка и характер изменения рН образующегося комплексного раствора.
3. Показана возможность повышения растворимости оксида цинка в результате компенсирования затраченного хлорида аммония на реакцию образования дихлоридтетрааммина цинка.
Библиографическая ссылка
Перетрутов А.А., Петровский А.М., Чубенко М.Н., Ким П.П., Зайцев Л.И. ИММАНЕНТНЫЕ СВОЙСТВА АММИАЧНО-АММОНИЙНЫХ ВОДНЫХ РАСТВОРОВ АММИАКАТОВ ЦИНКА // Международный журнал прикладных и фундаментальных исследований. 2017. № 6-1. С. 51-55;URL: https://applied-research.ru/ru/article/view?id=11620 (дата обращения: 31.12.2025).

