Вирус гриппа типа А (ВГА) является одним из важнейших инфекционных агентов человека и животных. Столь высокий потенциал ВГА связан с их быстрой эволюцией, в результате чего может повысить свою патогенность по отношению к птице и приобрести эпидемическую опасность [1]. Возбудителем болезни является ВГА семейства ортомиксовирусов, имеющих подтиповые варианты, которые устанавливаются двумя наружными белками – гемагглютинином (Н1-Н16) и нейраминидазой (N1-N10). Гемагглютинин и нейраминидаза являются факторами агрессии вируса гриппа. Интенсивность интоксикации при гриппе определяется свойствами гемагглютинина, а нейраминидаза обладает выраженным иммунодепрессивным действием. Оба поверхностных антигена характеризуются выраженной способностью к изменчивости, в результате чего появляются новые антигенные варианты вируса. Гемагглютинины 1, 2, 3-го типов и нейраминидазы 1, 2-го типов содержат вирусы, которые поражают человека. Другие антигены характерны для вирусов гриппа животных (свиней, собак, лошадей, многих видов птиц и др.) [2].
Эффективная борьба с ВГА невозможна без своевременной и достоверной серологической диагностики, а также проведения постоянного диагностического мониторинга эпизоотической обстановки, которые являются первоочередными задачами медицинской и ветеринарной служб.
Основная роль в диагностике и профилактике вирусных заболеваний принадлежит специфическим сывороточным препаратам, получаемым от различных животных – продуцентов [3]. Экспериментально доказано, что большое значение в получении активных и специфичных антисывороток имеют неспецифические стимуляторы антителообразования или адъюванты, а также доза и пути введения антигена [4].
В связи с этим получение высокоактивных и специфических диагностических препаратов к ВГА актуально в том плане, что появится возможность своевременного, высокоэффективного и точного типирования ВГА на территории Республики Казахстан.
Цель исследования
Выделение НА подтипов ВГА и на их основе получение диагностических препаратов.
Материалы и методы исследования
Вирус: В работе использовали штаммы А/утка/Альберта/35/76 (Н1N1), А/серебристая чайка/Атырау/2186/07 (Н2N2), А/утка/Германия/215/73 (Н2N3), А/чирок свистунок/Коргалжын/1797/06 (Н3N8), А/малая поганка/Алаколь/791/04 (Н4N6), А/домашний гусь /Павлодар/1/05(Н5N1), А/duch/Singapore-Q/F-119-2/97 (Н5N3), A/turkey/Massachusetts/3740/65 (Н6N2), А/цыпленок/Росток/29 (Н7N1) и А/черноголовый хохотун/Атырау/284/02 (Н13N6) ВГА, которые находятся в лаборатории «Коллекция микроорганизмов» РГП НИИПББ КН МОН РК. Данные штаммы были выращены в РКЭ согласно установленным регламентам [5].
Животные. В качестве доноров противогриппозных антител к подтипам ВГА служили кролики и козы местной породы в возрасте до одного года. Использование высокоспецифичных антисывороток, полученных от этих животных, рекомендовано Экспертным комитетом ВОЗ для уверенного антигенного субтипирования HА и NА ВГА, так как они дают самые минимальные неспецифические реакции [6].
Очистка суспензий ВГА. Вируссодержащую суспензию ВГА осветляли центрифугированием при 3000 об/мин, затем рН доводили до 8,5, и с целью концентрирования к суспензии добавляли ПЭГ-6000 до конечной концентрации 7 % и оставляли в течение 24 ч при 4 °C. Далее вирус осаждали центрифугированием при 5000 g в течение 1 ч. Затем вирус подвергали ультрацентрифугированию при 106000 g в течение 2 ч. Осадок вируса гомогенизировали и осветляли при 5000 g в течение 10 мин. Вирус при необходимости, очищали в градиенте плотности (20–60 %) сахарозы. Очищенный вирус ресуспендировали в 100-кратном объёме стерильного 0,05 М фосфатно-буферного раствора с рН 7,2–7,4.
Выделение HA+NA ВГА. Очищенные препараты ВГА разрушали тритоном в конечной концентрации 0,5 % в течение ночи при 4 °С. Для выделения фракции HA + NA, разрушенный вирус наслаивали на 25 % сахарозу и центрифугировали 1,5 часа при 250000 g при 4 °С. Верхний слой, над сахарозой, согласно методике, содержал фракцию очищенных поверхностных белков вируса гриппа (HA – NA). Далее фракцию HA – NA диализовали в течение 3 суток против 0,01М ФБС. Очищенный препарат должен содержать только HA – NA.
Разделение НА от NA. Очистку НА от NA проводили с помощью адсорбции на формалинизированных эритроцитах петуха в течение 10–15 мин при 4 °С. Элюция НА с эритроцитов осуществлялась теплым физиологическим раствором в течение 4–6 ч при 37 °С.
Получение антисывороток. Схема гипериммунизации кроликов состояла из 3 введений HA в возрастающей дозе (512, 1024 и 2048 ГАЕ/кг) в область надколенных лимфоузлов задних ног с интервалом между введениями в 1 неделю в комплексе с адъювантом ISA-71, в соотношении 1:1. За неделю до начала цикла гипериммунизации кроликам вводили, в область надколенных лимфоузлов задних ног по 0,5 мл HA+NA.
Схема гипериммунизации коз также состояла из 3 введений HA, в возрастающей дозе (512,1024,2048 ГАЕ/кг) в область предлопаточных лимфоузлов с интервалом между введениями в 1 неделю в комплексе с сапонином (2–3 введение). За 21 день до начала цикла гипериммунизации козам вводили HA в дозе 256 ГАЕ/кг массы тела.
Постановка РГА и РТГА. Гемагглютинирующую активность вируса определяли в РГА микрометодом по общепринятому методу [5].
Реакцию РТГА проводили микрометодом в 96-луночных планшетах фирмы «Costar» (США) согласно рекомендациям МЭБ [5].
Содержание белка определяли по методу Lowry [7], используя в качестве стандарта БСА фирмы «Sigma» (США).
Результаты исследования и их обсуждение
Как известно, препаративное выделение высокоочищенных антигенов вируса гриппа является одним из важнейших этапов получения диагностических иммунореагентов. Для очистки вируса из вируссодержащих суспензий нами был применен широко используемый метод осаждения и очистки вируса гриппа с помощью ПЭГ-6000 с последующим ультрацентрифугированием и осветлением. Результаты концентрирования белка и активности в РГА очищенных подтипов ВГА представлены на рис. 1 и 2.
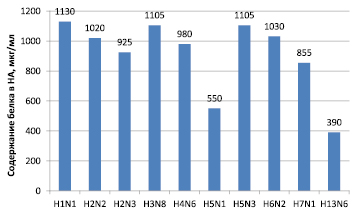
Рис. 1. Концентрация белков подтипов ВГА
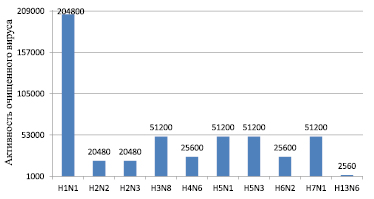
Рис. 2. Активность очищенных препаратов подтипов ВГА в РГА
Очищенный вирус представлял собой гомогенный препарат, гемагглютинирующая активность составляла 1:2560–2048000, при исходной активности вируса 1:512–1:1024, содержание белка 390–1130 мкг/мл. Очищенные препараты были использованы для выделения гемагглютинина и нейраминидазы.
Выделение гемагглютинина и нейраминидазы в чистом виде связано с определёнными трудностями. Оба антигена являются гликопротеидами и прикрепляются к липидной оболочке вируса последовательностями гидрофобных аминокислот.
Для снятия с поверхности вириона гликопротеинов ортомиксовирусов обычно используют большой спектр реагентов. Чаще других неионные детергенты Тритон Х-100, NP-40, Твин-20, эфир, ионный детергент додецилсульфат натрия (ДСН), а также бромелайн и n-октилглюкозид (октилглюкопиранозид, 1-O-n-octyl-β-d-glucopyranoside) [8].
В результате проведенных исследований было установлено, что оптимальным реагентом для получения чистого препарата НА ВГА оказался тритон Х-100.
Активность очищенных препаратов ВГА исследовали в РГА. Результаты представлены на рис. 3.
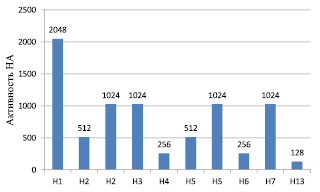
Рис. 3. Активность НА подтипов ВГА в РГА
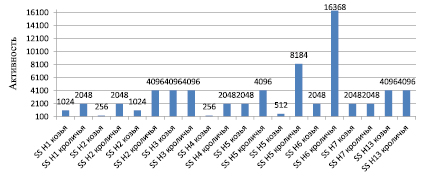
Рис. 4. Активность антисывороток к НА подтипов ВГА в РТГА
В результате очищенные препараты НА ВГА показали высокую гемагглютинирующую активность в РГА – с 1:128 до 1:2048. Очищенные препараты (НА) в дальнейшем были использованы для получения специфических сывороток к НА Н1, Н2, Н3, Н4, Н5, Н6, Н7 и Н13 ВГА на козах и кроликах.
В практике чаще всего применяют введение возрастающих доз антигена с интервалами в 4–5 и более дней. Способствует повышению иммунологической реактивности продуцентов гипериммунизация [4].
Через 7 суток после последней инъекции у коз и кроликов брали пробу крови и проводили контроль активности антителообразования в РТГА (рис. 4).
Как видно из рис. 4, активность антисывороток к НА, полученных на кроликах, составила в РТГА 1:256-1:16368, активность козьих антисывороток составила в РТГА 1:256-1:4096.
Полученные антисыворотки к НА Н1, Н2, Н3, Н4, Н5, Н6, Н7 и Н13 ВГА на козах и кроликах были проверены на специфичность и чувствительность методами ИФА (набор ФГБУ «ВНИИЗЖ») и РТГА (набор ОАО «Покровский завод биопрепаратов»). В результате опыта приготовленные препараты оказались пригодными для ИФА и РТГА для диагностики ВГА.
Заключение
В результате проведённых исследований, из концентрированных и очищенных препаратов штаммов ВГА А/утка/Альберта/35/76 (Н1N1), А/серебристая чайка/Атырау/2186/07 (Н2N2), А/утка/Германия/215/73 (Н2N3), А/чирок свистунок/Коргалжын/1797/06 (Н3N8), А/малая поганка/Алаколь/791/04 (Н4N6), А/домашний гусь /Павлодар/1/05(Н5N1), А/duch/Singapore-Q/F-119-2/97 (Н5N3), A/turkey/Massachusetts/3740/65 (Н6N2), А/цыпленок/Росток/29 (Н7N1) и А/черноголовый хохотун/Атырау/284/02 (Н13N6) вируса гриппа типа А были выделены и очищены гемагглютинин, и на основе НА были получены активные и специфичные сыворотки на козах и кроликах. Полученные препараты были апробированы методами ИФА (ФГБУ «ВНИИЗЖ») и РТГА (ОАО «Покровский завод биопрепаратов»).
Приготовленные препараты могут быть использованы в диагностических тест-системах (РТГА и ИФА) с целью типирования вируса гриппа типа А и для определения напряженности иммунитета.
Библиографическая ссылка
Исмагамбетов Б.М., Кошеметов Ж.К., Богданова М.И., Наханова Г.Д., Нурабаев С.Ш., Сейсенбаева М.С., Сансызбай А.Р., Касенов М.М. ПОЛУЧЕНИЕ ДИАГНОСТИЧЕСКИХ ПРЕПАРАТОВ К ПОДТИПАМ ВИРУСА ГРИППА ТИПА А // Международный журнал прикладных и фундаментальных исследований. 2017. № 10-2. С. 260-264;URL: https://applied-research.ru/ru/article/view?id=11900 (дата обращения: 03.03.2026).

