На сегодняшний день одной из наиболее актуальных проблем в медицине являются ожирение и сахарный диабет – две патологии, которые зачастую идут рука об руку, сопровождая пациента на пути к ранней инвалидизации и смерти, вызванной в первую очередь сердечно-сосудистыми заболеваниями.
За последние двадцать лет количество людей, страдающих ожирением, в мире увеличилось более чем в два раза [1]. Согласно прогнозам, при текущем темпе распространения ожирения к 2030 году более 60 % населения мира будут иметь избыточный вес или страдать ожирением [2]. По данным Всемирной Организации Здравоохранения, по всему миру ожирение является причиной смерти в 10–13 % случаев.
Висцеральное ожирение является важнейшим фактором, лежащим в основе инсулинорезистентности (ИР), которая, в свою очередь, является ключевым звеном развития СД.
На сегодняшний день в мире СД страдают 285 миллионов людей, 85–95 % которых составляют пациенты с СД 2 типа. Согласно прогнозам ВОЗ, к 2030 г. количество больных диабетом практически удвоится. [3] Необходимо отметить, что СД до настоящего времени остается медленно прогрессирующим заболеванием, при котором на фоне медикаментозной терапии целевой контроль достигается лишь у 30 % больных. Лечение ожирения с помощью фармакотерапии и диеты также не всегда эффективно.
В связи с этим методы бариатрической хирургии являются клинически значимой альтернативой в лечении этих заболеваний. Было установлено, что бариатрические операции (БО) с высокой частотой приводят к ремиссии сопутствующих ожирению метаболических нарушений, таких как дислипидемия и СД. Так, по данным мета-анализа Бухвальда, после бариатрических вмешательств отмечается снижение массы тела в среднем на 61,2 %. При этом ремиссия диабета отмечалась у 76,8 % больных, дислипидемии у 70 %, а артериальной гипертензии у 61,7 % [3]. Именно феномен ремиссии сахарного диабета после БО позволил ввести новое понятие – метаболическая хирургия.
Метаболический эффект БО обеспечивается как за счет ограничения поступления питательных веществ, так и за счет влияния БО на процесс секреции гастроинтестинальных гормонов (гормонов желудочно-кишечного тракта, ГИП). Наиболее значимым с точки зрения метаболизма является характерный для глюкагонподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) инкретиновый эффект. Он заключается в стимуляции выработки инсулина в ответ на пероральный прием глюкозы.
Действие ГИП не ограничивается влиянием на углеводный метаболизм; для них были доказаны разнообразные системные эффекты. На сегодняшний день наиболее изученными являются эффекты ГПП-1 и гормонов группы грелина (грелин, обестатин) [4]. Докладывают о цитопротективном действии ГПП-1 и грелина в отношении β-клеток поджелудочной железы, миокарда, [5] головного мозга, [6] гепатоцитов [7] и системы эндотелия [8]. Помимо цитопротективного, обширное рецепторное поле ГИП опосредует и иные плейотропные эффекты, в частности вазодилатационный. В отличие от действия фармакологических аналогов ГИП, БО приводит к устойчивому изменению профиля ГИП – снижению секреции одних и повышению уровня других ГИП, в зависимости от типа БО.
Цель: изучить влияние различных видов БО на устойчивость миокарда к ишемическому и реперфузионному повреждению в эксперименте в условиях физиологической нормы.
Материалы и методы исследования
В исследовании использовались крысы-самцы стока Wistar (самцы), m = 200 ± 50 грамм, которым выполнялась операция продольной резекции желудка (ПРЖ, группа ПРЖ) и илеотранспозиции (ИТ, группа ИТ). Операция ПРЖ выполнялась в связи с широким клиническим распространением, существенным послеоперационным снижением уровня грелина и умеренным повышением ГПП-1 в плазме крови. Выбор операции ИТ был обусловлен выраженным послеоперационным селективным повышением ГПП-1. Контрольной группе выполняли лапаротомию.
Через 4 недели после операции выполнялось моделирование ишемического и реперфузионного повреждения на изолированных сердцах крыс, перфузируемых методом Лангендорфа [9].
Оценка сократительной функции изолированных сердец
Параметры сократительной активности изолированных сердец регистрировали в изоволюмическом режиме с помощью введенного в полость левого желудочка латексного баллончика, соединенного с датчиком давления, встроенного в аппарат для физиологических исследований PhysExp (Кардиопротект, Россия). Баллончик заполняли дистиллированной водой, объем которой был достаточным для создания конечно-диастолического давления в левом желудочке на уровне 10 мм Hg. Оценку сердечной деятельности проводили регистрацией кривой внутрижелудочкового давления. Дальнейший расчет параметров сократимости изолированного сердца осуществляли с помощью оригинальной прикладной программы PhysExp.
Мониторирование физиологических показателей изолированных сердец осуществляли на всем этапе реперфузионного периода. Осуществляли мониторинг частоты сердечных сокращений (ЧСС, уд/мин), систолического артериального давления (САД, мм рт.ст.); давления, развиваемого левым желудочком (ДРЛЖ, мм Hg) (вычисляли как разницу между систолическим и диастолическим давлением), и интенсивности сократительной функции левого желудочка (характеризовали произведением ДРЛЖ на ЧСС, мм Hg/мин).
Оценка коронарного кровотока изолированных сердец
Критерием оценки коронарного кровотока изолированных сердец являлся коронарный проток (КП) – количество перфузата, протекающего через коронарные сосуды за одну минуту, мл/мин. Регистрацию коронарного протока проводили на 20-й минуте перфузии раствором Кребса – Хензеляйта (до ишемии, исходные показатели), на 5, 15, 30, 45 и 60 минутах реперфузионного периода.
Критерии исключения: из общего количества изолированных сердец, первоначально включенных в исследование, часть в дальнейшем была исключена на основании следующих критериев:
1. Технические ошибки при катетеризации изолированного сердца или неправильное введение баллончика.
2. Коронарный проток менее 7 и более 15 мл/мин.
3. Нарушения ритма.
4. ДРЛЖ менее 80 мм рт.ст.
5. Отрицательная динамика показателей в течение 20-минутного стабилизационного периода (ДРЛЖ, САД, ЧСС, КП) [10].
Ограничения данной работы
В рамках данной работы не производили оценку влияния отдельных видов БО на устойчивость миокарда к ишемическим и реперфузионным повреждениям на модели сахарного диабета и ожирения. В ходе исследования оценивался суммарный эффект формирующего профиля гормонов после выполненных БО (оценка уровня отдельных гастроинтестинальных гормонов не производилась).
Статистическая обработка результатов
Статистическая достоверность различий функциональных данных в каждой временной точке оценивалась с помощью программного пакета STATISTICA 10.0 и непараметрического критерия Манна – Уитни. Все функциональные данные выражались в виде «среднее и ошибка среднего». Значения р < 0,05 рассматривались как достоверные.
|
|
|
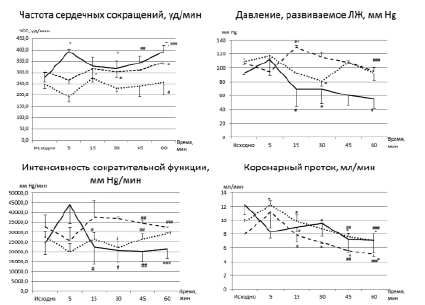
Влияние различных типов БО на гемодинамические показатели изолированных сердец крыс. * P < 0,05 относительно исходного уровня (до ишемии), # P < 0,05 относительно 5 минуты реперфузионного периода, ## P < 0,05 относительно 5 и 30 минут реперфузионного периода, ### P < 0,05 относительно 5, 30, 45 минут реперфузионного периода
Результаты исследования и их обсуждение
Исходные (доишемические) показатели сократительной активности и КП изолированных сердец во всех исследуемых группах статистически не различались (р > 0,05) (рисунок). На данном этапе эксперимента изолированные сердца исследуемых групп демонстрировали следующие показатели сократительной активности: САД составляло 113,5 ± 3,3 мм Hg, ДРЛЖ – 104,2 ± 3,5 мм Hg, ИСФ – 27862,7 ± 6767 мм Hg/мин, ЧСС – 274,4 ± 17 уд/мин, КП – 10,5 ± 0,7 мл/мин.
В начале реперфузионного периода в группе контроля отмечалось частичное восстановление параметров сократительной функции. Так, САД в данной группе на указанном этапе составляло 115 ± 13 мм Hg, ДРЛЖ – 117,3 ± 4,3 мм Hg, ИСФ – 44008,0 ± 9846 мм Hg/мин, ЧСС – 391,3 ± 11,6 уд/мин, КП – 8,3 ± 0,9 мл/мин. Однако на момент окончания реперфузии наблюдалось снижение сократительной активности сердец данной группы. САД в группе контроля на данном этапе составляло 76 ± 16 мм Hg, ДРЛЖ – 55,5 ± 13,0 мм Hg, ИСФ – 21577,5 ± 5269 мм Hg/мин, ЧСС – 393,0 ± 26,0 уд/мин, КП – 7,1 ± 1,9 мл/мин. Снижение сократительной активности сердец группы контроля обусловлено альтерирующим влиянием факторов реперфузии и реоксигенации.
Сердца групп ПРЖ и ИТ на начальном этапе реперфузионного периода демонстрировали равную степень восстановления параметров сократительной активности: САД составляло 105,3 ± 17,8 мм Hg (группа ПРЖ) и 126 ± 4 мм Hg (группа ИТ) соответственно (р > 0,05 между группами, по сравнению с контролем). ДРЛЖ составляло 94,5 ± 18 мм Hg (группа ПРЖ) и 117,3 ± 4,3 мм Hg (группа ИТ) соответственно (р > 0,05 между группами, по сравнению с контролем); ЧСС составляла 267,3 ± 16,8 уд/мин и 194,5 ± 24,4 уд/мин (р > 0,05 между группами, по сравнению с контролем); КП составлял 11,2 ± 2,3 (группа ПРЖ) и 12,3 ± 0,5 (группа ИТ) мл/мин (р < 0,05 по сравнению с контролем).
В динамике реперфузионного периода в изолированных сердцах групп ПРЖ и ИТ наблюдалось постепенное снижение эффективности гемодинамики в виде снижения САД и ДРЛЖ, (р < 0,05 по сравнению с контролем). КП во группах ПРЖ и ИТ равномерно снижался, достоверных различий между группами выявлено не было. (р < 0,05)
Сердца групп ПРЖ и ИТ к концу реперфузионного периода демонстрировали схожие параметры сократительной активности. В указанный момент САД в группах составило: в группе ПРЖ – 97 ± 8 мм Hg, в группе ИТ – 102 ± 9,8 мм Hg (р > 0,05 между группами). ДРЛЖ находилось на схожем уровне: в группе ПРЖ – 95,2 ± 5,6 мм Hg, в группе ИТ – 92,6 ± 10 мм Hg. (р > 0,05). ЧСС составляла для групп ПРЖ и ИТ 345 ± 9 уд/мин и 257,8 ± 57 уд/мин (р > 0,05 между группами, по сравнению с контролем); КП составлял 5 ± 0,3 (группа ПРЖ) и 7,1 ± 0,7 (группа ИТ) мл/мин. (р > 0,05 между группами, по сравнению с контролем).
Таким образом, выполненные бариатрические операции ПРЖ и ИТ не обусловливают выраженного протективного эффекта в отношении ишемизированного и реперфузируемого миокарда.
Как известно, инкретины обеспечивают до 70 % постпрандиальной секреции инсулина у здоровых людей, в то время как у больных СД2 вклад инкретинов в стимуляцию секреции инсулина снижен до 40 %. В ранних исследованиях было показано, что сниженный уровень (ГПП-1) и инкретинового ответа являются следствиями сахарного диабета, были получены данные, демонстрирующие снижение уровня (ГПП-1) у больных с СД2 [11]. Тем не менее в ряде последующих исследований были получены противоречивые результаты, а по данным двух мета-анализов [12, 13] разницы в уровне ГПП-1 на фоне стимуляции у здоровых и больных СД2 получено не было.
Вероятно, отсутствие кардиопротективного эффекта может быть обусловлено исходно физиологическими уровнями ГПП-1 до выполнения БО и отсутствием значимого в отношении ишемизированного миокарда в условиях нормы. Также может иметь значение тот факт, что при ПРЖ единственным источником грелина остается двенадцатиперстная кишка, секреторного потенциала которой недостаточно для осуществления кардиопротекторного эффекта.
Заключение
Полученные результаты показали отсутствие выраженного влияния ПРЖ и ИТ на устойчивость миокарда к ишемическому и реперфузионному повреждению в опытах ex vivo в условиях отсутствия метаболических изменений, характерных для ожирения и СД2. Полученные результаты обусловливают целесообразность дальнейшего изучения кардиопротективного влияния различных типов бариатрических операций в условиях in vivo на моделях ожирения и СД2.
Работа выполнена на средства гранта РФФИ № 16-34-01079\17 «Влияние изменения профиля гормонов желудочно-кишечного тракта после бариатрических операций на устойчивость миокарда к ишемическому и реперфузионному повреждению».
Библиографическая ссылка
Семикова Г.В., Торопова Я.Г., Корнюшин О.В., Берко О.М., Глистенкова Д.Д., Краснюк К.В., Минасян С.М. ИССЛЕДОВАНИЕ ВЛИЯНИЯ БАРИАТРИЧЕСКИХ ОПЕРАЦИЙ НА УСТОЙЧИВОСТЬ МИОКАРДА К ИШЕМИЧЕСКИМ И РЕПЕРФУЗИОННЫМ ПОВРЕЖДЕНИЯМ В ЭКСПЕРИМЕНТЕ // Международный журнал прикладных и фундаментальных исследований. 2017. № 12-1. С. 89-93;URL: https://applied-research.ru/ru/article/view?id=11969 (дата обращения: 28.12.2025).



 Контроль
Контроль Продольная резекция желудка
Продольная резекция желудка Илеотранспозиция
Илеотранспозиция