Несмотря на значительный прогресс сосудистой хирургии в последнее десятилетие, лечение больных с тяжелой ишемией нижних конечностей, обусловленной окклюзионными поражениями артерий бедренно-подколенно-берцовых сегментов, остается одной из актуальных проблем [1]. Методом выбора в большинстве случаев реконструктивных вмешательств на артериях среднего и малого калибра считают пересадку аутовенозного трансплантата. Аутовена обладает лучшей проходимостью в отдаленном периоде по сравнению с протезом при инфраингвинальных реконструкциях. В отделении сосудистой хирургии Национального научного центра онкологии и трансплантологии (ННЦОТ) г. Астана, Казахстан, в период с 2010 по 2017 г. находились на лечении 453 больных с поражениями поверхностной бедренной артерии. Среди них часть имела поражения подколенной и тибиальных артерий. Двусторонние окклюзии имели место у 145 (32 %) лиц. Средний возраст больных с атеросклерозом составил 54 ± 3,5 лет. Всем им были выполнены реконструктивные операции на артериях в большинстве наблюдений с применением большой подкожной вены, которая является наиболее благоприятным кондуитом при бедренно-подколенном шунтировании [2, 3]. Гистоморфологические свойства этой вены довольно вариабельны. В большой подкожной вене могут встречаться возрастные и варикозные изменения [4, 5], патологические процессы в связи с диабетом [6]. Также немаловажную роль среди причин нарушения функций венозных трансплататов играет травмирование ее стенки при выделении вены [7, 8].
Цель исследования
Изучить возрастные, патологические и травматические структурные изменения в большой поверхностной вене после выделения ее открытым способом перед формированием анастомоза для мониторинга шунта в отдаленном периоде.
Материалы и методы исследования
Наилучшим методом оценки состояния вены служит дуплексное ультразвуковое исследование, которое позволяет определить размер вены, анатомические изменения, проходимость. С целью определения состояния большой подкожной вены в качестве будущего трансплантата для пораженного артериального бассейна она исследовалась с помощью ультразвуковой доплерографии. Определялись диаметр вен и функциональное состояние терминального клапанного аппарата. Полученные данные анализировались с учетом длительности заболевания. У некоторых пациентов исследовалось морфологическое строение кусочка имплантируемой вены. Изучению подвергался дистальный участок вены при ее выделении открытым способом, препараты фиксировали, заливали в парафин, готовили поперечные срезы с последующей окраской гематоксилином и эозином, фуксилином по Харту и пикрофуксином по Ван-Гизону. Определялся характер и выраженность возрастных и патологических процессов в интиме, медии, адвентиции. В зависимости от степени выраженности указанные изменения описывались как очаговые, умеренно выраженные либо выраженные, При анализе полученных данных учитывали следующие факторы: длительность заболевания и возраст пациентов.
Результаты исследования и их обсуждение
Большая подкожная вена, являясь, в отличие от глубоких вен, сосудом мышечного типа, свободно располагающимся в подкожной клетчатке, изолированно относительно подлежащего мышечно-фасциального пространства, отвечает на меняющуюся гемодинамическую нагрузку в значительной степени за счет своего собственного тонуса и эластических свойств, которые обеспечиваются нормальным функционированием соединительнотканного и гладкомышечного матрикса сосудистой стенки. Определение, по данным ультразвукового сканирования, основных анатомических и функциональных характеристик магистральных поверхностных вен нижних конечностей показало, что в ряде наблюдений имеется дилатация просвета и несостоятельность терминального клапанного аппарата уже на ранних сроках заболевания. Также нередко имело место и умеренное снижение значения индекса эластичности, относительно максимальных значений по мере увеличения длительности патологии. Полученные данные могут косвенно указывать на патологические изменения стенки БПВ, снижающие возможность мышечно-эластического каркаса регулировать объем вены при повышении трансмурального давления.
Известно, что при выделении вены и ее подготовке к имплантации вследствие даже микроскопического травмирования в эндотелиальном слое и субэндотелии возникают межклеточный отек, десквамация эндотелия и кровоизлияния. Нами проведена оценка уровня травматического воздействия на стенку вены. Почти у трети больных мы наблюдали эрозию эндотелия с адгезией форменных элементов крови, иногда надрывы внутренней оболочки в пределах субэндотелиального слоя и расслоения стенки вены без видимых повреждений (рис. 1). Таким образом, интраоперационные манипуляции с веной до ее анастомозирования могут приводить к повреждениям, которые играют определенную роль в будущем стенозе трансплантата.
У лиц пожилого возраста подкожные вены нижних конечностей могут быть варикозно измененными. Даже если вена макроскопически выглядит нормальной, в ней могут быть утолщения внутренней и средней оболочек, что неблагоприятно влияет на их проходимость. Нами изучены возрастные и патологические изменения стенки большой подкожной вены после ее извлечения для последующей трансплантации. В результате морфологического анализа у всех больных, включенных в исследование, и возраста пациентов выявлены признаки структурной перестройки сосуда. Возрастные изменения характеризовались наличием волнообразных складок внутренней оболочки. В ней сохранялся однорядный эндотелий с тонким подлежащим субэндотелиальным слоем, в котором отмечалось некоторое огрубение соединительнотканных структур. Местами она имела утолщения с замещением эластических волокон на коллагеновые. Средняя оболочка содержала циркулярно расположенные пучки гладкомышечных клеток без гипертрофии мышечных элементов, или имела место незначительная гипертрофия циркулярно-расположенных гладких мышечных клеток с огрубением соединительнотканных структур (рис. 2). Нередко отмечалась большая степень развития коллагеновых волокон, появление сети коллагеновых волокон на границе между внутренней и средней оболочками по всему периметру сосуда. Эластические волокна в средней оболочке были в основном не изменены, лишь иногда выявлялась их фрагментация. В наружной оболочке выявлялись продольные пучки гладких миоцитов, обычной толщины при отсутствии склеротических изменений и определялись достаточно толстые, преимущественно интактные эластические волокна, многочисленные vasa vasorum.
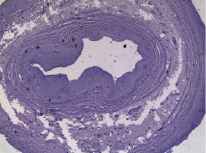
Рис. 1. Расслоение средней оболочки большой подкожной вены. Окр. гематоксилином и эозином. Ув. 80
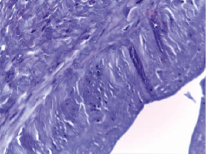
Рис. 2. Очаговые склеротические изменения внутренней оболочки большой подкожной вены. Окр. гематоксилином и эозином. Ув. 400
Морфологическая оценка патологических изменений выявила сочетание явлений склероза, гипертрофии и в ряде случаев признаки атрофии. Внутренняя оболочка имела неравномерную толщину: в одних участках утолщена из-за склероза, в других – несколько атрофичная. Эндотелиальный слой был выражен не везде, иногда эндотелиоциты отсутствовали на большом протяжении. субэндотелиальный слой утолщен. В мышечном слое интимы обнаруживались достаточно значительной толщины коллагеновые волокна, зачастую замуровывавшие отдельные пучки гладких миоцитов. Миоциты выглядели атрофичными. В отдельных сосудах в кольцевидных утолщениях интимы формировались бляшковидные фиброзно-эластические выступы. Из-за интенсивного разрастания плотной соединительной ткани средняя оболочка была расслоена, при этом миоциты сохраняли свою ориентацию и формировали слои. Гладкомышечные клетки были неравномерно гипертрофированы и муфтообразно окружены коллагеновыми волокнами (рис. 3). В адвентиции отмечались утолщение, склерозирование, наличие продольных пучков гладких миоцитов разной толщины. Отмечался значительно выраженный эластолиз. При этом во внутренней оболочке сплетение этих волокон определялось только в отдельных участках, на остальном протяжении имел место их распад. В средней и наружной оболочках определялся выраженный распад эластических волокон на фрагменты. В адвентициальных сосудах как артериального, так и венозного звеньев при данном варианте изменений стенки вены также отмечались значительные структурные преобразования в виде гипертрофии мышечных слоев с фиброэластозом. Таким образом, большая подкожная вена, используемая в качестве аутотрансплантата при операциях аутовенозного бедренно-подколенного шунтирования, может иметь различную степень исходной структурной перестройки, обусловленной как возрастными, так и патологическими изменениями.
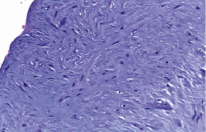
Рис. 3. Гипертрофия миоциотов, склеротические изменения средней оболочки большой подкожной вены. Окр. гематоксилином и эозином. Ув. 400
Механизм и морфология поражения аутовенозных шунтов могут быть различными: в аутовенозных шунтах в разные сроки после операции могут происходить различные процессы: тромбоз и гиперплазия интимального слоя, атероматоз. Как только на аутовенозный трансплантат начинает действовать артериальный кровоток, происходит десквамация эндотелия особенно в зоне анастомоза. В этом месте фиксируются тромбоциты и образуется тромб. В течение последующих нескольких суток он созревает. Гиперплазия интимы обусловлена повреждением интимы во время шунтирования. Она характеризуется пролиферацией и миграцией гладкомышечных клеток из средней оболочки в интиму. По мере увеличения сроков после операции происходят так называемая «артериализация» венозного шунта и гиперплазия его интимы. Шунт обретает необходимые для полноценного кровотока адаптационные механизмы, но становится подверженным атеросклеротическому повреждению не в меньшей степени, чем нативное артериальное русло. В ближайшем периоде не происходит атеросклеротического перерождения венозных шунтов, и основная причина их закрытия – тромботическая окклюзия. В отдаленном периоде, напротив, преимущественно атеросклеротические изменения «артериализированного» венозного русла могут приводить как к окклюзии, так и к стенозу шунта. Анализ непосредственных результатов осуществлялся нами на основании данных клинического осмотра и ультразвуковой доплерографии. Тромбоз развился у 5,8 % больных с атеросклерозом в первые часы после операции. Одной из причин тромбоза у 32 % человек была эмболия фрагментов атероматозных бляшек в дистальное русло. Это можно связать с отрывом или надрывом фрагмента измененной интимы вследствие грубой манипуляции с пораженными бедренными артериями в результате неоднократного пережатия их зажимами, попытка эндартерэктомии с оставлением в просвете свободных фрагментов бляшек, выдавливания атероматозного фрагмента из устья коллатерали при ее перевязке или пережатии и т.д. Причины тромбозов в раннем послеоперационном периоде обусловлены тактическими и техническими погрешностями и носят ятрогенный характер. Следует иметь в виду, что меньшая упругость венозной стенки по сравнению с артериальной стенкой не позволяет адаптироваться к условиям повышенного артериального давления и обеспечивать оптимальную скорость кровотока через шунт, что способствует замедлению кровотока и повышенному тромбообразованию. У 231 (51 %) пациента дистальный анастомоз был сформирован выше щели коленного сустава, у других 222 (49 %) больных дистальный анастомоз был наложен с подколенной артерией ниже щели коленного сустава. При сравнении частоты ранних послеоперационных тромбозов в обеих группах отмечено, что частота тромбозов в группе больных, которым анастомоз был выполнен выше щели коленного сустава ниже, чем у лиц, которым дистальный анастомоз был выполнен ниже (3,9 % против 5,0 %) р < 0,05. Анализ отдаленных результатов осуществлялся на основании данных клинического осмотра и ультразвуковой доплерографии. Пятилетняя проходимость шунтов составила 64 %, семилетняя – 43 %.
Заключение
Ультразвуковое сканирование магистральных поверхностных вен нижних конечностей показало у 30 % больных дилатацию просвета и несостоятельность терминального клапанного аппарата уже на ранних сроках заболевания и умеренное снижение значения индекса эластичности относительно максимальных значений. Возрастные изменения стенки большой подкожной вены характеризовались огрубением соединительнотканных структур в субэндотелиальным слоем внутренней оболочки, которая местами имела утолщения с замещением эластических волокон на коллагеновые. Морфологическая оценка патологических изменений выявила сочетание явлений склероза, гипертрофии и в ряде случаев признаки атрофии и эластолизиса. Внутренняя оболочка имела неравномерную толщину: в одних участках утолщена из-за склероза, в других – несколько атрофичная. Средняя оболочка была расслоена, гладкомышечные клетки были неравномерно гипертрофированы и муфтообразно окружены коллагеновыми волокнами. При выделении вены, вследствие ее травмирования, в эндотелиальном слое и субэндотелии возникают отек, десквамация эндотелия и кровоизлияния, которые могут играть определенную роль в будущем стенозе трансплантата. Проведенные исследования могут играть определенную роль при определении влияния факторов риска для улучшения результатов хирургического лечения больных с поражением бедренно-подколенного артериального сегмента в инфраингвинальной позиции.
Библиографическая ссылка
Куркин А.В., Сагандыков И.Н., Калдыбаев М.М., Сагандыкова А.И. МОРФОЛОГИЯ АУТОВЕНОЗНОГО ТРАНСПЛАНТАТА ДЛЯ ФОРМИРОВАНИЯ АРТЕРИАЛЬНОГО БЕДРЕННО-ПОДКОЛЕННОГО ШУНТА // Международный журнал прикладных и фундаментальных исследований. 2018. № 1. С. 68-71;URL: https://applied-research.ru/ru/article/view?id=12067 (дата обращения: 11.02.2026).

