В настоящее время пробиотики являются неотъемлемым компонентом лечения и профилактики широкого спектра нозологических форм заболеваний и могут использоваться как в качестве дополнительного лечебного средства, так и в качестве пробиотической составляющей диеты. В связи с этим вопрос разработки и внедрения в клиническую практику современных пробиотиков в виде БАД к пище не теряет своей актуальности.
«LB-комплекс Л» представляет собой жидкий сорбированный синбиотик IV поколения, в качестве стартерных культур которого использованы штаммы Lactobacillus plantarum, Lactobacillus fermentum, Bifidobacterium bifidum, Bifidobacterium longum, иммобилизованные на матрице-носителе – цеолите. Композиция штаммов подобрана с учетом их пробиотического потенциала и биологических свойств: антагонистической активности, устойчивости к низкой рН желудочного сока и действию желчных кислот, адгезивных свойств, антибиотикорезистентности нетрансмиссивного типа и биосовместимости [1].
Цеолит, использованный в качестве сорбента-носителя, разрешен для использования в медицинской практике (№ KZ 16.01.76.003.Е.004706.08.15) [2]. Питательная основа, содержащая гидролизат пищевого казеина и пребиотическую составляющую – фруктоолигосахарид раффинозу, не обладает иммуногенностью, что обеспечивает хорошую переносимость пробиотика [3–5].
Тем не менее, клинические испытания и дальнейшее применение нового пробиотика в форме БАД к пище невозможны без этапа доклинической апробации, в процессе которой должна быть установлена его безопасность. Это связано с тем, что свойства многокомпонентных мультиштаммовых пробиотиков могут отличаться от свойств отдельных составляющих – сорбента, штаммов-продуцентов и питательной основы.
Согласно общей фармакопейной статье «Безопасность пробиотиков в тестах in vivo» для определения безопасности испытуемого препарата используют биологические методы in vivo, которыми определяют следующие показатели: безвредность, вирулентность, токсичность, токсигенность [6]. МУК 4.2.2602-10 также регламентирует проведение тестов на острую и хроническую токсичность и местно-раздражающие свойства пробиотика [7].
Материалы и методы исследования
Установление безопасности пробиотической БАД к пище «LB-комплекс Л» включало в себя изучение безвредности, вирулентности, токсигенности, токсичности, в том числе острой и хронической, и местно-раздражающего действия. Определение безвредности, вирулентности, токсигенности, острой и хронической токсичности проводили согласно МУК 4.2.2602-10 «Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков», местно-раздражающее действие оценивали согласно ГОСТ 1.12.007-76 [7, 8].
Экспериментальной моделью для изучения безопасности БАД к пище служили мелкие лабораторные животные – белые мыши SH -линии обоего пола, массой тела 10,0–14,0 г; морские свинки массой тела 250,0–400,0 г; кролики породы шиншилла массой тела 2,5–3,5 кг. Группы животных формировались по массе тела и возрасту. Животные содержались в виварии на стандартном рационе, который содержал все необходимые для нормальной жизнедеятельности животных компоненты согласно ИСО 10992 от 02.12.2009 г. Всего было сформировано 13 групп состоящих из 95 мышей, 6 морских свинок и 3 кроликов породы шиншилла, 10 экспериментальных и 3 контрольные группы. Было проведено 7 серий экспериментов.
На начальном этапе работы было определено количество живых микроорганизмов-продуцентов в готовой форме БАД и титруемой кислотности по Тернеру (МУК 4.2.577-96, МУК 4.2.2602-10) [7, 9].
Для определения безвредности и «острой токсичности» были сформированы опытные группы 10 и 11 по 5-ти животных в каждой. Отбирали клинически здоровых белых мышей, средний вес животных составлял 15,0 ± 5 г. Взвесь биологически активной добавки в концентрации 108–109 КОЕ/мл в объеме 0,5 мл вводили каждой мыши перорально при помощи зонда. За 2 часа до манипуляций у животных убирались корм и вода, кормление возобновлялось через 2 часа после проведения процедуры. В качестве контроля контрольной группе перорально вводили физиологический раствор (С080812 годен до 09.2017 г.). Наблюдение за мышами осуществлялось в течение 7 суток. Во время опыта ежедневно фиксировались вес и состояние животных.
Для определения вирулентности были сформированы 3 группы по 10 мышей в каждой: 2 опытные и 1 контрольная группа (масса тела мышей 10–14 г). Биологически активную добавку вводили животным перорально в концентрации 109 КОЕ/мл (первая опытная группа) и 108 КОЕ/мл (вторая опытная группа) в объеме 0,5 мл. Контрольной группе был введен перорально физиологический раствор (С080812 годен до 09.2017) по 0,5 мл. Наблюдение за животными осуществлялось в течение 14 суток, ежедневно в протоколе отмечалось количество павших и выживших животных.
Для определения токсигенности была сформирована опытная группа из 10-ти клинически здоровых белых мышей, средний вес которых составлял 13,1 ± 1 г.
Для накопления возможных токсических продуктов проводили культивирование 20 % посева пробиотика (10 мл продукта в 200 мл стерильной бифидум-среде) в течение 10 дней в термостате при 37,5 ± 1 °С, при этом кислотность увеличилась до 100 ° Т, а количество жизнеспособных колониеобразующих единиц снизилось до 3×106 КОЕ/мл. Далее центрифугировали полученную культуру при 5000 об/мин в течение 20 минут при температуре 4 ± 2 °С. Надосадочную часть образцов фильтровали через апирогенные фильтры Minisart® (Sartorius Stedium Biotech) с диаметром пор 0,20 μm для удаления остатков бактериальной массы. Далее, каждому животному вводили 0,5 мл фильтрата (в котором должно было содержаться 1,5×106 КОЕ) внутрибрюшинно, время наблюдения составляло 14 суток. Ежедневно фиксировали состояние животных, активность, окраску слизистых оболочек, массу тела, характер стула. Контрольной группе был введен физиологический раствор (С080812 годен до 09.2017) внутрибрюшинно по 0,5 мл.
Для определения токсичности была сформирована опытная группа из 10-ти клинически здоровых белых мышей, средний вес животных составлял 15,0 ± 1 г.
Для инактивации бактерий пробиотик в объеме 75 мл прогревали на водяной бане при температуре 110 °С в течение 10 минут. После охлаждения до комнатной температуры продукт центрифугировали при 5000 об/мин в течение 20 минут при температуре 4 ± 2 °С, надосадочную жидкость собирали в стерильную центрифужную пробирку. Отсутствие роста в надосадке подтверждали путем высева на полужидкую питательную бифидум-среду с последующей инкубацией при 37 °С в течение трех суток.
Прогретый препарат в нативном виде вводили внутрибрюшинно животным в объеме 0,5 мл. Каждому животному опытной группы было введено 109 КОЕ/мл. Наблюдение за животными осуществляли 14 дней. Ежедневно фиксировали состояние животных, состояние шерсти, активность, окраску слизистых оболочек, массу тела, характер стула. Контрольной группе был введен физиологический раствор (С080812 годен до 09.2017) внутрибрюшинно по 0,5 мл. Следует отметить, что контрольная группа была сформирована из 10-ти мышей и являлась контролем одновременно в экспериментах по определению вирулентности, токсигенности, токсичности, так как они проводились параллельно в один отрезок времени.
Для определения хронической токсичности сформировали опытную группу из 20 животных, которые получали брикетированный корм производства ООО «Лабораторкорм», предназначенный для лабораторных животных, и воду. Пробиотик вводили перорально 1 раз в сутки в течение 30 дней в дозе, эквивалентной рекомендуемой суточной дозе в качестве биологически активной добавки к пище для человека (для мышей весом 14 г – 0,5×107 КОЕ). Животным контрольной группы вводили перорально физиологический раствор (С080812 годен до 09.2017 г).
Наблюдения за животными проводили в течение периода введения препарата – 30 дней и последующие 7 суток. Ежедневно фиксировали состояние животных, состояние шерсти, активность, окраску слизистых оболочек, массу тела, характер стула.
После окончания опыта проводили забой животных хлороформным наркозом, осуществляли вскрытие и осмотр и взвешивание внутренних органов, определяли «коэффициент массы внутренних органов» делением массы органа в миллиграммах на массу тела в граммах. Согласно ГОСТ Р 50855-96 в случае получения достоверной разницы между опытной и контрольной группами по двум из исследуемых показателей – добавка признается токсичной.
Местно-раздражающее действие оценивали на кроликах (3 особи) при многократных аппликациях, наносимых окклюзивно в течение 14 дней на предварительно выстриженных участках кожи размером 8×9 см согласно ГОСТ 1.12.007-76, время экспозиции – 2 часа 1 раз в сутки. При этом на левый бок животного (контрольный) наносили аналог потовой жидкости в количестве 10 мл, на правый бок – исследуемую БАД в объеме 10 мл. Воздействие оценивали по наличию эритемы, температуры тела, толщине кожной складки, сыпи и других признаков. Степень выраженности раздражающего действия оценивали по балльной шкале С.В. Суворовой.
Результаты исследования и их обсуждение
При микробиологическом исследовании БАД к пище «LB-комплекс Л» посторонней микрофлоры, грибов и плесеней не обнаружено. Установлено, что концентрация микроорганизмов родов Lactobacillus и Bifidobacterium соответствует заявленному в документации и составляет не менее 5×108 КОЕ/мл, кислотность продукта – 60 °Т. После осаждения носителя в надосадочной жидкости остается 4×107 КОЕ/мл.
В ходе исследования безвредности, токсигенности, токсичности и острой токсичности выявлено, что на протяжении всего опыта у животных опытной и контрольной групп отсутствовали признаки нарушения здоровья и потери массы тела к концу срока наблюдения, что подтверждает, что БАД безвредна для белых мышей SHK-линии обоего пола, при введении дозы, эквивалентной дозе, получаемой человеком, то есть «LB-комплекс Л» не обладает токсичностью и не является токсигенным.
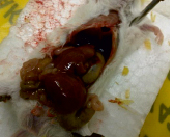
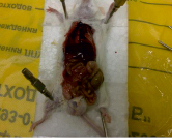
А В
Результаты вскрытия мышей опытной (А) и контрольной (В) групп
Таблица 1
Определение хронической токсичности БАД к пище «LB-комплекс Л» по «коэффициентам массы внутренних органов»
|
№ п/п |
Масса тела мыши, г |
Масса печени животного, г |
Коэф. печени |
Масса селезенки животного, г |
Коэф. селезенки |
|
Опытная группа |
|||||
|
1 |
26,65 |
1,6261 |
61,02 |
0,1897 |
7,12 |
|
2 |
24,25 |
2,0068 |
82,75 |
0,2865 |
11,87 |
|
3 |
23,14 |
1,7252 |
74,33 |
0,2435 |
6,00 |
|
4 |
28,38 |
1,9862 |
69,98 |
0.1110 |
3,91 |
|
5 |
28,90 |
2,1858 |
75,63 |
0,1982 |
6,85 |
|
Ср. |
26,26 ± 2,7 |
– |
72,74 ± 11,7 |
– |
7,15 ± 4,7 |
|
Контрольная группа |
|||||
|
1 |
20,85 |
1,5251 |
73,14 |
0,3002 |
1,43 |
|
2 |
24,35 |
1,5753 |
64,69 |
0,1921 |
7,88 |
|
3 |
23,43 |
1,3921 |
59,41 |
0,1992 |
8,50 |
|
4 |
21,79 |
1,3134 |
60,27 |
0,2751 |
12,62 |
|
5 |
24,25 |
1,7491 |
72,12 |
0,2019 |
8,32 |
|
Ср. |
– |
– |
65,34 ± 5,6 |
– |
9,43 ± 3,8 |
Таблица 2
Показатели функционального состояния кожи кроликов после многократных аппликаций биологически активной добавки к пище «LB-комплекс Л»
|
Показатели, ед. измерения |
Контрольная площадь поверхности тела |
Опытная площадь поверхности тела |
|
Эритема, баллы |
0 |
0 |
|
Толщина кожной складки, мм |
2,05 ± 0,06 |
2,06 ± 0,04 |
|
Температура кожи, °С |
36,3 ± 0,8 |
36,1 ± 0,2 |
|
рН кожи |
6,0 ± 0,2 |
6,0 ± 0,2 |
Примечание. Р > 0,05.
В результате исследования вирулентности установлено, что как в 1-й группе, получившей дозу 3,78×107 КОЕ на 1 г веса мыши, так и во второй группе, где доза бифидобактерий и лактобацилл составляла 3,57×106 КОЕ на 1 г веса животного, и в контрольной группе по истечении 14 суток не пало ни одно животное. Это означает, штаммы-продуценты, входящие в состав БАД к пище «LB-комплекс Л», не являются вирулентными для белых мышей SHK-линии обоего пола в дозе, эквивалентной рекомендуемой для человека.
В ходе проведения эксперимента на выявление хронической токсичности были получены сходные результаты: у всех животных, взятых в исследование, контролируемые показатели (состояние шерсти, активность, окраска слизистых, характер стула) в течение всего времени проведения опыта оставались без изменений, все животные были здоровы и прибавляли в весе. При вскрытии визуальных изменений внутренних органов, в том числе лимфоузлов, обнаружено не было (рисунок).
Достоверных различий «коэффициентов массы внутренних органов» в опытной и контрольной группах не наблюдалось (табл. 1).
Следовательно, биологически активная добавка к пище «LB-комплекс Л» при пероральном введении не обладает хронической токсичностью для белых мышей SHK-линии обоего пола в дозе (для мышей массой 14 г – 0,5×107 КОЕ), эквивалентной предлагаемой для человека.
При изучении местно-раздражающего действия БАД к пище на всем протяжение эксперимента визуальных изменений функционального состояния кожи у животных не происходило (табл. 2).
Из табл. 2 видно, что у животных не было выявлено признаков местно-раздражающего действия при воздействии биологически активной добавки к пище «LB-комплекс Л» на кожные покровы. Толщина кожной складки, температура кожи и водородный показатель кожных покровов (рН) на опытной и контрольной кожных поверхностях кроликов не отличались между собой. Отсутствовали также эритема, отек, сухость, сыпь и другие признаки местной реакции кожи.
Заключение
В ходе проведенной работы подтверждена хорошая переносимость и полная безвредность биологической активной добавки к пище «LB-комплекс Л» для организма животных. Показано, что препарат не обладает токсигенностью, токсичностью, не вызывает хроническую и острую токсичность при пероральном введении. Не обладает вирулентностью при пероральном введении в дозе 3,78×107 КОЕ на 1 г массы животного, не оказывает местно-раздражающего действия.
Библиографическая ссылка
Белова И.В., Точилина А.Г., Соловьева И.В., Жиленкова О.Г., Мелихова А.В., Беляева Е.В., Ермолина Г.Б., Борискина Е.В., Жирнов В.А., Иванова Т.П. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ БЕЗОПАСНОСТИ НОВОГО ИММОБИЛИЗОВАННОГО СИНБИОТИКА «LB-КОМПЛЕКС Л» НА ЖИВОТНЫХ // Международный журнал прикладных и фундаментальных исследований. 2018. № 2. С. 85-89;URL: https://applied-research.ru/ru/article/view?id=12113 (дата обращения: 05.02.2026).
DOI: https://doi.org/10.17513/mjpfi.12113

