Применение современных биоинформатических и молекулярно-генетических технологий показало, что гены, ассоциированные с нарушением работы головного мозга, часто кодируют белки, взаимодействующие в рамках одной функции или биологического процесса [1]. Количество генов, описанных при нарушениях функционирования мозга у детей, составляет более 1000 [2–4]. Мутации во многих из них ассоциируют с нарушением синаптических функций, нейрогенеза, нарушении транскрипции и репарации ДНК [5–10]. Отмечая большое количество ассоциированных генов, низкую воспроизводимость результатов относительно рекуррентных мутаций в различных исследованиях, а также феномен «бремени мутаций» (изменения в отдельных генах не приводят к значимому эффекту, однако большое количество мутаций в этих же генах, например, одной геномной сети, может привести к нарушению ее функционирования), различные авторы обращают внимание на значимость выявления процессов-кандидатов для разработки потенциальной терапии [8, 11]. В качестве примера можно привести сигнальную сеть Notch, которая играет роль в развитии органов и тканей в целом, но также вовлечена в поддержание клеток-предшественников эмбриональной нервной системы, способствует дифференциации астроцитов, а также участвует в регуляции функционирования нервной системы во взрослом возрасте. Нарушения в данной геномной сети ассоциированы, в частности, с лобно-височной лобарной дегенерацией, нарушениями обучения и памяти (у мышей). При нарушениях этого геномного пути предлагаются два основных направления терапии: блокировка сигнального пути (на уровне лигандов и/или рецепторов; на уровне транскрипционного комплекса) или его активация [12, 13]. Определение процессов-кандидатов является значимым направлением в современной медицинской генетике, предлагающим новые возможности для терапии генетически обусловленных заболеваний [14]. Таким образом, в настоящее время актуальность исследования вариаций генома, приводящих к изменению биологических процессов и вызывающих нарушения функционирования головного мозга, не вызывает сомнений.
Цель исследования
Целью настоящей работы являлись описание и апробация алгоритма приоритизации процессов-кандидатов заболеваний мозга на основе анализа данных о CNV, полученных с помощью молекулярного кариотипирования.
Материалы и методы исследования
Были исследованы образцы ДНК, выделенной из лимфоцитов периферической крови 374 детей с аутистическими расстройствами и/или задержкой психомоторного/психоречевого развития или умственной отсталостью, врожденными пороками и/или микроаномалиями развития. Молекулярное кариотипирование проводилось при помощи методов SNP array (352 пациента) и array CGH (22 пациента), с применением микроматриц (чипов) Affymetrix Cytoscan HD и Nimblegen 12*135K соответственно. Биоинформатический анализ проводился по описанному ранее протоколу [15, 16].
Результаты исследования и их обсуждение
В настоящей работе описывается алгоритм интерпретации данных молекулярного кариотипирования, который позволяет на основе пошагового применения стратегий приоритизации, ранжирования, составления интерактома и выявления геномных сетей получить кластеры процессов-кандидатов, ассоциированных с определенными фенотипическими проявлениями заболевания. В группе из 374 пациентов с нарушением функционирования головного мозга (ГМ), выражающимся как расстройство аутистического спектра и/или задержка психомоторного/психоречевого развития или умственная отсталость с врожденными пороками и/или микроаномалиями развития, патогенных и вероятно патогенных вариаций генома не было обнаружено в 26 (7 %) случаях. Патология генома в виде анеуплоидии, структурных аномалий хромосом, сложных хромосомных перестроек, потери гетерозиготности, характерной для детей от кровнородственных браков [17], а также потери гетерозиготности в импринтированных генах, были выявлены в 157 случаях (42 %). Данные случаи были исключены из дальнейшего исследования. В 51 % случаев (191 пациент) были выявлены CNV, являющиеся патогенными или вероятно патогенными и затрагивающие от 1 до 500 тыс. пн. Для изучения молекулярных механизмов нарушения психики у детей из данной группы был предложен алгоритм интерпретации данных молекулярного кариотипирования [8, 15]. Алгоритм основан на пошаговом применении стратегий приоритизации, ранжирования, составления интерактома и выявления геномных сетей, и позволяет в результате получить набор процессов-кандидатов и кластеров процессов, предположительно вносящих вклад в определенное заболевание (рисунок). Выявление CNV, имеющих значение для фенотипических проявлений, проводилось с помощью анализа следующих параметров: рекуррентность; упоминание в базах данных патогенных и непатогенных геномных вариаций; определение генов, локализованных в участках CNV; функций данных генов и заболеваний, ассоциированных с CNV/генами. Далее анализировалась экспрессия генов, локализованных в участках патогенных и вероятно патогенных CNV, в нервных клетках. Следующим шагом являлось выявление взаимодействий генов, имеющих повышенную экспрессию в клетках головного мозга. На основании выявленных интеракций составлялся так называемый «объединенный интерактом», включающий в себя все взаимодействующие элементы из исследуемого на данном этапе массива. Для всех генов объединенного интерактома определяли геномные сети при помощи нескольких баз данных. Далее полученные геномные сети ранжировали, основываясь на соотношении общего количества генов, входящих в геномную сеть, и генов, задействованных в этой геномной сети в исследуемой выборке. Исходя из результатов предыдущего шага, выявляли значимые геномные сети, которые объединяли в кластеры по функции и по вовлеченности в подобные процессы. Вышеобозначенные кластеры рассматривали в качестве элементов патогенетического каскада молекулярных и клеточных процессов, являющегося причиной нарушений психики при болезнях мозга (таблица).
Использованные электронные ресурсы
|
Номер этапа |
Использованные ресурсы |
Ссылка на ресурс |
|
1 |
UCSC Genome Browser on Human Feb. 2009 (GRCh37/hg19) Assembly |
http://genome.ucsc.edu/ |
|
ОMIM (Оnline Мendeliаn Inheritаnсe in Маn) |
https://www.omim.org/ |
|
|
NСBI Mар Viewer |
https://www.ncbi.nlm.nih.gov/mapview/ |
|
|
Dаtаbаsе оf Genоmiс Vаriаnts – саtаlоgue оf struсturаl vаriаtiоn in the humаn genоme |
http://dgv.tcag.ca/dgv/app/home |
|
|
2 |
BiоGРS (Genоmiсs Institute оf the Nоvаrtis Reseаrсh Fоundаtiоn) |
http://biogps.org/#goto=welcome |
|
Genatlas (Genatlas Universite Paris Descartes) |
http://genatlas.medecine.univ-paris5.fr/ |
|
|
3. |
STRING.db (Seаrсh Tооl fоr the Retrievаl оf Interасting рrоteins dаtаbаse) |
httр://string.db.оrg/ |
|
BioGRID (Biological General Repository for Interaction Datasets) |
https://thebiogrid.org/ |
|
|
NCBI gene |
https://www.ncbi.nlm.nih.gov/gene |
|
|
5. |
KEGG (Kyoto Encyclopedia of Genes and Genomes) |
http://www.genome.jp/kegg/ |
|
Gene Ontology (Gene Ontology Consortium) |
http://www.geneontology.org/ |
|
|
REACTOME |
http://www.reactome.org/ |
|
|
NCBI biosystems |
https://www.ncbi.nlm.nih.gov/Structure/ biosystems/docs/biosystems_about.html |
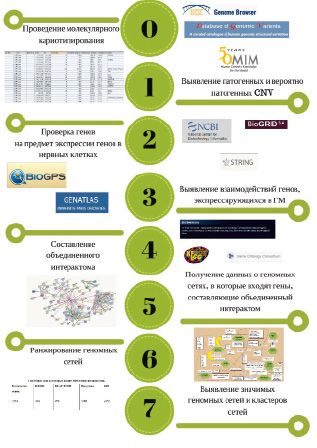
Алгоритм приоритизации данных молекулярного кариотипирования
Применение данного алгоритма к исследуемой группе из 191 пациента позволило показать, что недифференцированное расстройство аутистического спектра и умственная отсталость могут быть ассоциированы с нарушением определенных кластеров процессов, геномных сетей и генов. Было выявлено 475 генов, входящих в 39 геномных сетей и составляющих 13 кластеров процессов и «молекулярных путей» (pathways): «функционирование везикул», «репарация ДНК», «транскрипция», «нейродегенеративные заболевания», «сигнальный путь ErbB», «протеасома», «B-лимфоциты», «макромолекулярные взаимодействия», «функционирование актина», «митоз», «старение», «сигнальная сеть Notch», «сигнальная сеть TP53».
Наибольшее количество генов (35 из 475) было вовлечено в кластер «Протеасома». Протеасома выполняет значимую функцию, заключающуюся в разложении отработанных или поврежденных белков путем протеолиза. Нарушение функции протеосомных комплексов вызывает снижение протеолитической активности, в результате чего накапливаются поврежденные или неправильно сформированные белки. Это может приводить к развитию характерных изменений при нейродегенеративных, сердечно-сосудистых и аутоиммунных заболеваниях, а также при воспалительных реакциях и системных ответах на повреждение ДНК [18, 19]. В кластер «Нейродегенеративные заболевания» входят гены, ассоциированные с различными тяжелыми заболеваниями и выполняющие значимые биологические функции. Ген DCTN1 вовлечен в формирование веретена деления и аксонов; ген FUS участвует в регуляции экспрессии генов и поддержании целостности генома; ген CDK5 вносит вклад в различные процессы, такие как синаптическая пластичность и миграция нейронов; ген GRN регулирует рост клетки, а OPTN участвует в транспорте веществ через мембрану. Геномная сеть p53 состоит из генов, реагирующих на широкий спектр сигналов стресса.
Изучение молекулярных сетей, в которые вовлечены белки, ассоциированные с умственной отсталостью, позволило продемонстрировать, что многие из них принадлежат к подробно описанным сигнальным путям [20].
Рассматривая потенциальные подходы к лечению, можно обратить внимание на применение методов, модулирующих их активность. Например, большая часть мутаций, влияющих на малые ГТФазы, приводит к гиперактивации пути транспорта данных ферментов. Уменьшение трансдукции сигнала возможно при использовании либо общих ингибиторов малых ГТФаз, либо более специфических ингибиторов, направленных на нижележащие киназы [21, 22]. Для уменьшения уровня активации Ras у модельных животных с нейрофиброматозом первого типа было успешно использовано ингибирование фарнезил-трансферазы. Данное заболевание является комплексным нервно-психическим нарушением, обусловленным потерей функции RasGAP, NF1 [23]. Мутации в других генах, ассоциированных с умственной отсталостью, могут инактивировать геномные сети типа APIX/Rac/PAK3/LIMK или IL1RAPL1/JNK. В этих случаях терапевтические стратегии могут быть связаны с активацией нижележащих эффекторов. Многие геномные пути, ассоциированные с нарушением функционирования ГМ, также вовлечены в развитие онкологических заболеваний, и разработка терапии при их нарушении проводится прежде всего в этом направлении. Например, активирующие мутации в генах, участвующих в геномной сети ErbB (члены семейства EGFR), приводят к гиперактивации сигнального пути PI3K-AKT-mTOR, контролирующего клеточный метаболизм, пролиферацию и подвижность. Ингибирование данного сигнального пути восстанавливает рецепторную активность и компенсирует отсутствие нисходящих сигналов от рецептора [24].
Необходимо отметить, что, имея представление о механизмах нарушений психики, определенных с помощью биоинформатического анализа, можно рассматривать две основные платформы для дальнейшей разработки терапевтических стратегий: (1) изучение структурных изменений белков, вовлеченных в нарушенные «молекулярные пути» (pathways); (2) оценка эффекта мутаций на определенные биологические процессы или их каскадов. Таким образом, изучение геномных сетей и взаимодействия генов является необходимым для полноценного анализа результатов молекулярного кариотипирования, что делает биоинформатический анализ неотъемлемой частью интерпретации его результатов [25].
Выводы
Показано, что недифференцированная умственная отсталость и расстройство аутистического спектра могут быть ассоциированы с нарушением 13 кластеров процессов и геномных сетей (нейродегенерация, функционирование актина, функционирование протеасомы, сигнальный путь ERBB, регуляция транскрипции, сигнальная сеть TP53, сигнальная сеть Notch, старение, митотическое деление клетки, репарация ДНК, функционирование везикул, макромолекулярные взаимодействия, B-лимфоциты). Применение методов молекулярного кариотипирования совместно с биоинформатическим анализом позволяет не только выявлять хромосомные и эпигенетические аномалии, но и определять процессы, лежащие в основе недифференцированных форм заболеваний, связанных с патологией головного мозга, что способствует разработке терапевтических стратегий индивидуального лечения. Применение данного метода обладает высокой эффективностью для выявления процессов, лежащих в основе недифференцированных форм заболеваний, связанных с патологией головного мозга.
Библиографическая ссылка
Зеленова М.А., Ворсанова С.Г., Юров Ю.Б., Васин К.С., Шмитова Н.С., Юров И.Ю. ПРИОРИТИЗАЦИЯ ПРОЦЕССОВ-КАНДИДАТОВ ПРИ УМСТВЕННОЙ ОТСТАЛОСТИ И АУТИЗМЕ НА ОСНОВЕ ДАННЫХ МОЛЕКУЛЯРНОГО КАРИОТИПИРОВАНИЯ О ВАРИАЦИЯХ ЧИСЛА КОПИЙ ПОСЛЕДОВАТЕЛЬНОСТЕЙ ДНК // Международный журнал прикладных и фундаментальных исследований. 2018. № 3. С. 100-104;URL: https://applied-research.ru/ru/article/view?id=12157 (дата обращения: 17.12.2025).

