Манифестирование клинически выраженной папилломавирусной инфекции и её рецидивирование, в частности гиперкератозов кожи, после удаления хирургическими путем и радиочастотной коагуляции наблюдается довольно часто, поэтому даже и при лечении жидким азотом при криодеструкции зачастую возникает необходимость в проведении повторных сеансов криодеструкции у трети пациентов. Рецидивы могут возникать при криодеструкции не только бородавок, но и при лечении гемангиом.
Широко известен метод лечения гемангиом у детей СВЧ-криодеструкцией. СВЧ-криодеструкция изучалась и стала широко применяться на кафедре детской хирургии РГМУ для лечения келлоидных рубцов и гемангиом, также динамику льдообразования в тканях изучали методом ЯМР-спектроскопии на кафедре биофизики МГУ им. М.В. Ломоносова [1].
Результаты этих исследований по оценке влияния СВЧ воздействия на размеры зон замораживания и некроза живой ткани в экспериментах показали, что оптимальными параметрами предварительного СВЧ поля являются – мощность 10 Вт, частота 915 МГц, и время облучения 3–5 мин с интервалами 2 мин. Размер зоны замораживания в этом случае увеличивался более чем в 2 раза, а объем некроза – в 5–6 раз, по сравнению с только криодеструкцией, этот известный метод усиления в настоящее время широко используется [2]. Криодеструкция и СВЧ-криодеструкция не позволяют точно оценить объем ткани, подвергаемой деструкции, и для лечения пациентов с гемангиомами часто приходится повторять сеансы деструкции. Даже полной эффективности лечения иногда невозможно достигнуть, также технические сложности при проведении СВЧ криодеструкции возможны и в местах сложной анатомической локализации. Для усиления воздействия на патологические образования эффективна криодеструкция с предварительным лазерным облучением в инфракрасном диапазоне, либо только лазерокоагуляция образований с помощью импульсного лазера Nd_YAG с длиной волны 1064 нм [3].
Обширные гиперкератозы и гемангиомы лечатся склеротерапией в сочетании с криодеструкцией, и зачастую места инъекций склерозантов и лидокаина могут длительно кровоточить. Криохирургический метод лечения при заболеваниях горла и носа также широко применяется и имеет различные результаты [4].
Без применения электромагнитных и лазерных инфракрасных излучений методы усиления криодеструкции, более или менее традиционны, это и криодеструкция с предварительным введением в зону разрушения патологических образований физиологических растворов или местных анестетиков, либо криодеструкция с множественными циклами замораживания с оттаиванием [5, 6]. Известно, что не все пациенты переносят введение новокаина или лидокаина, да и инфильтрационный способ введения любого раствора может быть болезненным, также в результате инъекций возможно развитие кровотечения из гемангиомы. Достаточно тяжело проходит лечение и химическими методами деструкции особенно при подошвенных гиперкератозах, где эффективность может доходить до 62,5 %, и в последующем требуется комплексное лечение с приемом противовирусных и проведения все же удаления с помощью радиочастотного метода [7].
В связи с вышеизложенным, с целью усиления криодеструкции и повышения эффективности лечения без рецидивов патологических новообразований кожи, была предпринята попытка изучения криодеструкции с гемостатическими препаратами. Применялась криодеструкция с применением 2,5-диоксибензолсульфоната диэтиламина, – этамзилат, 12,5 % раствор дицинона производитель Лек., Словения.
2,5-диоксибензолсульфонат диэтиламин гемостатический препарат, увеличивает образование в стенках капилляров мукополисахаридов большой молекулярной массы и повышает устойчивость капилляров, нормализует их проницаемость при патологических процессах, улучшает микроциркуляцию. Оказывает гемостатическое действие, которое обусловлено активацией формирования тромбопластина в месте повреждения мелких сосудов. Препарат стимулирует образование фактора свертывания крови III, нормализует адгезию тромбоцитов. Дицинон не влияет на протромбиновое время, не обладает гиперкоагуляционными свойствами. Именно влияние на сосуды и способность активировать формирование тромбопластина в месте повреждения сосудов, использовалось для увеличения объема криодеструкции и точной её локализации в тканях в эксперименте на животных и у пациентов.
Материалы и методы исследования
Экспериментальные работы проводили на кафедре детской хирургии Алтайского государственного медицинского университета в г. Барнауле. Исследование проводили на коже лабораторных мышей, изучалось влияние сверхнизких температур в сочетании с медикаментозным гемостазом, с целью усиления криодеструкции, а также только изолированная криодеструкция. Морфологическим методом со стандартной гистологической обработкой и окраской по Романовскому изучались очаги криодеструкции и последующей регенерации кожи на первый, третий и последующие дни заживления. Изучению подверглись криодеструкция с введением 12,5 % раствора дицинона накануне, средней степени по Б.А. Задорожному 1985 г. [8] с выраженным поверхностным некрозом эпидермиса. Отмечали скорость заживления послеоперационных ран, при криодеструкции с дициноном и чистой криодеструкции, время до отпадения корочки, с макроскопическим описанием морфологических элементов и оценкой эстетического результата, результаты подверглись статистической обработке.
Экспериментальную часть провели на 45 белых лабораторных мышах, разделенных на три группы по 15 особей. Выполнялись микрофотографирование и регистрация с описанием формирующихся морфологических элементов на коже после криодеструкции и ежедневно до трех недель заживления. На участке воздействия лабораторным мышам сбривали шерсть, в области бедра, а также для всех животных были созданы одинаковые условия обитания.
Криодеструкцию проводили в первой группе, во второй предварительно внутримышечно вводился дицинон перед криодеструкцией и третьей группе мышей проводили только радиочастотную коагуляцию кожи бедра. Для криодеструкции применяли аппарат «криоиней» на сбритом участке кожи, использовали криоаппликатор диаметром 5 мм, экспозиция 120 сек., вызывали криоповреждение второй степени, характеризовавшееся поверхностным некрозом эпидермиса. Из-за обилия в бритой мышиной коже волосяных фолликулов и других придатков, экспозиции в одну минуту не вызывали у мышей типичных очагов криоповреждения средней степени. Учитывая это, экспозиция криодеструкции была увеличена в два раза. Радиочастотным скальпелем электропульс С-350РЧ, проводили высокочастотную коагуляцию кожи. Иссечённую скальпелем кожу после экспериментального повреждения, из очагов микроскопировали предварительно фиксировав в 10 % нейтральном растворе формальдегида. Гистологический материал подвергали стандартной окраске гематоксилином и эозином, полученные гистологические препараты описывались в соответствии с принятой терминологией для морфологических исследований. Все патоморфологические изменения были иллюстрированы соответствующими полученными микрофотографиями.
Патологические образования, бородавки и гемангиомы кожи инфильтрировались в основание 12,5 % раствором дицинона (125 мг) 1 мл с помощью инсулинового шприца, за 30 мин до криодеструкции. После чего проводили криодеструкцию аппаратом «криоиней», с экспозицией 60 сек. После поверхность обрабатывали бриллиантовой зеленью, с наложением сухой асептической повязки [9, 10].
Другой группе пациентов проводили лечение только криодеструкцией, без введения каких-либо препаратов, с той же экспозицией, аппаратом «криоиней», эта группа пациентов была контрольной, одноцентровое наблюдательное проспективное рандомизированное исследование.
Результаты исследования и их обсуждение
Исследование влияния дицинона было экспериментальным и предварительно опробовано на коже уха здоровой мыши, перед клиническими испытаниями у пациентов. Макроскопически описание внешнего вида криодеструкции кожи уха мыши, которым вводился 12,5 % раствор дицинона 0,1 мл, было следующим; внешне отмечалась гиперемия кожи уха на месте криодеструкции, но без массивных кровоизлияний и кровотечений, которые виднелись у тех мышей которым проводили только криодеструкцию, что говорило о «сосудосохраняющем» ангиопротективном влиянии дицинона при криодеструкции.
При введении дицинона перед криодеструкцией зона криоповреждения на всем протяжении характеризовалась выраженным лекоцитарным инфильтратом, в виде вала по краю криоповреждения и диапедезных кровоизлияний большей выраженности, которые являлись исходом гиперемии, но без крупных разрывов сосудов, в отличие от изолированной криодеструкции.
В зоне криодеструкции в ходе переохлаждения морфологически обнаруживались полнокровные и расширенные капилляры, с начинающейся геморрагической имбибицией окружающих тканей, наряду с обнаруженными, отчетливо сформированными, чем при только криодеструкции, тромбозами. По краям зоны криодеструкции в эпидермисе во всех микропрепаратах обнаруживались кровоизлияния, с распространяющимися субэпидермальными полосчатыми гематомами, особенностью являлся и выраженный лейкоцитарный инфильтрат. Глубже в подлежащей подкожножировой клетчатке под всем участком криодеструкции всегда имелись множественные микрогематомы и диапидезные кровоизлияния, опять с интенсивным лейкотаксисом из-за повышенной проницаемости сосудов. Дицинон активировал интенсивный лейкотаксис к массам коагулята зоны криодеструкции, с увеличением диапидезных коровоизлияний из-за повышенной проницаемости сосудов, и без разрывов.
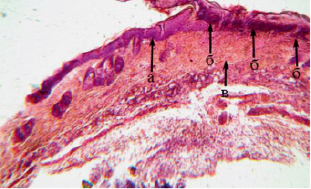
Рис. 1. Криодеструкция с дициноном кожи белой лабораторной мыши. Окраска гематоксилином и эозином×40. а – зона эпидермиса вне «деструкции», б – зона деструкции эпидермиса и глубоких слоёв дермы с преобладанием коагуляционного некроза с гомогенизацией тканевых структур, в – в базальных отделах зоны деструкции на границе с субдермальными структурами интенсивное капиллярно-венозное полнокровие
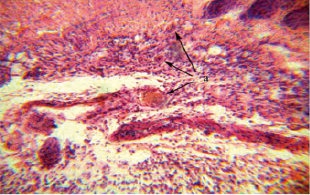
Рис. 2. Криодеструкция с дициноном, кожи белой лабораторной мыши, фрагмент рис. 1. Окраска гематоксилином и эозином×120. а – стазы в капиллярах и венулах с массивной инфильтрацией мононуклеарами окружающих тканей
Повреждение кожи лабораторных мышей при радиочастотной коагуляции, отличалось от замораживания – криодеструкции, и криодеструкции с дицином, практически полным отсутствием сосудистых расстройств, всегда имевшейся выраженной лейкоцитарной инфильтрацией зоны коагуляционной деструкции кожи, увеличивающейся по мере заживления высокочастотной коагуляции. После заживления отсутствовал рост волос, с их придатками потовыми и сальными железами в центре радиочастотной коагуляции, что отмечали во всех изученных микропрепаратах. При криодеструкции в процессе заживления обнаруживалась менее выраженная мононуклеарная инфильтрация в сравнении с высокочастотной коагуляцией, при которой изменения были локализованными и зависели от глубины радиочастотного повреждения. При криодеструкции же изменения характеризовались диффузным характером в основном связанные с ишемией подлежащих тканей в результате сосудистых расстройств.
Полученные экспериментальные результаты легли в основу метода, который позволил улучшить результаты лечения папилломавирусной инфекции и гемангиом кожи у детей. Так из 28 детей 75 % пациентов полностью вылечились за одну операцию с предварительным введением 12,5 % раствора дицинона, у 6 пациентов отмечено рецидивирование бородавок в течение года и у одного пациента после операции сократился патологический элемент и потребовалась повторная криодеструкция. Срок заживления раневой поверхности после криодеструкции с дициноном в среднем был короче. Достоверность различий в зависимости от количества больных, группы сравнения рассчитывалась по критерию χ2 с оценкой показателя по критерию Романовского с t 5,69 различия оказались достоверны (p < 0,05).
Пациенты, у которых гиперкератозы были пролечены методом только криодеструкции 23 ребенка с бородавками, группа сравнения, в которой последующее выздоровление после однократного лечения, с заживлением очага криодеструкции без рецидива достигло 69,9 %, что на 5,1 % меньше, чем при криодеструкции с дициноном (75 %).
Рецидивирование гиперкератозов при бородавках, потребовавшее повторных сеансов криодеструкции, пролеченных криодеструкцией без введения препаратов составило 30,1 %, а в группе больных детей, лечившихся с предварительным введением дицинона 25 %, так же, как и средний срок рецидива папилломавирусной инфекции в процессе наблюдения с применением дицинона составил 12,1 мес., а при чистой криодеструкции 9,3 мес.
По современным представлениям о криоповреждении тканей было обнаружено, что в месте под криоаппликатором, развиваются прямые некротические и дистрофические изменения от непосредственного контакта с металлом проводником, а в тканях глубже формируются стазы и тромбозы в приносящем звене сосудистого русла, стазы и запустевание просветов в просветах венул и вен в выносящем звене. В результате деструкции стенок сосудов и изменения реологических свойств крови наступает блокада микроциркуляции, также с механическими повреждениями формируются изменения, характерные для коагуляционного воздействия охлаждения, в виде стазов, тромбозов, обширных отложений и выпадений фибрина.
Дицинон (2,5–диоксибензолсульфонат диэтиламин) кровоостанавливающий гемостатический препарат, действие которого заключается в усилении адгезии тромбоцитов и стабилизации стенок микрососудов, препарат нарушает выброс простагландинов, которые вызывают дезагрегацию тромбоцитов и последующую паралитическую вазодилятацию. Влияние дицинона по нашим экспериментальным морфологическим результатам, в «свете» современных представлений механизма криодеструкции, способствует формированию стазов, тромбозов и выпадению фибрина в сосудистом русле очага криодеструкции патологических образований и, как следствие, развитию более обширной и глубокой ишемии патологической ткани.
В практическом применении при лечении патологических образований у больных, по наблюдениям в ходе, оценки с группой сравнения, где выполняли только криодеструкцию, без её усиления препаратами, отмечалось уменьшение времени экспозиции с криоапликаторами, наряду с уменьшением количества сеансов лечения, что позволяло лечить, по нашему мнению, уже более объемные и глубокие патологические образования кожи.
Положительной особенностью явилось и то, что дицинон, как описано в инструкции, не влиял на механизм коагуляции в норме, а также на протромбиновое время, фибринолиз и уровень тромбоцитов. Дицинон активно предупреждал кровотечения из коагулированных криодеструкцией патологических образований кожи, при изъязвлённых гемангиомах, отмечено также благоприятное влияние дицинона на течение раннего послеоперационного периода.
Заключение
Проведено экспериментальное наблюдательное рандомизированное сравнительное исследование оценки влияния дицинона (2,5-диоксибензолсульфоната диэтиламина) на криодеструкцию кожи мышей с помощью морфологических методов. В ходе исследования обнаружилось формирование выраженного лейкоцитарного инфильтрата и диапедезных кровоизлияний большей выраженности, без разрывов сосудов в отличие от только криодеструкции. Дицинон в наблюдении способствовал гемостазу и формированию тромбозов в очаге криодеструкции, а тем самым её усиливал. Криодеструкцию гемангиом и вирусных бородавок осуществляли с предварительным введением под образование 12,5 % раствора дицинона. Констатировано благоприятное течение послеоперационного периода, снижение частоты рецидивирования гиперкератозов, повышение управляемости криодеструкции. У больных, получивших только криодеструкцию, полное выздоровление после одной деструкции было достигнуто в 69,9 % случаях, а при предварительном введении перед криодеструкцией дицинона у 75 %, все это обуславливает снижение рецидивов и получение оптимального косметического результата, что позволяет рекомендовать метод для повышения эффективности лечения образований кожи в дерматологии, косметологии и хирургии.
Библиографическая ссылка
Дегтев М.В., Кожевников Е.В., Кожевников В.А. ВЛИЯНИЕ ДИЦИНОНА НА КРИОДЕСТРУКЦИЮ ГЕМАНГИОМ И БОРОДАВОК КОЖИ // Международный журнал прикладных и фундаментальных исследований. 2018. № 4. С. 58-62;URL: https://applied-research.ru/ru/article/view?id=12183 (дата обращения: 03.03.2026).

