Анализ физиологической роли иммунного ответа говорит о том, что его регуляция является одной из основных функций организма. Эта функция принадлежит генам главного комплекса гистосовместимости – MHC (от Major Histocompatibility Complex) [1–3]. Интересно, что само это название отражает скорее историю открытия данной генетической системы, чем ее основную функцию. Дело в том, что история открытия первых продуктов генов главного комплекса гистосовместимости, называемых у человека антигенами HLA (от Human Leucocyte Antigens), связана с появлением и развитием трансплантационной иммунологии. В то время возникла необходимость подбора тканесовместимых пар донора и реципиента. Сегодня мы знаем, что роль системы МНС в отторжении трансплантата является лишь одной из частных физиологических функций этой системы [4–6].
В настоящее время известны следующие HLA-ассоциированные заболевания: анкилозирующий спондилоартрит (болезнь Бехтерева), синдром Рейтера, ревматоидный артрит, острый передний увеит, целиакия, болезнь Аддисона, диффузный токсический зоб, инсулинозависимый сахарный диабет (СД), миастения, системная красная волчанка, идиопатический гемохроматоз, рассеянный склероз, обыкновенный псориаз, болезнь Хасимото, хронический гепатит, болезнь Бехчета, синдром Шегрена, синдром Гудпасчера, гранулематоз Вегенера. Кроме этого, при некоторых заболеваниях наблюдается зависимость течения болезни от HLA-генотипа [7]. Изучение генетических механизмов, контролирующих сопротивляемость иммунного ответа при различных инфекционных заболеваниях, становится одним из важнейших разделов инфекционной иммунологии. Рецидивирующие формы герпес-вирусной инфекции (РГИ) встречаются, по данным различных авторов, у 5–30 % людей трудоспособного возраста. Их развитие напрямую связано с нарушением клеточных и гуморальных механизмов иммунологической резистентности, в частности с дефектами в HLA-системе [8–10].
Цель: Изучить частоту экспрессии антигенов системы HLA у больных рецидивирующей герпетической инфекцией.
Материалы и методы исследования
Обследованы группы больных с РГИ, находившихся на стационарном лечении в инфекционной клинической больнице. Диагностику РГИ осуществляли на основании клинико-эпидемиологических и лабораторных данных. Из обследованных больных РГИ мужчины составляли 47,1 %, а женщины 52,9 %. Более 68 % составляли больные, возраст которых превышал 50 лет. По возрастным группам больные распределялись следующим образом: до 20 лет – 3,9 %, 20–29 лет 16,7 % , 30–39 лет 5,9 %, 40–49 лет 4,9 %, 50–59 лет 21,6 %, 60 лет и старше 47,0 %. Средний возраст обследованных составлял 55,6 лет. Среди обследованных больных РГИ в основном были рабочие 33,4 % и пенсионеры 29,4 %. На долю учащихся и студентов приходилось 23,5 %, а остальные относились к категории служащих 13,7 %. Исследования иммунного статуса проводились согласно рекомендациям Р.В. Петрова с использованием тестов 1 и 2 уровней включали изучение количественного и функционального состояния и систем лимфоцитов, нейтрофилов, комплемента. HLA типирование проведено у больных латентно-рецидивирующим герпесом, вызванным вирусом H. Simplex в возрасте от 16 лет до 76 лет. Ежегодные обострения герпетической инфекции у обследованных больных составляли не менее 3-х раз в год. В соответствии с задачами работы фракцию мононуклеарных клеток для исследования получали путем седиментации крови в одноступенчатом градиенте иколл-верографин с плотностью раствора 1,077 г/см при 400 g в течение 30 мин. При заборе крови в качестве антикоагулянта использовали гепарин из расчета 10 единиц на 1 мл крови.
HLA фенотип устанавливали в стандартном двухступенчатом микролимфоцитотоксическом тесте с использованием HLA- антисывороток, в анализе учитывали 8 антигенов HLA-A локуса: 1, 2, 3, 9, 10 11, 19, 28; 16 антигенов HLA-B локуса: 5, 7, 8, 12, 13, 14, 15, 16, 17 18, 21, 22, 27, 35, 40, 41, 4 антигена HLA-C локуса: 1, 2, 3, 4.
При определении HLA-антигенов локуса А,В,С выделенную на градиенте плотности фиколл-верографина суспензию мононуклеарных клеток в концентрации –4×100₆ клеток в 1 мл раскапывали по 1 мкл в лунки планшет Терасаки, содержащих типирующие сыворотки в объеме 1 мкл. Клетки инкубировали в течение 30 мин при комнатной температуре, затем добав лили в каждую лунку по 5 мкл цельного кроличьего комплемента, прове ренного предварительно на активность и цитотоксичность. После инкубации клеток в течение 60 минут при температуре 37 °С проводили учет реакции, используя 5 %-ный раствор эозина.
Результаты исследования и их обсуждения
Из приведенных данных видно, что в исследуемой группе определялись все антигены А, В, С локусов, идентифицируемые серологическим методом. С наибольшей частотой у больных РГИ встречались антигены HLA локуса А2 (52 %), АЗ (27,5 %), А24 (4,9 %), А25 (4,9 %), А26 (4,9), СW1 (4,9 %), В7 (18,6 %), В12 (18,6 %), В40 (17,6 %). Частота антигенов А9 (15,6 %), А11 (5,9 %), А28 (3,9), В15 (6,9 %), В35 (6,7 %), В15 (6,9 %) отмечалась реже (рис. 1).
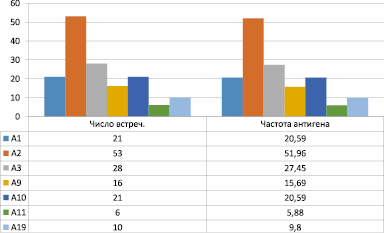
Рис. 1. Распределение антигенов системы HLA по локусам А и С у больных рецидивирующей герпетической инфекцией
Полученные результаты по распределению антигенов HLA у больных РГИ позволили определить антигены и группы антигенов среди всех трех изучаемых локусов, имеющих либо положительную либо отрицательную ассоциацию с данной патологией. Из наиболее весомых антигенов с положительной ассоциацией в развитии РГИ следует отметить HLA-АЗ (Рс < 0,01), (Рс < 0,01). Сочетание данных антигенов HLA у больных герпетической инфекцией, вероятно, и является определяющим фактором в механизмах генетической предрасположенности и резистентности отдельных индивидумов к развитию РГИ.
Для уточнения роли отдельных антигенов в возможном развитии РГИ у индивидуумов были определены показатели относительного риска (RR), этиологической и превентивной фракции (EFиPF). Показатель относительного риска характеризует, с одной стороны, силу ассоциативных связей, а с другой стороны, определяет эту связь либо как положительную (RR ˃ 1,0), либо – отрицательную (RR ˂ 1,0).
Наиболее сильные ассоциативные связи с РГИ выявлены у антигенов HLA-A25 (RR-5,15). A26 (RR-3,42) и A3 (RR-3,26), однако среди данных антигенов достоверные различия с показателями здоровых были выявлены лишь по антигенов достоверные различия с показателями здоровых были выявлены лишь по антигенам HLA – A3 (Pc ˂ 0,01). A25(Pc ˂ 0,01).
Считается, что вычисление этиологической фракции ЕF даёт более верное представление6 чем показатель относительного риска RR о сравниваемой силе ассоцииаций в тех случаях, когда с заболеванием ассоциируется несколько антигенов и возникает вопрос, какая из этих ассоциаций является первичной, необусловленной неравновесным сцеплением HLA-генов. Ассоциативная связь антигена HLA-А3 с РГИ характеризовалась наивысшим показателем этиологической фракции EF > 0,19 (рис. 2).
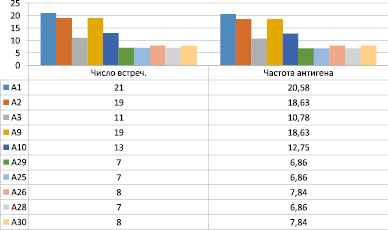
Рис. 2. Распределение антигенов HLA по локусам А и С у доноров
Наиболее сильными отрицательными ассоциями явились ассоциативные связи HLA-A28 (RR-0,29), В35 (RR-0,27), А11 (RR-0,29), В16 (RR-0,31), А9 (RR-0,43), В15 (RR-0,52). Хотя антигены А28, В15, В16 (рис. 3) у больных РГИ характеризовались сильной отрицательной ассоциативной связью, они не отличались достоверно от данных здоровых (Рс < 0,8–0,9).
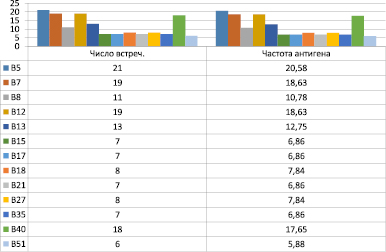
Рис. 3. Распределение антигенов системы HLA по локусу В у больных рецидивирующей герпетической инфекцией
В тех случаях, когда RR < 1, т.е. частота HLA-антигена у заболевших ниже, чем в контроле, что может свидетельствовать о «защитной» роли данного антигена, определяется величина превентивной фракции (PF). Эта величина определяет у какого антигена наиболее сильная отрицательная ассоциативная связь, и даёт более верное статистически значимое представление, чем показатель относительного риска RR, когда с заболеванием ассоциируется так же несколько антигенов (в данном случае антигены HLA-А9, Рс < 0,05; А11, Рс < 0,01; В35, Рс < 0,01) Ассоциативные связи антигенов НLА В35 и Ф11 с РГИ характеризовались наивысшими показателями превентивной фракции PF – 2,26 и 2,16 соответственно, при ведущей роли антигена HLA В35. Наиболее часто в данной группе лиц встречались гаплотипы HLA-А1В40, А2В5, А2В7, А3В12, А10В12 (рис. 4).
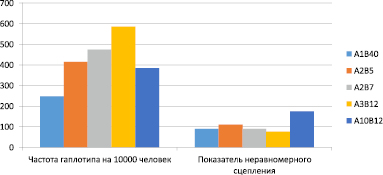
Рис. 4. Наиболее часто встречающиеся HLA гаплотипы у лиц с РГИ
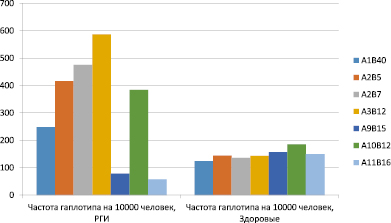
Рис. 5. Особенности распределения гаплотипов системы HLA у лиц РГИ и здоровых
Из рис. 5 можно видеть, что лиц с РГИ наиболее значимо было представительство гаплотипов А2В5 (Рс < 0,001, RR-1,7, EF-1,8), А2В7 (Р < 0,001), RR-2,4, EF-2,1), А3В12 (Р < 0,001, RR-3,4, ЕF-2,8). Наиболее сильными явились ассоцииации гаплотипов А3В12 и А2В7 и РГИ при ведущей роли гаплотипа А3В12 (EF-2,8).
Таким образом, проведённые исследования по определению встречаемости HLA антигенов и гаплотипов у больных с РГИ показали ряд существенных различий. Повышенная воспримичивость к возникновению и течению с периодическим обострениями герпетической инфекции вызванной вирусом простого герпеса связана с антигеном HLA-А3 и гаплотипами А3В12, А2В7. Генами протекторами в снижении риска развития герпетической инфекции являются антигены HLA-В35, А11 при ведущей роли антигена HLA-В35.
Частота встречаемости HLA антигенов и гаплотипов у больных рецидивирующим латентным течением герпетической инфекции и здоровых лиц казахской национальности имеет ряд закономерностей. Восприимчивость к возникновению и течению с периодическими обострениями герпетической инфекции вызванной вирусом простого герпеса у лиц казахской национальности связана с антигенами HLA-A3, B35, A11 и гаплотипами HLA-A2B7, HLA-A3B12.
Полученные результаты могут быть использованы для формирования групп риска лиц, у которых возможно возникновение герпетической инфекции с рецидивирующим течением и прогнозировать особенности течения данной инфекции с целью проведения адекватной терапии.
Библиографическая ссылка
Култаев М.С., Мусаев А.Т., Шынтерекова А.Е., Алдабергенов Е.Н., Аскарова Н.М., Малимбай С.Т., Сейдан О.К., Орынханова М.О., Асатиллакызы А.А., Отеулиева М.А. ЧАСТОТА ЭКСПРЕССИИ АНТИГЕНОВ СИСТЕМЫ HLA У БОЛЬНЫХ РЕЦИДИВИРУЮЩЕЙ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИЕЙ // Международный журнал прикладных и фундаментальных исследований. 2018. № 4. С. 67-71;URL: https://applied-research.ru/ru/article/view?id=12185 (дата обращения: 03.03.2026).

