Ограниченный протеолиз белков является одним из важнейших средств регулирования деятельности организма, поэтому его изучение необходимо для понимания механизмов модификации белка при патологии [1]. При этом особый интерес представляют не денатурационные процессы, а тонкие конформационные переходы. Удобной моделью для таких исследований является спонтанный гидролиз С3 компонента комплемента [2].
Среди белков системы комплемента компонент С3 – наиболее универсальная и многофункциональная молекула. Одной из значимых его особенностей является способность ковалентно присоединяться к акцепторным молекулам на поверхности клетки через эфирную или амидную связи [3, 4]. Это свойство C3 проявляет благодаря наличию внутримолекулярной тиоэфирной связи в α-цепи. Тиоэфирная связь формируется в течение посттрансляционной модификации между тиольной группой цистеина и аминогруппой глутамина в пределах последовательности Gly-Cys988-Gly-Glu-Gln991-Asn [5]. В результате происходит перестройка молекулы и образуется ее конформационная форма С3(Н2О), формирующая начальную конвертазу альтернативного пути активации комплемента вместе с фактором B, который, как было показано, проявляет более высокое сродство к C3(H2O) чем к C3b [6].
C3 компонент активируется как путем конвертазно-зависимого расщепления, так и путем его конформационного перехода в C3(H2O). Спонтанный гидролиз тиоэфирной связи нативного С3 происходит постоянно, в нормальной сыворотке крови количество С3(Н2О) колеблется от 0,3 до 2,5 % от общего уровня С3 [2].
Ходжкинские лимфомы (ХЛ) – злокачественное заболевание лимфатической системы, обычно проявляющееся в виде лимфоаденопатий различных локализаций, при котором немногочисленные диффузно рассеянные атипичные клетки имеют В-клеточную природу.
Неходжкинские лимфомы (НХЛ) – группа опухолей из клона лимфоидных клеток, являющихся предшественниками различной гистогенетической принадлежности и степени дифференцировки [7].
Целью данного исследования явилось изучение профиля спонтанного гидролиза С3 компонента комплемента при переходе в конформационную форму С3(Н2О) в процессе инкубации сыворотки и плазмы крови при онкопатологии.
Материалы и методы исследования
Определение уровня С3 компонента системы комплемента и его конформационной формы – С3(Н2О) проводили в процессе инкубации сыворотки и плазмы венозной крови 14 больных ХЛ и 16 НХЛ в сравнении с контрольной группой из 12 здоровых доноров. Кровь брали в две пробирки: 1 – без ЭДТА, 2 – с 0,1 М ЭДТА (рН 7,4) в соотношении 4:1 (добавление ЭДТА, хелатирующего катионы, блокирует переход фибриногена в нерастворимый фибрин, а также переводит ферменты в формы, не способные проявлять свою активность, в том числе системы комплемента). Затем сыворотку и плазму отделяли центрифугированием при 300 g, инкубировали при 37 °С в течение 1,5; 3; 5; 7; 9; 11; 24 часов, замораживали и хранили при 70 °С. Размораживание проб проводили одновременно, непосредственно перед постановкой эксперимента. Уровень С3 и С3(Н2О) определяли методом иммуноферментного анализа (ИФА) с помощью специфических моноклональных антител (МКА) [ГНЦ НИИ ОЧБ, Санкт-Петербург].
Для экспериментального исследования на животных были использованы линейные мыши BALB/c (34 самца массой 22–25 г), у которых моделировали рак путем внутрибрюшинного инъецирования клеток мышиной миеломы Sp 2/0 Ag14 (0,5×106 кл/мышь). Животным опытной группы в течение двух недель перорально вводили комплекс синтезированных соединений 3d-металлов (II): Mn, Fe, Co, Cu и Zn с глюконовой кислотой (0,4 мг/мл, суточная доза – 4 мг/кг) [2]. Cостав глюконатов отвечал формуле Mе(C6H11O7)2·2H2O, где Mе – атом металла. На 16-е сутки у животных забирали кровь из хвостовой вены и отделяли путем центрифугирования сыворотку, в которой аналогичным образом определяли С3 и С3(Н2О). Статистическую обработку результатов проводили с помощью программы «Microsoft Excel».
Результаты исследования и их обсуждение
Из представленных в табл. 1–2 данных видно, что концентрации С3 компонента и его конформационной формы С3(Н2О) при ХЛ и НХЛ через 1,5 часа после забора крови оставались на уровне здоровых доноров. Однако в процессе инкубации сыворотки и плазмы их уровень менялся, значимо отличаясь от контрольного. Так, концентрация С3 компонента в сыворотке крови (табл. 1) больных ХЛ на протяжении всех точек измерения была выше, чем в контроле: через 3, 5, 11, 24 часа (p < 0,001), через 7 и 9 часов (p < 0,01). В сыворотке крови больных НХЛ уровень С3 оставался также выше за исключением 7 часов. В плазме (табл. 2) у больных ХЛ уровень С3 также превышал контрольный. При НХЛ в отличие от ХЛ через 9 часов наблюдалось резкое снижение С3 по сравнению с контролем (p < 0,01).
Таблица 1
Уровень С3 и С3(Н2О) при инкубации сыворотки крови больных ходжкинскими (ХЛ) и неходжкинскими лимфомами (НХЛ) в сравнении со здоровыми донорами (контроль)
|
Время инкубации сыворотки, час |
С3, мкг/мл |
С3(Н2О), мкг/мл |
||||||||||||
|
1,5 |
3 |
5 |
7 |
9 |
11 |
24 |
1,5 |
3 |
5 |
7 |
9 |
11 |
24 |
|
|
Здоровые (n = 12) |
1303 ± 44,2 |
1052 ± 40,3 |
725 ± 42 |
1297 ± 62 |
998 ± 41,8 |
1148 ± 72,3 |
748 ± 43 |
10,09 ± 0,68 |
6,02 ± 0,25 |
4,31 ± 0,32 |
5,92 ± 0,34 |
6,32 ± 0,31 |
5,48 ± 0,3 |
1,3 ± 0,07 |
|
Больные ХЛ (n = 14) |
1448 ± 77,5 |
1640 ± 85 ** |
1225 ± 74,2 ** |
1746 ± 107 * |
1450 ± 103 * |
2020 ± 118 ** |
1198 ± 64,5 ** |
9,92 ± 0,66 |
9,95 ± 0,67 ** |
9,98 ± 0,56 ** |
9,93 ± 0,47 ** |
5,94 ± 0,43 |
6,05 ± 0,34 |
0,62 ± 0,03 ** |
|
Больные НХЛ (n = 16) |
1447 ± 95,8 |
2080 ± 139 ** |
1225 ± 71,6 ** |
1150 ± 41,7 |
1280 ± 66,7 * |
2175 ± 126 ** |
1410 ± 64 ** |
10,07 ± 0,65 |
10,05 ± 0,57 ** |
9,92 ± 0,57 ** |
9,95 ± 0,43 ** |
5,88 ± 0,37 |
9,93 ± 0,5 ** |
1,03 ± 0,11 |
Примечание. В сравнении с контролем (здоровые доноры): * – p < 0,01; ** – p < 0,001.
Таблица 2
Уровень С3 и С3(Н2О) при инкубации плазмы крови больных ходжкинскими (ХЛ) и неходжкинскими лимфомами (НХЛ) в сравнении со здоровыми донорами (контроль)
|
Время инкубации плазмы, час |
С3, мкг/мл |
С3(Н2О), мкг/мл |
||||||||||||
|
1,5 |
3 |
5 |
7 |
9 |
11 |
24 |
1,5 |
3 |
5 |
7 |
9 |
11 |
24 |
|
|
Здоровые (n = 12) |
1024 ± 49 |
625 ± 42,2 |
524 ± 28,3 |
648 ± 31,8 |
676 ± 43,2 |
897 ± 52,8 |
518 ± 24 |
10,06 ± 0,4 |
4,43 ± 0,27 |
4,05 ± 0,25 |
4,3 ± 0,21 |
3,96 ± 0,28 |
4,12 ± 0,29 |
3,23 ± 0,16 |
|
Больные ХЛ (n = 14) |
874 ± 62,5 |
1049 ± 68,5 ** |
1342 ± 65,5 ** |
1343 ± 64,5 ** |
1075 ± 70,8 ** |
1345 ± 72,3 ** |
963 ± 67,7 ** |
9,97 ± 0,55 |
9,89 ± 0,52 ** |
7,48 ± 0,27 ** |
7,52 ± 0,51 ** |
9,86 ± 0,91 ** |
5,92 ± 0,45 * |
5,11 ± 0,3 ** |
|
Больные НХЛ (n = 16) |
952 ± 46,5 |
1396 ± 81,7 ** |
1050 ± 60,5 ** |
1250 ± 97,1 ** |
475 ± 25,5 * |
1197 ± 57,7 * |
800 ± 50,3 ** |
10,04 ± 0,59 |
3,9 ± 0,21 |
9,96 ± 0,52 ** |
5,89 ± 0,45 * |
9,92 ± 0,75 ** |
5,5 ± 0,34 * |
4,9 ± 0,32 ** |
Примечание. В сравнении с контролем (здоровые доноры): * – p < 0,01; ** – p < 0,001.
Концентрация С3(Н2О) в сыворотке крови больных ХЛ в процессе инкубации изменялась по сравнению с контрольными пробами неоднократно: через 3, 5 и 7 часов уровень С3(Н2О) превышал (p < 0,001), а через 24 часа – наоборот, становился ниже контрольного уровня (p < 0,001). У больных НХЛ уровень С3(Н2О) в сыворотке крови в первые 7 часов инкубации почти не менялся, оставаясь в пределах от 10,07 ± 0,65 мкг/л до 9,92 ± 0,57 мкг/л, превышая контроль через 3, 5 и 7 часов (p < 0,001). При этом его содержание в сыворотке крови здоровых лиц существенно снижалось уже к 3 часу наблюдений. К 24 часам инкубации уровень С3(Н2О) в сыворотке крови, как доноров, так и больных НХЛ резко снижался.
В плазме крови (табл. 2) результаты были более стабильными: при ХЛ уровень С3(Н2О) на протяжении всего времени наблюдений оставался выше контрольного. При НХЛ через 1,5 и 3 часа инкубации концентрация С3(Н2О) не отличалась от контроля, снижаясь к 3 часу. Но уже к 5 часу уровень С3(Н2О) при НХЛ становился выше, чем в контроле примерно в 2,5 раза (p < 0,001), затем к 7 часам снижался и к 9 часам вновь поднимался, превышая контроль в 2,5 раза (p < 0,001). Через 11 и 24 часа инкубации уровень С3(Н2О) падал почти в 2 раза, при этом также оставаясь выше, чем в контроле (p < 0,001).
На рис. 1–2 показано, что доля С3(Н2О) от С3 ( %) у больных ХЛ, НХЛ и здоровых людей на протяжении 24 часов инкубации сыворотки и плазмы изменялась различным образом. В сыворотке (рис. 1) разница между ХЛ и контролем наблюдалась через 5, 7 (при ХЛ выше, чем в контроле), 9, 11 и 24 часа инкубации (в контроле выше, чем при ХЛ). У больных НХЛ данный показатель превышал контроль так же, как и при ХЛ, через 5 и, в большей степени, через 7 часов инкубации сыворотки.
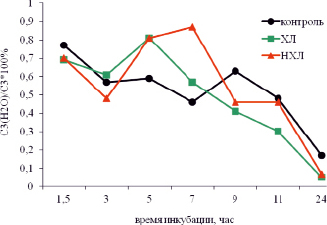
Рис. 1. Изменение уровня С3(Н2О)/ С3*100 % при инкубации сыворотки крови больных ходжкинскими (ХЛ) и неходжкинскими лимфомами (НХЛ) в сравнении с контролем
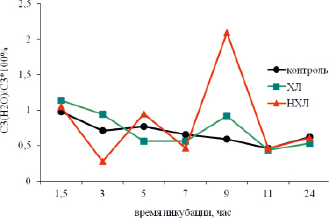
Рис. 2. Изменение уровня С3(Н2О)/ С3*100 % при инкубации плазмы крови больных ходжкинскими (ХЛ) и неходжкинскими лимфомами (НХЛ) в сравнении с контролем
В плазме крови (рис. 2) резкое увеличение показателя С3(Н2О)/С3 наблюдалось позднее – через 9 часов инкубации.
Обсуждая причины данного феномена, мы исходили из того, что появление дополнительного количества белков при опухолевых заболеваниях способствует увеличению модифицированных белков.
Конформационный переход белка при его функционировании чаще всего осуществляется на уровне субъединичных и субдоменных структур, а основные модули остаются более или менее интактными. При лигандировании такие белки часто присоединяют избыточное количество лиганда и таким образом еще больше модифицируются [1]. Так, например, для IgG была доказана зависимость его конформации и свойств от взаимодействия с амфифильными лигандами [2].
Поэтому при опухолевых заболеваниях, сопровождающихся деструктивными процессами опухолевых клеток и тканей, обнаруживаются качественно измененные IgG, отличающиеся от нормальных иммуноглобулинов повышенной конформационной ригидностью. Можно полагать, что белок С3 при неопластических процессах также претерпевает модификационные изменения, вызванные появлением большего (по сравнению со здоровыми донорами) количества нуклеофилов, которые обнажают тиоэфирную связь, что делает ее доступной для МКА, взаимодействующих с антигенной детерминантой, расположенной на С3(Н2О). Кроме того, при неопластических процессах увеличивается количество протеолитических ферментов, которые расщепляют С3, роль которых доказывает то, что в сыворотке крови, где ферменты не блокированы ЭДТА, увеличение уровня конформационной формы С3(Н2О) наблюдалось раньше, чем в плазме.
Подобные изменения наблюдались в плазме крови больных раком молочной железы [2], а также у мышей с привитой миеломой Sp 2/0 Ag14 [8].
В эксперименте на мышах линии BALB/c с привитой миеломой было показано, что после двухнедельной терапии животных комплексным препаратом из синтезированных двухвалентных глюконатов 3d-металлов (Mn, Fe, Co, Cu и Zn), приготовленных в физиологических концентрациях, которые, как было нами показано ранее, обладают иммуномодулирующими свойствами [9], происходила коррекция профиля гидролиза С3.
Таким образом, различия в профиле спонтанного гидролиза С3 компонента комплемента при инкубации сыворотки и плазмы крови онкобольных и здоровых лиц могут быть использованы в качестве дополнительного биохимического маркера при диагностике онкологических заболеваний.
Библиографическая ссылка
Князева О.А., Киреева Е.А. ПРОФИЛЬ ГИДРОЛИЗА C3 КОМПОНЕНТА КОМПЛЕМЕНТА – БИОХИМИЧЕСКИЙ МАРКЕР ОНКОПАТОЛОГИИ? // Международный журнал прикладных и фундаментальных исследований. 2018. № 4. С. 96-100;URL: https://applied-research.ru/ru/article/view?id=12190 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12190

