Рак молочной железы (РМЖ) – наиболее распространенное онкологическое заболевание у женщин в мире. В структуре заболеваемости женского населения России онкологической патологией РМЖ занимает лидирующую позицию (21,2 %). Стандартизованный показатель заболеваемости РМЖ женского населения России составляет 82,99 на 100000 населения. Прирост данного параметра с 2004 по 2014 гг. составил 29,47 % [1].
Основной причиной гибели больных РМЖ является прогрессирование заболевания, сопровождающееся развитием отдалённых метастазов. Средняя продолжительность жизни больных генерализованным РМЖ 2–3,5 года, пятилетняя выживаемость составляет 40 % и только 10 % пациенток живут свыше 10 лет [2]. К сожалению, необходимо констатировать, что метастатический РМЖ является неизлечимым заболеванием. Вследствие этого основной задачей лечения генерализованного РМЖ является продление жизни пациенток с минимальной потерей ее качества. На сегодняшний день ведущим направлением терапии больных метастатическим РМЖ является системная цитостатическая терапия. В то же время существует категория пациенток, составляющая около 5 % от числа всех пациенток метастатическим РМЖ, у которых выявляются изолированные отдаленные метастазы в границах одного органа или зоны [3]. В настоящее время данная категория больных стала обращать на себя пристальное внимание онкологов. К таким больным применяют индивидуализированный подход, в основе которого лежит комплексное лечение, включающее хирургический, радиологический и лекарственный методы, применяемые как к первичному очагу, так и к отдаленным метастазам. Задачей применяемой терапии является не только замедление роста метастатических очагов РМЖ и регресс местных проявлений заболевания, но и уменьшение общей биологической массы опухоли. Более 25 % пациенток с изолированными отдаленными метастазами РМЖ, в лечении которых использовалась подобная тактика, жили 15 и более лет. Интересно, что лимитирующим фактором для продолжительности жизни данной категории пациенток является метастатическое поражение печени, так как наличие метастазов в других органах (исключением являются метастазы в головной мозг) не влияет на продолжительность жизни, при условии радикального удаления метастазов в печени [4]. Объясняется это медленным ростом метастазов других локализаций.
Метастатическое поражение печени при РМЖ по данным разных авторов, составляет 15–30 %, тогда как при аутопсии метастазы в печени выявляют у 30–50 % больных. Одиночное изолированное метастатическое поражение печени диагностируется только у 3–9 % больных РМЖ. Наличие метастазов в печени сопровождается плохим прогнозом (медиана выживаемости < 6 месяцев) и только в исключительных случаях таким пациентам удается прожить более двух лет после назначения терапии [5].
Как правило, лечение при метастазировании РМЖ в печень является системным, в настоящее время ведутся работы, направленные на устранение химиорезистентности печеночных метастазов РМЖ [6]. Современные возможности местной терапии отдаленных метастазов, такие как хирургическая резекция и радиочастотная абляция в сочетании с эффективным системным лечением, активно применяются у данной категории больных [7]. Выявлено, что при изолированном хирургическом лечении метастазов РМЖ в печень, медиана и 3-летняя общая выживаемость составляют 53,4 мес. и 75,2 % соответственно. Медианный безрецидивный интервал составляет при этом 28,5 мес. [8, 9]. Хирургическая резекция печеночных метастазов в сочетании с высокодозной неоадъювантной химиотерапией дает 5-летнюю выживаемость свыше 22 % [10]. Применение химиотерапии позволяет достичь полной ремиссии метастатического очага в печени у 20 % больных, частичный ответ развивается в 33 % случаев, но продолжительность его составляет не более шести месяцев. В последнее время в лечении больных метастатическим РМЖ с поражением печени широко применяются методы интервенционной радиологии [11]. Такие методы обладают рядом преимуществ по сравнению с системной химиотерапией: введение цитостатика непосредственно в артериальное русло печени и метастатических узлов позволяет достичь локально терапевтической концентрации при значительно меньшем общем объеме лекарственного препарата, а дополнительная окклюзия артерий печени увеличивает время нахождения лекарства непосредственно в метастатических узлах, усиливая лечебный эффект [12, 13]. В работах, сочетающих системную химиотерапию и химиоэмболизацию, показано, что частота откликов на лечение составляет 81 %, а общая выживаемость достигает 12,5 месяцев. Применяемые режимы и схемы системной химиотерапии также оказывают влияние на прогноз, в настоящее время в основном используют более поздние протоколы химиотерапии, включающие антрациклин и/или таксаны, объективный ответ на лечение при этом фиксируется у 34 % пациентов [14].
Церебральные метастазы РМЖ являются грозным осложнением онкологического процесса. РМЖ является второй наиболее распространенной формой рака, метастазирующей в головной мозг [15]. У 10 % пациенток РМЖ выявляются метастазы в головном мозге. На современном этапе развития онкологии качество лечения диссеминированного РМЖ улучшается, пациенты живут дольше и частота выявления метастазов в головном мозге увеличивается [16, 17]. Как правило, внутричерепные метастазы РМЖ являются поздним проявлением болезни и только 15–50 % таких больных адекватно отвечают на проводимую терапию, эффективность которой во многом определяет молекулярный подтип опухоли. Her2-положительный статус опухоли повышает вероятность развития метастазов в головной мозг. Гиперэкспрессия her2 выявляется примерно в 20 % случаев РМЖ и почти у половины пациентов с этим подтипом опухоли выявляются метастазы в головной мозг [18]. Интересно, что в 24 % случаев выявляется несовпадение в her-2 статусе между первичной опухолью и метастатическим очагом. Кроме того, her2-положительные опухоли, как и гормон-рецептор-отрицательные имеют повышенный риск развития рецидива в ЦНС [19].
Метастатическое поражение головного мозга считается фатальным: без лечения или с применением только глюкокортикостероидов медиана выживаемости больных с метастазами в головном мозге составляет один-два месяца. Тотальное облучение головного мозга увеличивает продолжительность жизни таких больных до 3–6 месяцев, исторически сложилось так, что данный метод лечения был основой лучевой терапии церебральных метастазов; однако его возможности ограничены значительными нейрокогнитивными осложнениями, развивающимися впоследствии. Применение стереотаксической радиохирургии позволяет увеличить среднюю продолжительность жизни пациенток до 6–8 месяцев. Пациентки с системным РМЖ и изолированными метастазами в головной мозг, которым хирургическая резекция дополнялась лучевой терапией, живут дольше и имеют лучшее качество жизни, чем те, кто был отлечен только лучевой терапией. Однолетняя выживаемость пациентов с множественными внутричерепными метастазами, подвергавшихся резекции с последующей стереотаксической радиохирургией, как к опухолевому ложу, так и к синхронным поражениям, не отличается от таковой для пациенток с изолированным поражением головного мозга. Общая медиана выживаемости при сочетании двух методов лечения составила (22,9 ± 6,2 мес) [20–22].
В настоящее время целесообразность лечения метастазов РМЖ в головной мозг не подвергается никакому сомнению. Варианты лечения включают хирургическое удаление метастазов, лучевое лечение, химиотерапию и стереотаксическую радиохирургию. Одногодичная медиана выживаемости пациенток с метастазами в головной мозг, отлеченных хирургическим методом, а также после адъювантной радиохирургии составляет около 50 % [23, 24].
Практика показывает, что индивидуальные лечебные программы с использованием современных препаратов и методик позволяют добиться стойкой клинической ремиссии при метастатическом РМЖ [25].
Клинический пример. Пациентка Л., 1958 г.р. была госпитализирована в отделение опухолей костей, кожи, мягких тканей и молочной железы №1 ФГБУ «РНИОИ» Минздрава РФ 25.03.2010 по поводу верифицированного рака правой молочной железы Т2NХМ0, ст. II, амплифицирующий тип, кл. гр. 2. По данным комплексного обследования признаков отдаленных метастазов в других органах и системах выявлено не было (СРКТ головного мозга от 18.03.10: без очагов. СРКТ органов грудной клетки, органов брюшной полости, органов малого таза от 18.03.10: данных за очаговое поражение исследуемых органов нет). 29.03.2010 первым этапом лечения выполнена радикальная мастэктомия справа по Маддену, гистоанализ № 18612-13/10: инфильтрирующий протоковый рак, № 19290-99/10: в молочной железе после секторальной резекции опухоли нет, в коллекторных клетчатках и л/узлах метастазов нет, ИГХ от 31.03.2010: карцинома молочной железы с отсутствием экспрессии белков рецепторов эстрогена и прогестерона, с наличием гиперэкспрессии С-erb-2 (3+), с пролиферативной активностью Ki-67 (40 %). Послеоперационный период протекал без осложнений, рана зажила первичным натяжением, больная выписана из стационара на 10-е сутки.
В апреле 2010 проведен курс ДГТ на мягкие ткани области послеоперационного рубца, аксиллярные л/узлы справа, над- и подключичные л/узлы справа до СОД 40 изоГр. От проведения адъювантной полихимиотерапии больная отказалась.
В мае 2011 г. (спустя год после лечения) при выполнении контрольной СРКТ органов брюшной полости в правой доле печени выявлен солитарный метастатический очаг размером 7,5 см в диаметре. По данным УЗИ органов брюшной полости от 20.05.2011 (рис. 1): в правой доле печени в S8 визуализируется солитарное очаговое образование размерами 6,12×4,4 см с гипоэхогенным периферическим контуром. Метастатический очаг верифицирован гистологически (24.05.2011 выполнена чрескожная пункционная биопсия печени под УЗ контролем, гистоанализ № 32497-498/11: метастаз рака молочной железы). Пациентка была консультирована абдоминальным хирургом: хирургическое лечение возможно лишь в объеме гемигепатэктомии, что при вторичном характере процесса было нецелесообразным.
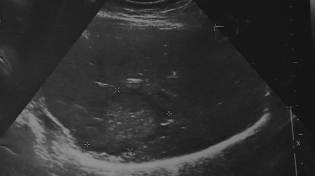
Рис. 1. Метастатический очаг в правой доле печени (20.05.2011 г.)
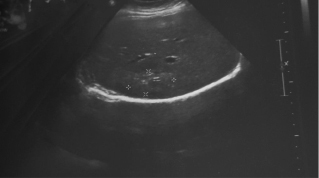
Рис. 2. Участок фиброза в печени на месте метастатического очага (03.11.2011 г.)
С 02.06.11 по 02.11.11 проведено 6 курсов полихимиотерапии. Суммарно введено: доксорубицина – 345 мг, таксотера – 486 мг. Также проводилась таргетная терапия герцептином в стандартном режиме.
После проведенного системного лечения 03.11.2011 выполнено контрольное сонографическое исследование печени: очаговые изменения не определяются, в S8 определяется участок повышенной эхогенности, без четких контуров, размерами 4,46×2,4 см, с кальцинированными включениями (сонографически – участок фиброза в зоне солитарного метастатического очага, описанного ранее при УЗИ № 983 от 20.05.2011), выраженная положительная динамика после лечения (рис. 2).
Эффективность проведенного лечения подтверждена 29.12.2011 на СРКТ органов брюшной полости и органов малого таза: в печени жировой гепатоз, объемных образований не выявлено.
В период с декабря по март 2013 г. у пациентки наблюдалась полная клинико-рентгенологическая и сонографическая ремиссия.
В марте 2013 г. появились жалобы на головные боли, головокружение, в связи с чем больная была обследована, выявлено метастатическое поражение мозжечка (МРТ головного мозга от 02.03.2013: МР картина объемных образований полушарий мозжечка с признаками масс-эффекта, более вероятно, вторичного характера (в левой гемисфере 24×34×25 мм, в правой гемисфере 8×13×10 мм) (рис. 3). По данным СРКТ органов грудной клетки, брюшной полости, костных структур от 04.03.2013 метастатических очагов в других органах нет.
07.03.13 в условиях отделения нейроонкологии ФГБУ РНИОИ Минздрава РФ была выполнена субокципитальная краниотомия, удаление двух метастатических очагов в гемисферах мозжечка. Операция выполнена под контролем нейронавигационной системы «StealthStation S7» с использованием операционного микроскопа OPMI PENETRO, ультразвуковой, высокочастотной, холодно-плазменной деструкции и коагуляции, микрохирургического инструментария. Г.А. № 13052-7/13: метастаз рака молочной железы.
После операции проведено 8 курсов химиотерапии (ломустин 120 мг внутрь), 4 курса интратекальной химиотерапии, включающей метотрексат, гидрокортизон, карбоплатин.
Динамическое наблюдение и данные инструментальных обследований – сонографии, МРТ, СРКТ, проведенных с марта 2013 по октябрь 2017 гг. подтверждают стойкую ремиссию заболевания.
МРТ головного мозга от 01.06.17 (рис. 4): МР-картина состояния после удаления очагового поражения полушарий мозжечка справа и слева: данных за рецидив после субокципитальной краниотомии нет. Состояние после вентрикулопункции в правой теменной области. Без динамики с марта 2013 г.
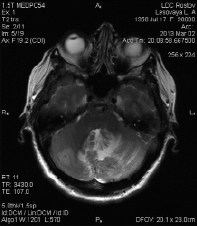
Рис. 3. Метастатическое поражение гемисфер мозжечка
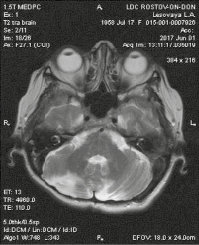
Рис. 4. Постоперационные изменения в обеих гемисферах мозжечка
Сонографически в печени очаговых образований нет, в S8 определяется зона фиброза.
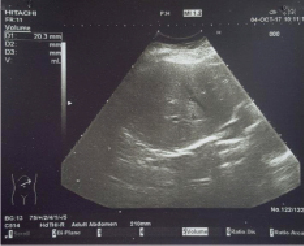
Рис. 5. УЗИ правой доли печени
Таким образом, пациентка наблюдается без признаков рецидива и метастазов с 2013 г. по настоящее время, социально активна, работает.
Заключение
Основной задачей лечения больных метастатическим РМЖ является нивелирование проявлений заболевания, сдерживание дальнейшей диссеминации опухоли, увеличение продолжительности жизни и минимизация влияния применяемого лечения на качество жизни пациенток.
Развитие современной онкологии в последнее десятилетие кардинально изменило отношение к лечению больных метастатическим РМЖ. Несомненным остается факт необходимости комплексного подхода к терапии данной категории пациенток. Наряду с хирургическим методом, лучевой терапией, системной химио- и гормональной терапией, достижения молекулярной онкологии позволили задействовать дополнительный рычаг приложения в виде таргетных препаратов, метод химиоэмболизации артерий позволяет осуществить точечную доставку цитостатиков, увеличивает время экспозиции лекарства в метастатическом очаге. Все большее распространение получает стереотаксическая радиационная терапия, позволяющая локально облучать труднодоступные метастатические узлы.
Таким образом, несмотря на то, что метастатический РМЖ остается неизлечимым на сегодняшний день, данное состояние надо рассматривать как хронический процесс, требующий постоянного контроля и сугубо индивидуализированного подхода к лечению.
Библиографическая ссылка
Ващенко Л.Н., Бакулина С.М., Черникова Е.Н., Тетерников А.В. СОВРЕМЕННЫЕ ВОЗМОЖНОСТИ ЛЕЧЕНИЯ МЕТАСТАТИЧЕСКОГО РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ // Международный журнал прикладных и фундаментальных исследований. 2018. № 4. С. 165-170;URL: https://applied-research.ru/ru/article/view?id=12204 (дата обращения: 03.03.2026).

