Основной задачей химической технологии является обеспечение условий для протекания химических реакций на производстве с максимальным экономическим эффектом, т.е. оптимальных технологических условий. Основополагающими характеристиками любого химико-технологического процесса являются расчетные значения, полученные путем математического вычисления соответствующих параметров. Расчеты представляют собой наиболее трудоемкую часть проектирования производств, позволяют определить наилучшие условия для проведения процесса, наметить пути сокращения потерь [1, 2].
Алгоритмы расчетов
Основными расчетами химико-технологических процессов являются:
1. Расчет материального баланса, основанный на законе сохранения массы веществ в химических реакциях, открытом М.В. Ломоносовым ещё в 1748 году. При расчете материального баланса необходимо помнить, что суммарная масса веществ, вступающих в процесс, должна быть равна суммарной массе всех полученных продуктов, включая побочные реакции и потери. Чем чище проходит химическое взаимодействие, чем меньше побочных продуктов, и чем выше выход реакции, тем больше получается искомого, желаемого продукта. А это и является практической задачей, практическим результатом всего химико-технологического процесса. Материальный баланс может быть составлен как для всего химико-технологического процесса, что представляет определенную сложность, так и для отдельных стадий или отдельного аппарата [3].
При расчете материального баланса необходимо учесть массы реагентов, поступающих в процесс, и массы готового, искомого продукта, результаты побочных процессов и неизбежные потери вещества. Здесь могут возникать некоторые сложности, так как химико-технологические процессы разнообразны и разноплановы, подчиняются разным стехиометрическим уравнениям, а химические вещества многочисленны, имеют свои особенные, индивидуальные физические и химические свойства. Из этого следует, что расчет материального баланса хотя и следует определенной логике, но не имеет алгоритма или клише, общего для всех химических процессов. Каждый расчет индивидуален.
2. Расчет теплового (энергетического) баланса, основанный на законе сохранения энергии. При расчете теплового баланса следует помнить, что суммарная энергия, поступающая в химический процесс, должна быть равна суммарной энергии, образовавшейся в ходе процесса. Энергетический расчет (так же как и материальный) может быть осуществлен как для всего химико-технологического процесса (что достаточно сложно и трудоемко), так и для отдельных стадий или аппаратов. Тепловой расчет строится на основе материального. Выполнение расчета теплового баланса более стандартно, так как имеются общие алгоритмы вычислений, применимые к большинству химико-технологических процессов. При расчете прихода энергии в процесс учитываются:
– энергетический запас поступающих веществ [4]. Каждое вещество является хранителем и источником энергии, обладает внутренней энергией. Количественно запас энергии, скрытый в веществах Q, можно оценить, зная величины удельной теплоемкости С, массы, объемы или количества веществ М, температуру t, по формуле
Q = MCt.
Здесь необходимо обращать внимание на единицы измерения, в которых выражается удельная теплоемкость: ккал или кДж, приходящиеся на кг, м3 или моль;
– теплота, выделяющаяся в ходе экзотермических реакций. Необходимо также учитывать тепловые эффекты, происходящие при различных физических процессах, сопровождающих химические реакции, такие как испарение, конденсация, растворение, переходы из одного агрегатного состояния в другое;
– теплота, привнесенная извне путем нагрева аппарата. Значение имеет способ подогрева: горячими газами, путем сжигания различных видов топлива, электроподогревом. Величина зависит от типа и устройства аппарата и от конкретных, специфических условий проведения процесса;
При расчете расхода энергии необходимо учитывать:
– унос энергии с продуктами реакции, выполняющийся по тем же формулам, что и приход;
– теплоту, поглощаемую в ходе эндотермических реакций, а также сопутствующих физических процессах;
– неизбежные теплопотери, учет которых также представляет некоторую сложность.
Расчет материального баланса
В настоящей работе основное внимание уделяется расчету материального баланса на примере классического химико-технологического процесса получения серной кислоты на основе использования серного колчедана [3, 5]. Для примера приведем расчет материального баланса печи кипящего слоя, в которой происходит обжиг колчедана.
Примем для расчета следующие исходные данные: производительность печи GH2SO4 25,10 т/ч, степень использования серы β 0,750, расход сухого колчедана (45 % S) 0,82 т, содержание серы в колчедане CS 38 %, содержание влаги в колчедане СВЛ 9 %, содержание серы в огарке CS(ОГ) 1,6 %, содержание SO2 в сухом обжиговом газе CSO2 13,4 %, содержание SO3 в сухом обжиговом газе CSO3 0,1 %, содержание в воздухе O2 – 22 %, N2 – 77 %, относительная влажность воздуха φ 53 %.
Выполнение расчета:
Общее содержание серы в колчедане:
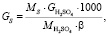 (1.1)
(1.1)
где МS – молярная масса серы, г/моль;
GH2SO4 – производительность печи, кг/ч;
β – степень использования серы, т.
Подставляя известные данные в формулу (1.1), получаем
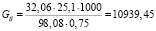 кг/ч.
кг/ч.
Количество сухого колчедана рассчитываем по формуле
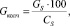 (1.2)
(1.2)
где СS – содержание серы в колчедане, %.
Подставляя известные данные в формулу (1.2), получаем
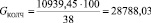 кг/ч.
кг/ч.
Количество влаги в колчедане:
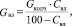 (1.3)
(1.3)
где GКОЛЧ – количество сухого колчедана, кг/ч;
СВЛ – содержание влаги в колчедане, %.
Подставляя известные данные в формулу (1.3), получаем
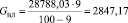 кг/ч.
кг/ч.
Количество огарка:
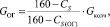 (1.4)
(1.4)
где СS(ОГ) – содержание серы в огарке; %.
Подставляя известные данные в формулу (1.4), получаем
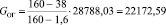 кг/ч.
кг/ч.
Количество серы в огарке:
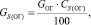 (1.5)
(1.5)
где GОГ – содержание серы в огарке, %.
Подставляя известные данные в формулу (1.5), получаем
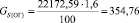 кг/ч.
кг/ч.
Потеря серы с огарком:
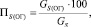 (1.6)
(1.6)
где GS(ОГ) – количество серы в огарке, кг/ч;
GS – общее содержание серы в колчедане, кг/ч.
Подставляя известные данные в формулу (1.6), получаем
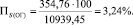
Количество выгоревшей серы:
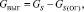 (1.7)
(1.7)
где GS(ОГ) – количество серы в огарке, кг/ч;
GS – общее содержание серы в колчедане, кг/ч.
Подставляя известные данные в формулу (1.7), получаем
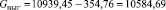 кг/ч.
кг/ч.
Общий объем SO2 и SO3:
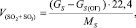 (1.8)
(1.8)
где GS(ОГ) – количество серы в огарке, кг/ч;
Gs – общее содержание серы в колчедане, кг/ч;
Ms – атомная масса серы, г/моль.
Подставляя известные данные в формулу (1.8), получаем
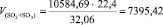 м3/ч.
м3/ч.
Объем SO2:
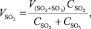 (1.9)
(1.9)
где VSO2+SO3 – общий объем SO2 и SO3, кг/м3;
СSO2 – содержание SO2 в сухом обжиговом газе, %;
СSO3 – содержание SO3 в сухом обжиговом газе, %.
Подставляя известные данные в формулу (1.9), получаем
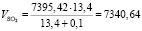 м3/ч.
м3/ч.
Объем SO3:
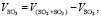 (1.10)
(1.10)
где VSO2+SO3 – общий объем SO2 и SO3, кг/м3;
VSO2 – объем SO2, кг/м3.
Подставляя известные данные в формулу (1.10), получаем
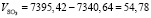 м3/ч.
м3/ч.
Объем сухого обжигового газа:
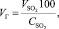 (1.11)
(1.11)
где VSO2 – объем SO2, кг/м3;
СSO2 – содержание SO2 в сухом обжиговом газе, %.
Подставляя известные данные в формулу (1.11), получаем:
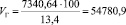 м3/ч.
м3/ч.
Концентрация O2:
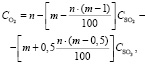 (1.12)
(1.12)
где n – содержание кислорода в воздухе (22 %);
m – стехиометрическое отношение числа молекул кислорода к числу молекул диоксида серы по балансовому уравнению
4FeS2 + 11O2 = 8SO2 + 2Fe2O3
m = 11/8 = 1,375;
CSO2 – содержание SO2 в сухом обжиговом газе, %;
СSO3 – содержание SO3 в сухом обжиговом газе, %.
Сводная таблица материального баланса
|
Приход |
Кол–во |
Расход |
Кол–во |
||
|
кг |
м3 |
кг |
м3 |
||
|
Сухой колчедан |
28788,03 |
– |
Огарок |
22172,59 |
– |
|
Влага колчедана |
2847,17 |
– |
Обжиговый газ |
||
|
Сухой воздух |
75499,4 |
58314,70 |
SO2 |
20973,3 |
7340,64 |
|
Пары воды в воздухе |
556,4 |
692,95 |
SO3 |
195,6 |
54,78 |
|
O2 |
3545,1 |
2483,16 |
|||
|
N2 |
56129,9 |
44902,32 |
|||
|
H2O |
3403,6 |
4236,09 |
|||
|
Всего |
107691 |
59007,65 |
Всего |
107420,09 |
59016,99 |
Подставляя известные данные в формулу (1.12), получаем
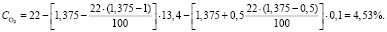
Объем O2 в обжиговом газе:
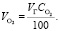 (1.13)
(1.13)
Подставляя известные данные в формулу (1.13), получаем
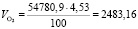 м3/ч.
м3/ч.
Объем N2 в обжиговом газе:
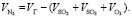 (1.14)
(1.14)
Подставляя известные данные в формулу (1.14), получаем
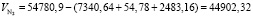 м3/ч.
м3/ч.
Объем сухого воздуха, поступающего на обжиг колчедана:
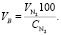 (1.15)
(1.15)
Подставляя известные данные в формулу (1.15), получаем
 м3/ч.
м3/ч.
Объем паров воды в воздухе при 20 °С при относительной влажности воздуха 53 %:
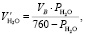 (1.16)
(1.16)
где РН2О – парциальное давление паров воды при температуре 20 °С.
Подставляя известные данные в формулу (1.16), получаем
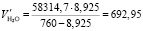 м3/ч.
м3/ч.
Общий объем паров H2O в обжиговом газе:
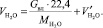 (1.17)
(1.17)
Подставляя известные данные в формулу (1.17), получаем
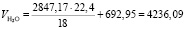 м3/ч.
м3/ч.
По результатам расчета составляется сводная таблица, в которой проводится сравнение величин прихода и расхода химических веществ, масс (кг) или объемов (м3). Сводим результаты расчета в таблицу.
Невязка баланса составляет 0,025 %, что связано в основном с округлением цифр при расчетах и является допустимым.
Заключение
Таким образом, в работе рассмотрены вопросы обеспечения оптимальных условий проведения химико-технологических процессов, обсуждены особенности расчетных характеристик, наличия алгоритмов расчета материального и теплового балансов производств. Приведен пример расчета химико-технологического процесса получения серной кислоты. Составлена сводная таблица, отражающая расчетные характеристики прихода и расхода химических веществ, выраженных в единицах массы и объема.
Библиографическая ссылка
Ермолаева В.А. АЛГОРИТМЫ РАСЧЕТА И РАСЧЕТНЫЕ ХАРАКТЕРИСТИКИ ХИМИКО-ТЕХНОЛОГИЧЕСКИХ ПРОЦЕССОВ // Международный журнал прикладных и фундаментальных исследований. 2018. № 5-1. С. 28-32;URL: https://applied-research.ru/ru/article/view?id=12211 (дата обращения: 02.02.2026).

