Гипертоническая болезнь (ГБ) относится к самым распространенным патологиям сердечно-сосудистой системы во всем мире [1, 2]. Имеются данные о том, что в патогенезе эссенциальной артериальной гипертензии (ЭАГ) немаловажная роль принадлежит нарушениям структурно-функциональных свойств клеточных мембран [3]. Классической моделью для изучения свойств мембран при различной патологии является мембрана эритроцита, так как ей присущи общие принципы молекулярной организации плазматических мембран. Цитоплазматическая мембрана эритроцита является ключевой в обеспечении и регуляции физиологической активности этих клеток. Сложная структурная организация мембраны, главным компонентом которой являются белки, обеспечивает ее специфические функции. В проведенных ранее исследованиях было установлено, что изменение взаимоотношений белковых компонентов мембраны при ЭАГ оказывает влияние на формирование и развитие сфероцитарных клеток [4]. Такие эритроциты с ослабленной способностью к деформации и сниженной пластичностью не могут эффективно осуществлять газообмен, что приводит к ухудшению кровотока в системе микроциркуляции органов и тканей [5]. Показано, что ведущими факторами формирования приобретенного сфероцитоза у больных с ЭАГ, осложненной метаболическим синдромом, являются структурно-функциональные нарушения взаимосвязей таких мембранных белков, как α-спектрин, анионтранспортный белок, глицеральальцегид-3-фосфатдегидрогеназа. У пациентов с ЭАГ, не осложненной метаболическим синдромом – анионтранспортный белок, глицеральальцегид-3-фосфатдегидрогеназа и актин. Следовательно, приобретенный сфероцитоз у больных с ЭАГ, осложненной и не осложненной метаболическим синдромом может быть обусловлен нарушением метаболических процессов на мембранном уровне [6, 7]. Вместе с тем, возникла необходимость установить, какие факторы и условия влияют на формирование сфероцитарного пула клеток у пациентов с разной степенью ЭАГ.
Цель работы – установление взаимосвязи между показателем сферичности эритроцитов и уровнем белков их мембраны, а также некоторыми эндогенными факторами природы у больных с эссенциальной артериальной гипертензией I-й и II-й степени.
Материалы и методы исследования
В исследовании принимали участие пациенты мужского пола с ГБ I-й (n = 27) и II-й степенью (n = 24), средний возраст – 42 ± 1,5 лет. Диагноз устанавливался по данным анамнеза и клинико-инструментального обследования. Дифференциальная диагностика АГ проводилась в соответствии с рекомендациями Всероссийского научного общества кардиологов (2008). Критериями исключения больных являлись: наличие стенокардии напряжения, хроническая сердечная недостаточность выше III–IV стадии (по классификации Нью-Йоркской кардиологической ассоциации NYHA), острого инфаркта миокарда или нарушения мозгового кровообращения в предшествующие 6 месяцев, нарушения ритма сердца, обострение интеркуррентных заболеваний. Контрольную группу составили 29 клинически здоровых мужчин, средний возраст которых составил 39 ± 1,3 лет. Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинской декларации. Получено одобрение Комитета по биомедицинской этике ФГБУ НЦРВХ (протокол № 9 от 9.11.2012).
На клинической модели эссенциальной гипертензии I-й и II-й степени оценивали содержание 10-ти белков мембраны эритроцитов: α- и β-спектринов, анкирина, анионтранспортного белка (АТБ), белков полосы 4.1; глицеральальцегид-3-фосфатдегидрогеназы (Г-3-ФДГ), актина, транспортёра глюкозы (GLUT), глутатион-S-трансферазы (Гл–S-тр) и тропомиозина.
Мембраны эритроцитов выделяли по методу Dodge. Очистку водорастворимой фракции белков выполняли на центрифугах «Allegra» 64 R. Концентрацию белков устанавливали с использованием набора Qubit Protein Assay Kit («Invitrogen», США) на приборе Qubit Protein согласно инструкции фирмы-изготовителя.
Одномерный электрофорез осуществляли на полиакриламидных гелевых пластинах с концентрацией разделяющего геля 7,5 и 15 % в присутствии додецилсульфата натрия по методу Лэмми. Пластинки окрашивали раствором Кумаси R-250 («Sigma», США). Массу исследуемых белков определяли наборами маркеров фирмы Bio-Rad (N-161-0363) и Thermoscientific (N26614). Количественное содержание мембранных белков (мкг на 1 мг общего белка) рассчитывали с привлечением оригинальной программы математической обработки электрофореграмм в пакете «Mathcad-2001 Pro» [8].
Показатель сферичности эритроцитов (ПСЭ) рассчитывали по общепринятой формуле: ПСЭ = D/T, где T = V/S (D – средний диаметр эритроцитов (7,35 мкм); Т – средняя толщина эритроцитов; V – средний объем эритроцитов; S – средняя площадь основания эритроцитов). В норме ПСЭ составляет 3,4–3,9. Если величина ПСЭ ниже 3,4, это указывает на тенденцию к сфероцитозу.
Исследовали комплекс биохимических параметров крови: липидный спектр, ЛДГ, уровень мочевины, креатинина, мочевой кислоты, ферритина и глюкозы на автоматическом биохимическом анализаторе «Синхрон-9» фирмы «Bekman» (США). Уровень РФМК и фибриногена крови определяли фотометрическим методом на фотометре V-50 (Германия).
Статистическая обработка результатов проводилась с помощью пакета программ «Statistica 10.0». Значимость расхождения данных в сравниваемых группах оценивали с учётом характера распределения переменных. Для исследования взаимосвязей переменных использовали корреляционный анализ, множественную и логистическую регрессию. Различия считались достоверными при р < 0,05.
Результаты исследования и их обсуждение
Сравнительный анализ уровня изучаемых белковых компонентов у пациентов с разной степенью АГ и клинически здоровых лиц показал более высокое содержание белков полосы 4.1, Г-3-ФДГ, Гл-S-Тр и снижение величины АТБ у всех больных ЭАГ по сравнению с контролем. Однако у пациентов с I-й степенью ЭАГ это отличие касалось четырех цитоскелетных белков, а у больных со II-й степенью ЭАГ – шести белков (табл. 1).
Как следует из таблицы, изменения в мембране эритроцитов пациентов со II-й степенью ЭАГ были более значимыми, чем у пациентов с I-й степенью, и касались транспортных (АТБ), ферментативных (Г-3-ФДГ) и структурных белков (спектринов).
Анализ линейных взаимосвязей цитоскелетных белков показал, что у пациентов с I-й степенью ЭАГ все структурные белки были связаны с уровнем ферментативного белка (Г-3-ФДГ), принимающего участие в процессах гликолиза. У больных же со II-й степенью ЭАГ эта связь была обусловлена содержанием Гл-S-Тр, которая обеспечивает антиоксидантную защиту мембраны. В то же время у пациентов обеих групп выявлена тесная связь структурного белка полосы 4.1 с уровнем как транспортных, так и ферментативных белков (табл. 2).
Выявленные существенные межгрупповые различия в содержании белков мембраны эритроцитов и нарушение белок-белковых взаимосвязей могут приводить к изменению деформабельности эритроцитов и образованию повышенного количества сфероцитарных клеток. Такие эритроциты с ослабленной способностью к деформации и уменьшению пластичности не могут эффективно осуществлять газообмен, что приводит к ухудшению кровотока в системе микроциркуляции органов и тканей [9].
Анализ множественной связи показателя сферичности эритроцитов с цитоскелетными белками показал, что у пациентов с I-й степенью ЭАГ в качестве независимых переменных выступают β-спектрин, АТБ, Г-3-ФДГ и тропомиозин.
ПСЭ = 2,252+ 0,003•β-спектрин - 0,009•АТБ + 0,371•ln(Г-3-ФДГ) + 0,003•тропомиозин;
R = 0,85, R2 = 0,72, p = 0,0000;
где R – коэффициент множественной корреляции, R2 – общий коэффициент детерминации, а уровень Г-3-ФДГ нелинейно связан с величиной ПСЭ.
При этом изменение величины ПСЭ было наиболее сопряжено с отклонением уровня β-спектрина (R2 = 0,21, p = 0,017), ln(Г-3-ФДГ) (R2 = 0,24, p = 0,0025) и тропомиозина (R2 = 0,21, p = 0,0005).
У пациентов со II-й степенью АГ независимым фактором, связанным с величиной ПСЭ, был α-спектрин, а ПСЭ нелинейно связан с уровнем АТБ и Г-3-ФДГ.
ПСЭ = 3,274 + 0,003•α-спектрин – 0,112•sqrt(АТБ) + 0,204•ln(Г-3-ФДГ) + 0,002•тропомиозин;
R = 0,85, R2 = 0,72, p = 0,0000.
Таким образом, нарушение деформабельности эритроцитов у пациентов с АГ связано со снижением уровня спектринов, основная функция которых заключается в поддержании формы клеток и обеспечении устойчивости к деформации. Совокупность изменения уровня спектринов с изменением других мембранных белков (Г-3-ФДГ и АТБ) является одним из предикторов формирования приобретенного сфероцитоза, наиболее выраженного у пациентов со II-й степенью ЭАГ.
Таблица 1
Сравнительные данные количественного содержания мембранных белков у лиц контрольной группы и пациентов с разной степенью АГ (M ± m)
|
Мембранные белки |
Контрольная группа, n = 29 |
I-я степень АГ, n = 27 |
II-я степень АГ, n = 24 |
p-level |
|
α-спектрин |
99,9 ± 5,6 |
86,0 ± 9,3 |
65,6 ± 7,7 |
p1,3 = 0,002 |
|
β-спектрин |
98,3 ± 5,9 |
81,2 ± 8,3 |
66,5 ± 7,6 |
p1,3 = 0,003 |
|
АТБ |
128,4 ± 4,1 |
92,8 ± 5,7 |
76,6 ± 5,0 |
p1,2 = 0,0001; p1,3 = 0,0000; p2,3 = 0,041 |
|
полоса 4.1 |
46,2 ± 1,7 |
80,2 ± 4,9 |
70,9 ± 4,3 |
p1,2 = 0,0000; p1,3 = 0,0000; |
|
Г-3-ФДГ |
33,7 ± 2,2 |
58,1 ± 4,4 |
47,4 ± 4,0 |
p1,2 = 0,0000; p1,3 = 0,015; p2,3 = 0,042 |
|
Гл-S-Тр |
46,0 ± 4,5 |
76,6 ± 5,2 |
63,2 ± 4,9 |
p1,2 = 0,0000; p1,3 = 0,006 |
Примечание. p – значимость межгрупповых различий (t-критерий).
Таблица 2
Взаимосвязь цитоскелетных белков эритроцитов у пациентов с разной степенью АГ
|
Мембранные белки |
АТБ |
GLUT |
Г-3-ФДГ |
Гл-S-Тр |
||||
|
I-я ст. |
II-я ст. |
I-я ст. |
II-я ст. |
I-я ст. |
II-я ст. |
I-я ст. |
II-я ст. |
|
|
α-спектрин |
– |
– |
– |
– |
0,43 |
– |
– |
0,44 |
|
β-спектрин |
0,45 |
0,40 |
0,49 |
|||||
|
анкирин |
0,55 |
0,62 |
0,52 |
0,59 |
0,53 |
0,58 |
0,82 |
|
|
полоса 4.1 |
0,95 |
0,89 |
0,89 |
0,87 |
0,89 |
0,77 |
0,79 |
0,84 |
|
актин |
0,73 |
0,54 |
0,68 |
0,57 |
0,62 |
0,76 |
0,44 |
|
|
тропомиозин |
0,64 |
– |
0,53 |
– |
0,46 |
– |
0,80 |
0,57 |
Примечание. I-я ст. – пациенты с I-й степенью АГ, II-я ст. – пациенты со II-й степенью АГ. Значимость всех коэффициентов Пирсона: p < 0,05.
Для оценки влияния комплекса биохимических параметров крови все пациенты с разной степенью ЭАГ были разбиты на две категории: 1 категория – пациенты, у которых показатель был меньше найденной его средней величины, 2 категория – показатель больше найденной его средней величины. В каждой категории были установлены доверительные интервалы соответствующего показателя ( ± 95 %).
Проведенное исследование с помощью одно- и двухфакторного дисперсионного анализа у двух категорий пациентов с ЭАГ выявило у них разные условия, при которых наблюдались существенные сдвиги в уровне цитоскелетных белков, имеющих наибольшую сопряженность с отклонением ПСЭ. Установлено, что у пациентов с I-й степенью ЭАГ, у которых САД (систолическое артериальное давление) или ЛДГ были ниже их средних показателей, уровень β-спектрина был значительно выше, чем у категории пациентов с более высокими значениями этих переменных (табл. 3). Причем, если у пациентов 2 категории наблюдалось одномоментное превышение средней величины САД и активности ЛДГ, то разница между уровнем β-спектрина у пациентов 1-й и 2-й категорий становилась еще более значительной (p1 = 0,006).
У пациентов 2-х категорий со II-й степенью ЭАГ отмечено изменение уровня α-спектрина под влиянием других эндогенных факторов. Так, если ДАД (диастолическое артериальное давление) превышало среднюю величину, выявленную у всех пациентов данной группы, то средний уровень этого белка достигал 54 мкг/мг общего белка, т.е. был на 40 % ниже, чем у пациентов 1 категории, p = 0,021 (табл. 4). Такая же закономерность отмечалась при снижении уровня мочевины в крови. В этом случае содержание α-спектрина в мембране эритроцитов падало на 43 % в сравнении с пациентами 1-й категории (p = 0,012). Еще более низкая величина данного белка определялась у пациентов 2-й категории при одновременном сочетании отмеченных условий (p1 = 0,013).
Установлено, что на процессы повышения АТБ может оказывать влияние избыточный уровень РФМК или ферритина (табл. 5). Так, превышение РФМК в пределах 9,5–19 мг/дл у пациентов 2-й категории сопровождалось увеличением уровня АТБ на 32 % относительно пациентов 1-й категории (p = 0,026), а повышение ферритина у пациентов категории в пределах 289–460 мкг/л – увеличением уровня АТБ на 28 % (p = 0,036). Тем не менее наибольший уровень АТБ достигался у пациентов 2-й категории при совокупном влиянии этих факторов (p = 0,004).
Таблица 3
Условия, способствующие изменению уровня β-спектрина у разных категорий пациентов с I-й степенью АГ
|
Категория пациентов |
Эндогенные условия отклонения уровня мембранного белка |
β-спектрин |
|
|
1 категория |
САД (140–141) |
ЛДГ (123–151) |
118,8 (90–146) |
|
β-спектрин |
101,9 (77,4–126) |
98,0 (76,5–119) |
|
|
2 категория |
САД (150–155) |
ЛДГ (172–193) |
53,3 (30–77) |
|
β-спектрин |
69 (50,1–87,8) |
65,5 (44,8–86,3) |
p1 = 0,006 |
|
p |
0,038 |
0,034 |
|
Примечание. Здесь и далее: p – значимость различных уровней белка между 2-мя категориями пациентов (по данным однофакторного анализа); p1 – значимость различных уровней белка между 2-я категориями пациентов (по данным двухфакторного анализа); LSD-критерий Фишера. В скобках даны доверительные интервалы.
Таблица 4
Условия, способствующие изменению уровня α-спектрина у разных категорий пациентов со II-й степенью АГ
|
Категория пациентов |
Эндогенные условия отклонения уровня мембранного белка |
α-спектрин |
|
|
1 категория |
ДАД (90–99) |
мочевина (5,7–6,6) |
123 (85–123) |
|
α-спектрин |
89,0 (65,3–112,6) |
83,8 (64,5–103) |
|
|
2 категория |
ДАД (100–107) |
мочевина (3,7–4,1) |
43,3 (20–66) |
|
α-спектрин |
54 (37,4–70,7) |
47,6 (28,6–66,8) |
p1 = 0,013 |
|
p |
0,021 |
0,012 |
|
Таблица 5
Условия, способствующие изменению уровня АТБ у разных категорий пациентов со II-й степенью АГ
|
Категория пациентов |
Эндогенные условия отклонения уровня мембранного белка |
АТБ |
|
|
1 категория |
РФМК (4,0–5,5) |
ферритин (96–137) |
64 (51–75) |
|
АТБ |
69,9 (59,1–80,6) |
70,1 (59,7–80,6) |
|
|
2 категория |
РФМК (9,5–19) |
ферритин (289–460) |
105 (86–125) |
|
АТБ |
92,2 (75,9–108,5) |
90 (75,9–108,5) |
p1 = 0,004 |
|
p |
0,026 |
0,036 |
|
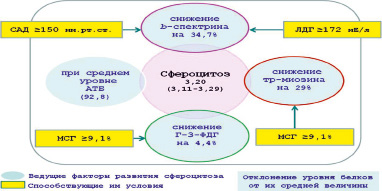
Рис. 1. Факторы и условия, индуцирующие развитие приобретённого сфероцитоза у пациентов с I-й степенью ЭАГ
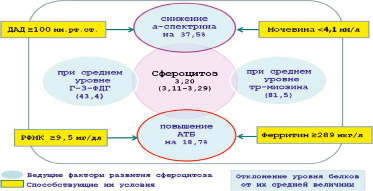
Рис. 2. Факторы и условия, индуцирующие развитие приобретённого сфероцитоза у пациентов со II-й степенью ЭАГ
На основании результатов регрессионного и дисперсионного анализов определены факторы и условия, индуцирующие развитие приобретенного сфероцитоза у пациентов с ЭАГ I-й (рис. 1) и II-й степени (рис. 2). При этом принимались во внимание отклонения отмеченных мембранных белков от их среднего уровня (ведущие факторы) и способствующие этому процессу условия.
Заключение
Таким образом, вся совокупность полученных данных позволила выявить основные факторы, индуцирующие структурно-функциональные нарушения белковых компонентов в мембране эритроцитов у исследуемых групп пациентов. Эти нарушения были обусловлены главным образом изменением уровня структурных (спектринов, белков полосы 4.1), транспортных (АТБ) и ферментативных (Г-3-ФДГ, Гл-S-Тр) белков, особенностью взаимосвязей белковых компонентов цитоплазматической мембраны, которые могли отражаться на деформабельных свойствах эритроцитов и, следовательно, на показателе сферичности этих клеток. Как показали исследования, этот параметр был тесно связан с отклонением β-спектрина, Г-3-ФДГ и тропомиозина у пациентов с I-й степенью АГ, α-спектрина и АТБ у пациентов со II-й степенью АГ, снижение уровня которых (наряду с повышением уровня АТБ) могло приводить к увеличению пула сфероцитарных клеток красной крови, ухудшая тем самым микроциркуляцию и газообмен в тканях. Исследование с помощью дисперсионного анализа у пациентов с разной степенью ЭАГ позволило выявить у них и разные условия, при которых наблюдались существенные сдвиги в уровне цитоскелетных белков, имеющих наибольшую сопряженность с отклонением ПСЭ.
Библиографическая ссылка
Пивоваров Ю.И., Кузнецова Э.Э., Горохова В.И., Дмитриева Л.А., Мухомедзянова С.В., Богданова О.В. СФЕРИЧНОСТЬ ЭРИТРОЦИТОВ И ГИПЕРТОНИЧЕСКАЯ БОЛЕЗНЬ // Международный журнал прикладных и фундаментальных исследований. 2018. № 5-1. С. 124-129;URL: https://applied-research.ru/ru/article/view?id=12229 (дата обращения: 02.02.2026).

