В настоящее время в мировой науке активно развиваются методы обнаружения позвоночных животных (в частности, рыб) в пробах воды с использованием ДНК окружающей среды (environmental DNA) [1]. ДНК окружающей среды (ДНКос) представляет собой ДНК, выделенную из образцов воды, почвы, воздуха и пр. Предполагается, что основным источником ДНКос животных служат продукты жизнедеятельности. Использование этого инструмента особенно актуально при мониторинге ареала обитания редких и исчезающих видов рыб и водных беспозвоночных. Кроме этого, потенциал применения данного метода заключается в повышении чувствительности обнаружения и эффективности оценок видового состава гидробионтов в полевых условиях в труднодоступных водоемах [2]. Таким образом, преимущество метода заключается также в том, что позволяет оперативно получать полную информацию о биоте водоема и необходимо при сжатых сроках выполнения полевых работ, ограничивающих тщательный облов рыб [3–5]. Метод активно развивается в трех направлениях: обнаружение находящихся под угрозой исчезновения видов, отслеживание инвазивных видов и оптимизация методов в полевых и лабораторных условиях [6–8].
Байкальский омуль Coregonus migratorius (Georgi, 1775) занимает одно из центральных звеньев пелагической трофической цепи Байкала и является основным объектом промысла. Актуальность более тщательного исследования состояния запасов этого вида в современный период определяется снижением его численности. В связи с этим использование методов мониторинга, не требующих проведения отлова рыб, становится приоритетным. Наряду с гидроакустическим методом, для оценки биомассы гидробионтов в настоящее время активно развивается метод количественного анализа ДНКос [9, 10 и др.]. Мы полагаем, что сочетание использования этих методов позволит существенно расширить наши знания о современном состоянии популяций рыб озера Байкал.
Цель исследования: апробация метода анализа ДНК окружающей среды для оценки запасов и мониторинга популяций байкальского омуля.
Материалы и методы исследования
Экспериментальные работы проводились с 26 по 30 марта 2018 г. на акватории озера Байкал, разрез пос. Листвянка – пос. Танхой с ледового покрова. Запись акустических сигналов и отбор проб ДНКос Байкала проводили синхронно на двух станциях: первая в районе м. Березовый, склоновая зона, над глубиной 400 м (51.831680N, 104.884533E); вторая – в открытом Байкале над глубиной 800 м (51.787013N, 104.942853E). В работе использовали гидроакустический комплекс, выполненный на базе эхолота Furuno FCV1100 (Япония) с гидроакустическими антеннами типа «один луч». Параметры эхолота в период проведения съемки: длительность зондирующего импульса 3 мс, частота зондирования 2 Гц. Низкочастотная антенна: диаграмма направленности по уровню – 3 дБ 24 ° частота 28 кГц, высокочастотная антенна – 12 °, частота 200 кГц. Калибровка эхолота проводилась по стандартной схеме с использованием калибровочных медных сфер [11].
Отбор проб и выделение ДНКос. Пробы воды (по 1 л каждая) на первой станции отбирались на горизонтах 25 и 250 м, на второй – 50, 300 и 400 м. Взятый объем воды фильтровали через стеклянный фильтр диаметром 47 мм и размером пор 0,7 мкм (Whatman, GE Healthcare Life Sciences). Выделение ДНКос из фильтров проводилось методом, предложенным ранее [12].
Полимеразная цепная реакция. Для проведения анализа использовали фрагмент гена NADH4 митохондриальной ДНК. Праймеры 10219CpelMtF 5’-ctatccctctgggcacttcaaat и 10341CpelMtR 5’-taacattggagaaggttgaggct инициировали синтез ампликона 167 нуклеотидов. Количественную ПЦР (qPCR) проводили в 10 мкл реакционной смеси, содержащей 0,5U AmpliTaq Gold DNA Polymerase (Applied Biosystems), 1 x ПЦР буфер, 2 mM MgCl2, 0,2 mM каждого dNTP, 0,2 uM R и F праймеры, 0,25 x EvaGreen и 0,5–20 нг ДНК. Амплификацию проводили на LightCycler® 96 (Roche Life Science). Режим амплификации: удержание – 95 °C (10 мин); циклирование – 95 °C (10 сек), 62 °C (15 сек), 72 °C (10 сек, детекция флуоресценции), 50 циклов; плавление – 62–95 °C. Для проведения количественных оценок использовали 10-кратные разведения ДНК байкальского омуля. Максимальное разведение, при котором не было ампликона, принимали за 1 молекулу целевого фрагмента. Нуклеотидные последовательности полученных фрагментов ДНК определяли прямым секвенированием с помощью набора BigDye Terminator v3.1 Cycle Sequencing Kit на генетическом анализаторе 3500 Genetic Analyzer (Thermo Fisher Scientific). Контроль качества продукта амплификации осуществляли с помощью техники плавления с высоким разрешением (HRM).
Результаты исследования и их обсуждение
В работе представлены эхограммы, иллюстрирующие вечернее распределение байкальского омуля в подледный период (рис. 1 и 2). Ранее специальные исследования распределения байкальского омуля с применением гидроакустической техники с ледового покрова озера не проводились. На первой станции зарегистрированы скопления рыб в диапазоне глубин 50–100 м в склоновой зоне и единичные экземпляры на глубинах до 300 м (рис. 1). На второй станции, расположенной в открытом Байкале, были отмечены единичные особи байкальского омуля в диапазоне глубин 50–300 м (рис. 2).
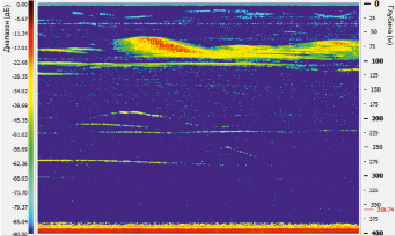
Рис. 1. Скопления байкальского омуля в диапазоне глубин 50–100 м, на первой станции 26 марта 2018 г. Эхограмма построена по данным низкочастотного канала (28 кГц)

Рис. 2. Разреженное скопление байкальского омуля в диапазоне глубин 50–300 м, на второй станции 28 марта 2018 г. Эхограмма построена по данным низкочастотного канала (28 кГц)
По данным гидроакустических съемок, проводимых после распаления льда, в период зимней температурной стратификации вод, также было отмечено наличие скоплений и более высоких концентраций рыб в присклоновой зоне и над возвышениями дна, в том числе на подводных
банках [13].
Для зимне-весеннего распределения характерна концентрация байкальского омуля в присклоновой зоне на глубине 100–350 м, его рассредоточение в нижних горизонтах эпипелагиали и практическое отсутствие в верхнем 50 м слое как у берега, так и в открытых районах. Наличие плотных скоплений, свидетельствующих о реализации стайного поведения рыб в открытых водах, также было зафиксировано преимущественно на глубинах 50–100 м. В период весеннего прогрева прибрежных и поверхностных вод Байкала по данным гидроакустических съемок было отмечено наличие двуслойного распределения омуля в толще вод озера – в слоях 50–150 и 160–350 м, обусловленное морфо-экологической внутривидовой дифференциацией рыб [13].
Как показали результаты секвенирования с праймерами 10219CpelMtF и 10341CpelMtR, используемый фрагмент ДНК гомологичен фрагменту NADH4 байкальского омуля. Плавление с высоким разрешением показало, что среди проанализированных образцов присутствуют как мономорфные, так и полиморфные пробы ДНКос (рис. 3). Определение нуклеотидных последовательностей показало, что полиморфные пробы представлены фрагментами с 1–3 вариабельными сайтами (G/C или A/T).
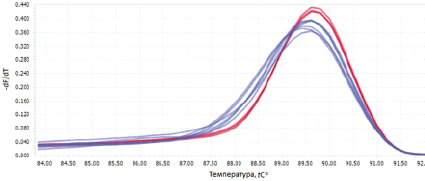
Рис. 3. Результаты плавления с высоким разрешением. Красным и синим цветом обозначены мономорфные и полиморфные пробы соответственно
Генетический полиморфизм байкальского омуля определяется количеством речных систем, в которых он размножается, а также дифференциацией особей по протяженности нерестовых миграций. Ранее анализ репродуктивной разобщенности, морфологической и биологической разнокачественности популяций байкальского омуля позволил объединить их в морфоэкологические группы (МЭГ): 1) пелагическая (многотычинковая), 2) прибрежно-пелагическая (среднетычинковая) и 3) придонно-глубоководная (малотычинковая) [14]. В зимне-весенний период (май – июнь) омуль всех МЭГ в местах основных скоплений обитает в придонных слоях воды. Однако часть его рассредоточена в открытых водах, в том числе над максимальными глубинами. Наличие среди проанализированных образцов как мономорфных, так и полиморфных проб ДНКос, возможно, подтверждает совместное обитание байкальского омуля разных МЭГ в зимний период. Результаты количественного анализа показали, что основная масса ДНКос омуля сосредоточена в склоновой зоне (рис. 4). При этом на глубинах выше 25 м концентрация ДНКос почти в два раза выше, чем на 250 м, что возможно в случае прохождения стаи рыб, либо апвеллинга генетического материала с потоком пузырьков газа, выделяемого омулем. В открытом Байкале, напротив – градиент концентрации соответствует зимнему батиметрическому распределению омуля: максимальное количество ДНКос сосредоточено на глубине 300 м в зоне стабильной регистрации рыб. На глубинах 50 м и менее омуль не был зарегистрирован, а на глубинах свыше 350 м встречался крайне редко. Наличие ДНКос на данных глубинах может быть обусловлено вертикальным переносом водных масс, диффузным переносом и седиментацией органических взвесей.
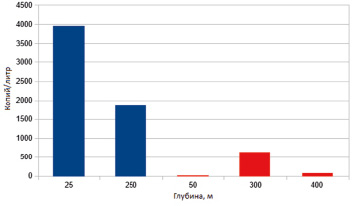
Рис. 4. Количество копий ДНКос байкальского омуля в пробах (копий ДНК целевого фрагмента на литр). Синим цветом обозначена присклоновая зона над глубиной 400 м, красным – зона открытого Байкала над глубиной 800 м
Проблемой определения численности байкальского омуля является мозаичность распределения и динамичность скоплений в рыбопромысловых районах, где сосредоточены основные запасы. По результатам проведенных в 2000–2003 гг. гидроакустических съемок межгодовые колебания численности омуля на обследованных акваториях составляли от 183 до 448 экз/га, биомассы – 26–99 кг/га или в пересчете на всю обследованную акваторию – 2,9–13,3 тыс. т [15]. Колебания оценок численности в четыре раза могут объясняться методическими просчетами при планировании учетных работ. Байкальский омуль – активно мигрирующий вид со сложной внутривидовой структурой. Сезонное распределение и миграции различных МЭГ имеют свои особенности, которые тем не менее не являются строго специфичными. В скоплениях и рассредоточенной части популяции встречаются особи разных МЭГ. По данным гидроакустических съемок было установлено, что байкальский омуль присутствует повсеместно в зоне эпи- и мезопелагиали до глубин 350–400 м по всей акватории озера, включая центральные глубоководные части всех трех котловин. В зимне-весенний период байкальский омуль пространственно обособлен и практически не пересекается с другими видами пузырных рыб, обитающими в прибрежной зоне, преимущественно до изобаты 50 м. Эти специфичные особенности экологии делают его уникальным объектом для решения методических вопросов применения гидроакустики и анализа ДНКос с целью разработки методов мониторинга и оценки запасов рыб. Оба подхода дополняют друг друга и позволяют проводить корректировку в случае исследования активно мигрирующих видов.
Заключение
Апробация метода анализа ДНК окружающей среды для оценки запасов и мониторинга популяций байкальского омуля показала, что выявленные при помощи гидроакустического метода особенности его распределения позволяют использовать этот вид в качестве модельного для разработки методов анализа ДНКос. Оба подхода дополняют друг друга и позволяют проводить корректировку в случае исследования активно мигрирующих видов. Разработка методов анализа ДНКос может служить основой исследования генетического полиморфизма рыб в скоплениях различного типа, а также в связи с их батиметрическим и пространственно-географическим распределением. В современный период использование методов мониторинга, не требующих проведения контрольных отловов, является приоритетным в связи со снижением численности байкальского омуля.
Работа выполнена в рамках темы 0345-2016-0002 (АААА-А16-116122110066-1) «Молекулярная экология и эволюция живых систем Центральной Азии в условиях глобальных экологических изменений».
Библиографическая ссылка
Кирильчик С.В., Макаров М.М., Аношко П.Н., Астахова М.С., Смолин И.Н., Дзюба Е.В. АПРОБАЦИЯ МЕТОДА КОЛИЧЕСТВЕННОГО АНАЛИЗА ДНК ОКРУЖАЮЩЕЙ СРЕДЫ ДЛЯ ОЦЕНКИ ЗАПАСОВ И МОНИТОРИНГА ПОПУЛЯЦИЙ БАЙКАЛЬСКОГО ОМУЛЯ // Международный журнал прикладных и фундаментальных исследований. 2018. № 6. С. 98-102;URL: https://applied-research.ru/ru/article/view?id=12300 (дата обращения: 15.02.2026).
DOI: https://doi.org/10.17513/mjpfi.12300

