Ведутся активные исследования регуляторных пептидов класса глипролинов, в том числе и их синтетических аналогов, каковым является и пептид селанк, в качестве лекарственных препаратов для коррекции нарушений углеводного и липидного обменов [1]. Клинически данные нарушения проявляются развитием ожирения и сахарного диабета, которые в совокупности означают развитие метаболического синдрома [2]. В последние десятилетия наблюдается острый подъем частоты встречаемости данного недуга, что связывают со снижением физической активности и пищевыми привычками. Ожирение – хроническое нарушение обмена веществ, патогенез которого до конца не изучен [3]. Жировая ткань рассматривается как самостоятельный секреторный орган, обладающий ауто-, пара- и эндокринной функциями [4].
Селанк является аналогом эндогенного пептида тафтцина – периферического регулятора иммунитета, способного оказывать и некоторые центральные эффекты. Он представляет собой гептапептид, С-конца к которому добавлена группировка Pro-Gly-Pro, защищающая его от быстрой деградации под действием протеолитических ферментов. В клинике селанк применяют в качестве анксиолитика, без побочных эффектов, свойственных препаратам данной группы (седативных, снотворных, миорелаксантных) [5].
Для получения доказательств безопасности, качества и эффективности лекарственного средства исследование препарата на здоровых животных является крайне необходимой частью эксперимента. Ранее было показано, что при введении селанка здоровым животным в плазме крови наблюдался одновременный антитромбоцитарный, антикоагулянтный и фибриндеполимеризационный эффект [6]. Также показана эффективность данного пептида при лечении пациентов с расстройствами пищевого поведения [7].
Цель исследования: изучить влияние пептида селанка на массу тела, показатели липидного профиля и концентрацию глюкозы в крови белых крыс линии Вистар.
Материалы и методы исследования
В исследовании использовался коммерческий препарат селанк (Thr-Lys-Pro-Arg-Pro-Gly-Pro), изготовленный в НИИ фармакологии им. В.В. Закусова и Институте молекулярной генетики РАН. Эксперимент был проведен на 28 лабораторных белых крысах-самцах линии Вистар с массой тела 340–364 г (в соответствии с методическими рекомендациями по доклиническому изучению лекарственных средств), которые содержались на естественном лабораторном рационе в стандартных условиях вивария. Работа с животными была проведена в соответствии с этическими принципами, установленными Европейской конвенцией по защите позвоночных животных (Страсбург, 15.06.2006 г). Животные были разделены на 2 группы (по 14 крыс в каждой группе). Опытным крысам вводили пептид интраназально, чтобы он не вступал в контакт с кислой средой желудка, не подвергался действию пищеварительных ферментов и мог непосредственно поступать в кровоток, оказывая максимальное действие (группа Опыт). Селанк вводили по 20 мкл/животное в дозе 75 мкг/кг массы тела 1 раз в сут в дневное время в течение 10 дней
(с 1-го по 10-й день эксперимента включительно). Контрольные животные получали в эти же сроки и подобным образом вместо пептида 0,85 %-ный раствор NaCl (группа Контроль).
Отбор образцов крови для исследований осуществляли натощак из v.jugularis через 20 ч после последнего введения селанка (11-й день) и через 7 сут после отмены его применения (18-й день эксперимента). В качестве консерванта использовали 3.8 %-ный раствор цитрата натрия в соотношении кровь:консервант как 9:1. Образцы крови центрифугировали при 3000 g в течение 10 мин для получения бедной тромбоцитами плазмы.
Показатели жирового обмена в плазме крови исследовали энзиматическим колориметрическим методом с использованием набора реагентов фирмы Ольвекс-Диагностикум (Россия). При этом определяли концентрацию общего холестерина (ОХ), холестерина липопротеидов высокой плотности (Хс-ЛПВС) и липопротеидов низкой плотности (Хс-ЛПНП), триглицеридов в соответствии с инструкцией к наборам. Концентрацию глюкозы в крови определяли на биохимическом анализаторе One Touch Horison (США), используя специальные тест-полоски для данного прибора.
Измерение массы тела животных производилось при помощи весов ВТ-500 в одно и то же время суток (в 9 ч утра) три раза: перед первым введением пептида (1-й день), через 20 ч после 10-го введения селанка перед первым взятием крови (11-й день) и через 1 нед после прекращения введения препаратов перед вторым взятием крови (18-й день).
Статистическую обработку данных проводили при помощи пакета прикладных программ Microsoft Office Excel 2010 и Statistica 7. После проверки количественных данных на нормальность распределения с помощью критерия Шапиро – Уилка, сравнительный анализ результатов осуществляли методом вариационной статистики для независимых выборок с вычислением t-критерия Стьюдента. Полученные данные представлены в виде М ± m, где М – среднее арифметическое значение, m – стандартная ошибка среднего. Различия считали достоверными при уровне статистической значимости p < 0,05.
Результаты исследования и их обсуждение
Как показали наши эксперименты, у крыс контрольной группы с 1 по 18 день эксперимента происходило равномерное увеличение массы тела (рис. 1). Так, средняя масса тела с 1-го по 11-й день наблюдения увеличилась с 352,0 ± 12,4 г до 361,0 ± 9,6 г, а к 18-м суткам достигла 373,0 ± 12,3 г. Таким образом, прирост массы тела в этой группе с 1-го по 11-й день составил 9 г,
с 11-го по 18-й день – 12 г, а суммарный привес (с 1-го по 18-й день) – 21 г.
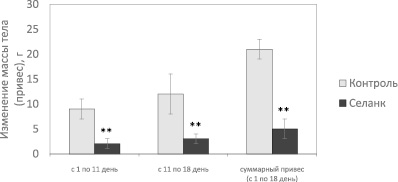
Изменение массы тела крыс в процессе проведения эксперимента. ** – p < 0,01 по сравнению с контролем
У крыс группы Опыт, которым интраназально вводили селанк, выявлено замедление роста массы тела: с 1-го по 11-й день средняя масса тела животных возросла с 353,0 ± 11,5 г (исходный уровень) до 355,0 ± 12,1 г, а прирост массы тела составил 2 г, что в 4.5 раза меньше по сравнению с контролем. После отмены применения пептида увеличение массы тела животных группы Опыт происходило более медленными темпами, чем у контрольных животных: через 1 неделю после прекращения введения селанка (на 18-й день эксперимента) масса тела крыс группы Опыт увеличилась до 358,0 ± 9,6 г, т.е. прирост массы тела с 11-го по 18-й день составил всего 3 г, а суммарный привес за все время проведения эксперимента – 5 г, что в 4 и 4,2 раза меньше, чем в контроле, соответственно.
Известно, что центры, регулирующие потребление пищи и энергетический баланс, находятся в гипоталамусе: одни гормоны и нейромедиаторы увеличивают потребление пищи, а другие – снижают. Нарушение синтеза, метаболизма и секреции нейротрансмиттеров может приводить к гормональным сдвигам, что имеет значение для развития ожирения и специфичности отложения жира [8, 9]. Селанк проявляет тропность к серотонинергической системе [10].
Было показано, что интраназальное введение 0,15 %-ного препарата Селанк в течение 14 дней пациентам с ожирением, страдающих расстройствами пищевого поведения, приводило к уменьшению эпизодов переедания вследствие более быстрого наступления эффекта насыщения и, таким образом, к снижению веса [7].
В наших экспериментах интраназальное введение синтетического пептида селанка крысам линии Вистар не выявило влияния на инсулярную систему: уровень глюкозы в крови крыс группы Опыт в течение всего срока наблюдений не изменялся и соответствовал значениям группы Контроль (таблица). В исследованиях Мясоедова с соавторами (2014) было установлено, что у животных с экспериментальным метаболическим синдромом 10-кратное интраназальное введение селанка в той же дозе не приводило к снижению концентрации глюкозы. Однако увеличение показателя было недостоверным по сравнению со значениями у здоровых крыс, которым не вводили пептид.
Изменение показателей липидного профиля и концентрации глюкозы в плазме крови здоровых крыс через 20 ч после 10-кратного интраназального введения селанка и через 1 нед после его отмены (М ± m)
|
Через 20 ч после 10-го введения селанка или NaCl |
Через 1 нед после отмены введения селанка или NaCl |
|||
|
селанк |
контроль |
селанк |
контроль |
|
|
ОХ, ммоль/л ( %) |
1,307 ± 0,054 (107) |
1,222 ± 0,115 (100) |
1,630 ± 0,106* (82) |
1,985 ± 0,042 (100) |
|
Хс-ЛПВП, ммоль/л ( %) |
1,117 ± 0,062* (119) |
0,939 ± 0,093 (100) |
1,069 ± 0,077* (72) |
1,482 ± 0,032 (100) |
|
Хс-ЛПНП, ммоль/л ( %) |
0,184 ± 0,026* (65) |
0,283 ± 0,022 (100) |
0,562 ± 0,044 (112) |
0,503 ± 0,034 (100) |
|
ТГ, ммоль/л ( %) |
0,394 ± 0,025** (79) |
0,501 ± 0,099 (100) |
0,527 ± 0,039** (69) |
0,767 ± 0,043 (100) |
|
Глюкоза, |
4,580 ± 0,950 (98) |
4,700 ± 0,032 (100) |
4,150 ± 0,710 (96) |
4,410 ± 0,122 (100) |
Примечание. ОХ – общий холестерин, Хс-ЛПВП – холестерин липопротеидов высокой плотности, Хс-ЛПНП – холестерин липопротеидов низкой плотности, ТГ – триглицериды. Статистические показатели рассчитаны относительно соответствующих проб контроля, принятых за 100 %. * – р < 0,05, ** – р < 0,01.
Селанк обладает анксиолитическим действием со стимулирующим компонентом, а в условиях эмоционального напряжения улучшает деятельность вегетативной системы, а также оказывает положительное влияние на адекватность адаптивного поведения. Известно, что при интраназальном введении он способен связываться со специфическими рецепторами на мембранах нервных клеток и оказывать влияние на обмен моноаминов в эмоциогенных структурах мозга и активность мозговых ферментов [11]. Возможно, наблюдаемый нами в эксперименте неизменный уровень глюкозы и связан с тем, что она является основным энергетическим субстратом для оптимальной работы мозга и ее содержание должно быть стабильным.
Следовательно, пептид Thr-Lys-Pro-Arg-Pro-Gly-Pro, применяемый многократно интраназально в дозе 75 мкг/кг, замедлял рост массы тела у здоровых животных, не затрагивая звенья углеводного обмена.
После 10-кратного интраназального введения селанка при неизменном уровне ОХ в обеих группах, в опыте наблюдалось достоверное снижение ТГ на 19 % и Хс-ЛПНП на 35 % по сравнению с контролем, а также увеличение уровня Хс-ЛПВП на 19 % (таблица).
Через 7 суток после отмены введения пептида в плазме крови опытных животных концентрация ОХ составила 82 % по сравнению с контролем. При этом в этой группе обнаружено достоверное уменьшение концентрации Хс-ЛПВП на 28 % и ТГ на 31 % относительно контрольных значений. Уровень Хс-ЛПНП в плазме практически соответствовал показателям у контрольных животных (таблица).
Показано, что исследуемый пептид восстанавливал нормальные значения показателей липидного профиля у крыс с метаболическим синдромом (животные постоянно употребляли высококалорийную пищу с избытком насыщенных жирных кислот и глюкозы), причем эффекты были значимыми и сохранялись даже после прекращения введения селанка в течение 2-х недель [12].
В механизме нарушения липидного обмена у больных ожирением помимо балансовых отклонений имеет значение расстройство нервной и эндокринной регуляции [13], сопровождающееся изменением соотношения жиромобилизующих и жиросжигающих гормонов и степени активности тканевых липаз. Процесс пищеварения активирует секрецию инсулина, который стимулирует использование метаболитов для запасания энергоносителей. В жировой ткани он индуцирует синтез липопротеидлипазы, что обеспечивает транспорт жирных кислот, глицерина в адипоциты, убирая субстрат для формирования атерогенных липопротеидов [8]. Адипоциты вырабатывают пептидный гормон лептин, дефицит которого в крови служит сигналом недостаточного запаса ТГ в организме, что приводит к увеличению аппетита и, в результате синтеза ТГ, повышению массы тела. Лептин является ключевым медиатором между жировой тканью и гипоталамо-гипофизарной системой [2, 14]. Возможно, селанк способен восстанавливать секрецию нейропептидов, регулирующих пищевое поведение и расход энергии, при нарушении восприятия лептиновых сигналов.
Итак, после применения синтетического пептида селанка наблюдалось пролонгированное (в течение 2-х недель) снижение концентрации триглицеридов, а уменьшение содержания в плазме крови общего холестерина отмечалось через 7 дней после отмены введения данного препарата (отставленный эффект).
Заключение
Таким образом, полученные данные указывают на способность селанка при 10-кратном интраназальном введении в дозе 75 мг/кг влиять на параметры жирового обмена у животных без патологий, а именно, снижать в крови общий холестерин, атерогенные липопротеиды низкой плотности, а также триглицериды. Впервые нами была показана способность данного пептида замедлять рост массы тела и блокировать накопление жировых отложений в организме здоровых животных. Следовательно, просматривается перспективность изучения пептида селанка в качестве препарата, предупреждающего развитие ожирения.
Библиографическая ссылка
Шубина Т.А., Оберган Т.Ю. ВЛИЯНИЕ ПЕПТИДА СЕЛАНК НА МАССУ ТЕЛА, ПОКАЗАТЕЛИ ЛИПИДНОГО ПРОФИЛЯ И УРОВЕНЬ ГЛЮКОЗЫ КРОВИ КРЫС ЛИНИИ ВИСТАР // Международный журнал прикладных и фундаментальных исследований. 2018. № 6. С. 130-134;URL: https://applied-research.ru/ru/article/view?id=12305 (дата обращения: 26.02.2026).

