В тканях живого организма непрерывно протекают процессы перекисного окисления липидов (ПОЛ), интенсивность которых регулируется системой антиоксидантной защиты (АОЗ), состоящей из множества компонентов, способных предотвращать возможные повреждения структур клетки [1]. Соотношение между активностью свободнорадикальных процессов и компонентов системы АОЗ определяет не только интенсивность метаболизма, но и адаптационные возможности организма, а также в случае дисбаланса в работе системы «ПОЛ-АОЗ» в сторону интенсификации процессов липопероксидации, риск формирования окислительного стресса [2, 3]. В настоящее время показано, что такой физиологический процесс, как старение, сопровождается развитием окислительного стресса, что связано с нарушением регуляторного механизма, осуществляющего контроль над клеточным уровнем свободных радикалов. Однако причина дисрегуляции окислительно-восстановительного баланса до настоящего время не ясна [1]. К настоящему времени проведено достаточно много исследований, касающихся оценки состояния системы АОЗ у женщин менопаузального возраста, однако их результаты не только неоднозначны, но и противоречивы [4–6]. Актуальность таких исследований определяется необходимостью разработки профилактических и лечебных мероприятий по коррекции метаболических нарушений у женщин данной возрастной группы. Таким образом, целью данного исследования явилась сравнительная оценка общего антиоксидантного статуса и содержания некоторых компонентов неферментативного звена системы АОЗ у женщин в разных фазах климактерического периода.
Материалы и методы исследования
В исследовании в качестве добровольцев приняли участие 45 женщин, территорией проживания которых был г. Иркутск. Каждой женщиной было подписано информированное согласие на участие в проводимом исследовании, протокол которого был одобрен Комитетом по биомедицинской этике ФГБНУ НЦ ПЗСРЧ.
Результаты клинико-анамнестического обследования позволили разделить обследуемых на две группы:
– перименопаузальный период (n = 19). Среднее значение возраста в данной группе составило 49,08 ± 2,84 лет, ИМТ – 27,18 ± 4,58 кг/м2;
– постменопаузальный период (n = 26). Среднее значение возраста в данной группе составило 57,16 ± 1,12 лет, ИМТ – 27,96 ± 3,57 кг/м2.
В качестве критерий исключения при проведении исследования были использованы обострение хронических заболеваний, ожирение, заболевания эндокринного генеза, применение заместительной гормональной терапии, преждевременная ранняя менопауза, хирургическая менопауза.
При анализе медицинской документации у женщин обследуемых групп были выявлены некоторые соматические заболевания (рис. 1).
Выраженность климактерического синдрома определялась количественной оценкой с использованием модифицированного менопаузального индекса Купперман – Уваровой (1983). Полученные результаты представлены на рис. 2.
Параметры системы АОЗ (ретинол, альфа-токоферол, общую антиокислительную активность (АОА)) определяли в сыворотке крови, забор которой осуществляли рано утром, натощак, из локтевой вены. Гемолизат, приготовленный из эритроцитов, служил материалом для определения восстановленного и окисленного глутатионов (GSH и GSSG). Содержание ретинола и альфа-токоферола определяли методом Р.Ч. Черняускене с соавт. (1984); GSH и GSSG – методом P.J. Hisin и R. Hilf (1976); общую АОА сыворотки крови – методом Г.И. Клебанова с соавт. (1988). Концентрацию ретинола и альфа-токоферола выражали в мкмоль/л, GSH и GSSG – в ммоль/л, уровень общей АОА сыворотки крови – в усл. ед. Измерительными приборами служили спектрофотометр «Shimadzu RF-1650» (Япония) и спектрофлюорофотометр «Shimadzu RF-1501» (Япония).
Концентрация мелатонина определялась иммуноферментным методом в нестимулированной слюне. Временными точками для сбора биологического материала с использованием специальных пробирок (SaliCaps, IBL) были 6.00–7.00 ч, 12.00–13.00 ч, 18.00–19.00 ч, 23.00–00.00 ч. Слюна немедленно замораживалась и хранилась при температуре –20 °С. Забор слюнной жидкости производился в зимнее время года (январь-февраль). Измерительным прибором для определения концентрации гормона в пг/мл с использованием коммерческих наборов Buhlmann (Швейцария) служил анализатор «Микропланшетный ридер EL×808» (США).
Статистическая обработка данных была проведена с использованием программы «Statistica 6.1». Оценка на нормальность распределения количественных признаков показала неправильное распределение, вследствие чего для анализа различий между группами были применены непараметрические критерии, а именно Mann – Whitney Test; Kolmogorov – Smirnov Two-Sample Test; Wald – Wolfowitz Runs Test. Оценка различий количественных показателей внутри изучаемых групп была проведена с использованием W-критерия Вилкоксона. Анализ взаимосвязей количественных признаков внутри групп был проведен с использование корреляционного анализа Спирмана с определением коэффициента корреляции (r).
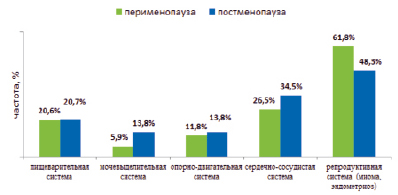
Рис. 1. Структура выявленных заболеваний у женщин в пери- и постменопаузе
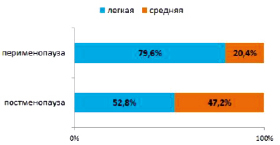
Рис. 2. Сравнительная оценка тяжести климактерического синдрома между обследуемыми группами
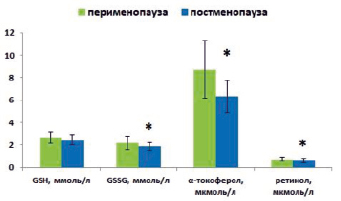
Рис. 3. Параметры неферментативного звена системы АОЗ у женщин в разных фазах климактерического периода. Примечание: * – статистически значимые межгрупповые различия
Результаты исследования и их обсуждение
Результаты проведенного исследования свидетельствуют о более низком содержании α-токоферола (в 1,37 раза (р < 0,05)), ретинола (в 1,14 раза (р < 0,05)) и GSSG (в 1,16 раза (р < 0,05)) в группе женщин постменопаузального периода по сравнению с перименопаузой (рис. 3). Уровень общей АОА сыворотки крови не отличался между фазами климактерия и составил 15,89 ± 7,99 усл. ед. в перименопаузе и 14,29 ± 5,98 усл. ед. в постменопаузе.
Полученные данные, демонстрирующие более низкое содержание α-токоферола и ретинола в постменопаузе согласуются с рядом исследований [4, 5]. Вероятнее всего, это связано с их расходом на инактивацию продуктов ПОЛ, интенсивность которого нарастает с возрастом [7]. Вследствие недостатка в организме α-токоферола происходит дестабилизация клеточных мембран, снижается их текучесть и продолжительность жизни эритроцитов. Дефицит в мембранах клеток витамина Е приводит к распаду ненасыщенных жирных кислот, а также к уменьшению их белкового состава [1]. Влияние α-токоферола на репродуктивную систему несомненно вследствие его участия в стимуляции стероидогенеза в яичниках, а также биосинтеза белка в эндометрии и других органах-мишенях стероидных гормонов. Таким образом, недостаточный уровень данного антиоксиданта в организме способствует нарушению и угасанию репродуктивной функции [8, 9].
Функциональные взаимосвязи между параметрами системы АОЗ в исследуемых группах
|
Корреляционная связь |
Перименопауза |
Постменопауза |
|
α-токоферол – ретинол |
0,47 |
0,58 |
|
α-токоферол – GSH |
0,38 |
|
|
Ретинол – GSH |
0,52 |
|
|
GSH – мелатонин 12.00–13.00 |
0,48 |
|
|
GSSG – мелатонин 06.00–07.00 |
0,40 |
|
|
Общая АОА – GSSG |
–0,36 |
|
|
Ретинол – мелатонин 23.00–00.00 |
–0,34 |
Другим жирорастворимым, не менее эффективным антиоксидантом является ретинол. С одной стороны, он взаимодействует со свободными радикалами различных видов, с другой стороны – обеспечивает стационарный уровень α-токоферола посредством усиления его антиоксидантного действия [10]. Это подтверждают и выявленные в данном исследовании функциональные взаимосвязи между данными антиоксидантами (таблица).
Еще одной функцией ретинола является способность совместно с аскорбатом участвовать в ингибировании включения селена в состав глутатионпероксидазы. Фермент разлагает гидроперекиси, тем самым препятствуя их вовлечению в окислительный цикл и, наряду с токоферолом, практически полностью подавляет чрезмерную активацию свободнорадикальных процессов в биологических мембранах [11]. Взаимосвязь α-токоферола и ретинола с глутатионовой системой подтверждается их корреляциями с GSH у женщин в перименопаузе.
К настоящему времени показано, что старение ассоциировано с прогрессирующим окислением глутатиона и других тиоловых соединений, следствием чего является снижение уровня GSH и, соответственно, соотношения GSH/GSSG [6]. В данном исследовании не выявлено изменений в уровне GSH у женщин постменопаузального возраста, однако содержание GSSG у них увеличено. Данный факт может быть следствием изменения в работе энзимного звена глутатионовой системы – повышения активности глутатионпероксидазы, либо снижения активности глутатионредуктазы [12].
Одним из представительных антиоксидантов является гормон мелатонин, обладающий более выраженными антиоксидантными свойствами, чем у витамина Е и глутатиона, и его антиоксидантный эффект реализуется как путем прямого действия на свободные радикалы, так и через активацию ферментативного звена системы АОЗ, катализируя работу каталазы, супероксиддисмутазы, глутатионредуктазы, глутатионпероксидазы и глюкозо-6-фосфатдегидрогеназы [1]. Подтверждением этого являются и выявленные корреляционные взаимосвязи между мелатонином и глутатионом у женщин в перименопаузе.
Результаты исследования циркадных ритмов секреции мелатонина у женщин в разных фазах климактерического периода представлены на рис. 4. Полученные данные подтверждают хронобиологические аспекты секреции мелатонина, продемонстрированные в многочисленных исследованиях, согласно которым у здоровых людей уровень гормона начинает повышаться в вечернее время, достигая максимума в ночное время суток [13]. Достоверно значимые различия между ранними утренними часами и дневными, а также вечерними и ночными часами выявлены в обеих исследуемых группах. Более того, у женщин в перименопаузе обнаружен более высокий уровень мелатонина в ночное время по сравнению с ранними утренними часами (10,84 ± 7,33 пг/мл против 5,93 ± 4,51 пг/мл соответственно (p < 0,05)).
При оценке циркадной ритмики секреции мелатонина в зависимости от фазы климактерия выявлено, что у женщин в постменопаузальном периоде уровень гормона в дневные, вечерние и ночные часы значимо снижен по сравнению с группой женщин в перименопаузе (в 1,94 раза (р < 0,05), в 3,22 раза (р < 0,05) и в 1,54 раза (р < 0,05) соответственно), что согласуется с результатами проведенных ранее исследований, где показано возрастзависимое уменьшение уровня мелатонина. Учитывая функциональные изменения в эпифизе при старении, полученные результаты подтверждают данные о возрастном снижении основной функции шишковидной железы [14].
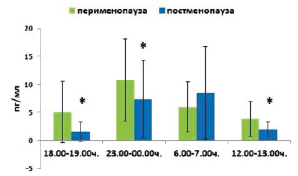
Рис. 4. Циркадная ритмика секреции мелатонина у женщин в разных фазах климактерического периода. Примечание. * – статистически значимые межгрупповые различия
Принимая во внимание отсутствие достоверно значимых различий по структуре соматической патологии между исследуемыми группами, результаты настоящего исследования согласуются с одним из заключений научной литературы, постулирующем следующее: в органах и тканях без возрастной патологии при старении происходит снижение активности энзимных и неэнзимных компонентов системы АОЗ, что может отражать возрастное уменьшение интенсивности окислительного метаболизма. В случае наличия какого-либо заболевания отмечается повышение активности антиоксидантов, свидетельствуя об интенсификации свободнорадикальных процессов, либо отсутствие каких-либо изменений в соответствующих органах и тканях [15].
Заключение
Полученные в ходе данного исследования результаты свидетельствуют о снижении ресурсов неферментативного звена системы АОЗ, таких как α-токоферол, ретинол, мелатонин, у женщин по мере прогрессирования климактерического периода, что может являться показанием к назначению антиоксидантной терапии у данной когорты населения в целях профилактики и коррекции окислительного стресса.
Исследование выполнено благодаря финансовой поддержке Совета по грантам Президента РФ (МК–3615.2017.4).
Библиографическая ссылка
Семёнова Н.В., Мадаева И.М., Шолохов Л.Ф., Колесникова Л.И. ОБЩИЙ АНТИОКСИДАНТНЫЙ СТАТУС И НЕФЕРМЕНТАТИВНОЕ ЗВЕНО СИСТЕМЫ АНТИОКСИДАНТНОЙ ЗАЩИТЫ У ЖЕНЩИН В МЕНОПАУЗЕ // Международный журнал прикладных и фундаментальных исследований. 2018. № 8. С. 90-94;URL: https://applied-research.ru/ru/article/view?id=12371 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12371

