На сегодняшний день сложилась серьезная экологическая ситуация в Южном регионе Казахстана, которые характеризуются наличием целого комплекса экстремальных факторов с усиленным развитием процессов засоления [1, 2]. В результате антропогенных нагрузок на экосистему наблюдается падение уровня моря и осолонение вод, что приводит к высокому росту температурных колебаний и сдвигу фаз температурного режима в толще воды. При этом снижается поступление биогенных элементов в море, низкое содержание биогенных элементов вызывает ограничения развития фотосинтетических процессов и низкую биологическую продуктивность в море [3]. Ухудшается кислородный режим моря за счет уменьшения его фотосинтетического продуцирования и интенсивного потребления на окисление органического вещества, что приводит к формированию зон дефицита кислорода [4, 5].
Повышение солености вод делает невозможным существование аборигенной микрофлоры, что вызывает изменения в количественно-качественном составе фито- и зоопланктона, фито- и зообентоса [6]. Адаптированные к существованию в крайне экстремальных условиях среды, галофильные микроорганизмы быстро приспосабливаются к изменениям солености среды. Данная группа микроорганизмов в природе практически не имеет ни конкурентов, ни антагонистов, поскольку ни одна из других жизненных форм не способна к существованию в условиях высокой концентрации солей [7–9].
Цель исследования: изучение микрофлоры солесодержащего сырья Южного региона Казахстана.
Материалы и методы исследования
Объектами исследования были образцы проб солесодержащего сырья Джаксы-Клычского месторождения (ДКМ) озерных солей и месторождения Бугажайлы (БМ) Сузакского района Туркестанской области (табл. 1). В качестве солесодержащего сырья использовали следующие образцы соли, рапы и ила, отобранные с глубины 0–10 см, 0–20 см, 0–30 см.
Таблица 1
Образцы проб солесодержащего сырья
|
№ образца |
Место отбора пробы |
|
Джаксы-Клычского месторождения |
|
|
№ 1 ДКМ |
Южный бассейн, 1,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 2 ДКМ |
Южный бассейн, 3,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 3 ДКМ |
Южный бассейн, 5,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 4 ДКМ |
Южный бассейн, соль с рапой, на глубину 0–20 см |
|
№ 5 ДКМ |
Береговая линия южного бассейна, соль с рапой, на глубину 0–20 см |
|
№ 6 ДКМ |
Сульфатная соль, северная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–5 см |
|
№ 7 ДКМ |
Сульфатная соль, южная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–5 см |
|
№ 8 ДКМ |
Сульфатная соль, восточная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–5 см |
|
№ 9 ДКМ |
Северная часть прибрежной зоны южного бассейна, 3,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 10 ДКМ |
Южная часть прибрежной зоны южного бассейна, 3,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 11 ДКМ |
Восточная часть прибрежной зоны южного бассейна, 3,0 м от береговой линии, на глубину 0–10 см |
|
№ 12 ДКМ |
Западная часть прибрежной зоны южного бассейна, 3,0 м от береговой линии, на глубину 0–10 см |
|
№ 13 ДКМ |
Северная часть прибрежной зоны южного бассейна, 5,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 14 ДКМ |
Южная часть прибрежной зоны южного бассейна, 5,0 м от береговой линии, соль, на глубину 0–10 см |
|
№ 15 ДКМ |
Вдоль берега, южная часть, белая соль, на глубину 0–10 см |
|
№ 16 ДКМ |
Вдоль берега, восточная часть, бурая соль, на глубину 0–10 см |
|
№ 17 ДКМ |
Вдоль берега, северная часть, белая соль, на глубину 0–10 см |
|
№ 18 ДКМ |
Рапа поверхностная, южная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–10 см |
|
№ 19 ДКМ |
Рапа, галитный пласт, северная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–10 см |
|
№ 20 ДКМ |
Рапа, сульфатный пласт, восточная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–10 см |
|
№ 21 ДКМ |
Ил поверхностный, южная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–10 см |
|
№ 22 ДКМ |
Ил глубинный, южная часть прибрежной зоны южного бассейна, 1,0 м от береговой линии, на глубину 0–10 см |
|
Месторождения Бугажайлы |
|
|
№ 1 БМ |
вдоль берега, белая соль, южная часть, на глубину 0–10 см |
|
№ 2 БМ |
вдоль берега, бурая соль, северная часть, на глубину 0–10 см |
|
№ 3 БМ |
Центр озера, белая соль, на глубину 0–10 см |
|
№ 4 БМ |
Ил глубинный, вдоль берега, южная часть |
|
№ 5 БМ |
Ил поверхностный, вдоль берега, южная часть |
|
№ 6 БМ |
Рапа поверхностная, вдоль берега, южная часть, на глубину 0–10 см |
|
№ 7 БМ |
Рапа глубинная, вдоль берега, южная часть, на глубину 30 см |
|
№ 8 БМ |
Гелеобразная рапа, вдоль берега, южная часть |
Были использованы образцы солесодержащего сырья, характеризующиеся как сульфатно-натриевые, галитные, галитно-сульфатные и натриевые соли. Подготовку образцов для посева проводили стандартными методами [10].
Микробиологическое обследование проводили по общепринятым методикам [11]. Учитывали следующие группы микроорганизмов: общее количество гетеротрофных бактерий, эндобактерий и микромицетов. Для этого использовались следующие питательные среды: МПА, агар Эндо-ГРМ, Чапека. Количество бактерий в образцах определяли методом посева последовательных десятикратных разведений образцов на питательную среду.
Морфолого-культуральные свойства. Для выделения чистых культур использовали бактерии, доминирующие в образцах. Выделение чистых культур осуществляли общепринятыми методами. Морфологию клеток изучали при микроскопии окрашенных по Граму препаратов стандартными методами [12]. Основным критерием для определения различных колоний служила совокупность следующих признаков: пигментация, выделение водорастворимого пигмента, образование внеклеточной слизи, консистенция, размер (мм), наличие воздушного и субстратного мицелия и другие характерные признаки.
Галорезистентность определяли по резистентности к NaCl (г/л среды: 3,0; 5,0; 10,0; 13,0; 17,0; 20,0; 25,0) при посеве бактерий штрихом на чашки, содержащие указанные концентрации NaCl [13].
Статистическая обработка полученных результатов проводилась вычислением среднего арифметического значения и величины стандартного отклонения. Все определения проводились в 3-х и 5-ти кратной повторности. Данные обрабатывались с помощью персонального компьютера IBM «Pentium» на базе пакетов прикладных программ «Excel».
Результаты исследования и их обсуждение
В результате проведения микробиологических исследований было установлено, что количество микроорганизмов в исследуемых образцах зависит от количественно-качественных характеристик солесодержащего сырья (рисунок).
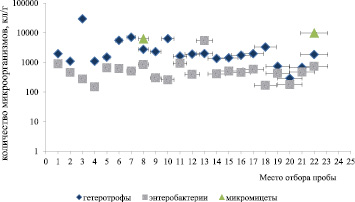
А
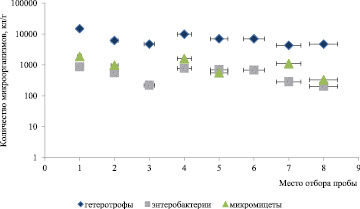
Б
Численность микроорганизмов, выделенных из различных месторождений Южного региона Казахстана: А – Южный бассейн Джаксы-Клычского месторождения; Б – солевой карьер Буга-Джайлы
На основании полученных результатов было установлено, что в пробах отобранных на территории Джаксы-Клычского месторождения (рисунок, а) численность гетеротрофных микроорганизмов колеблется в пределах 104 КОЕ/г. Однако в образцах проб № 3 ДКМ и № 8 ДКМ численность гетеротрофных микроорганизмов составила (2,9 ± 0,3)×105 кл/г и (2,7 ± 0,2)×105 кл/г соответственно. Наименьшее количество микроорганизмов сосредоточенно в пробах № 20ДКМ и № 21 ДКМ, где численность гетеротрофных микроорганизмов составила (2,9 ± 0,3)×103 кл/г и (6,8 ± 0,6)×103 кл/г соответственно. Численность энтеробактерий во всех образцах проб колеблется в пределах 103 КОЕ/г. Микромицеты обнаружены только в пробе № 8 ДКМ и № 22 ДКМ, где их численность составила (6,0 ± 0,5)×103 кл/г и (9,8 ± 0,8)×103 кл/г.
В пробах Бугажайлинского месторождения (рисунок, б) наблюдается аналогичная картина, где численность гетеротрофных микроорганизмов колеблется в пределах 104 КОЕ/г, энтеробактерий 103 КОЕ/г, а численность микромицетов в данных пробах увеличивается, по сравнению с образцами, отобранными из Джаксы-Клычского месторождения. В образцах проб № 1 БМ; № 2 БМ; № 4 БМ; № 5 БМ и № 7 БМ численность микромицетов колеблется в пределах 103 КОЕ/г, в пробе № 8 БМ численность данной группы колеблется в пределах 104 КОЕ/г, в пробах № 3 БМ и № 4 БМ микромицеты не обнаружены.
Установлено, что микрофлора солесодержащего сырья во всех образцах состоит из гетеротрофных микроорганизмов в количестве 104 КОЕ/г и энтеробактерий 103 КОЕ/г, а численность микромицетов характеризуется наименьшим количеством, только в пробах БДМ численность микромицетов была в пределах 104 КОЕ/г.
Из исследованных образцов с учетом морфологических и культуральных свойств микроорганизмов было изолировано 10 культур микроорганизмов. Доминирующую часть гетеротрофной микрофлоры, составили представители родов – Micrococcus, Bacillus, Pseudomonas. Род Micrococcus представлен тремя доминирующими видами – M. luteus, M. roseus, Micrococcus sp. Энтеробактерии представлены одним видом – Enterobacter sp. Микромицеты представлены родами Aspergillus, Mucor, Penicillium и Fusarium.
Галорезистентность изолированных культур микроорганизмов определяли по способности расти при различных концентрациях NaCl от 0 до 20 % (табл. 2).
Таблица 2
Рост культур микроорганизмов при различных концентрациях NaCl в среде, %
|
Культуры |
Рост микроорганизмов при концентрации NaCl, % |
|||||||
|
контроль |
3 |
5 |
10 |
13 |
17 |
20 |
25 |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
|
M. roseus |
90 |
85 |
83 |
81 |
67 |
0 |
0 |
0 |
|
Micrococcus sp. |
90 |
85 |
81 |
73 |
63 |
57 |
0 |
0 |
|
M. luteus |
95 |
93 |
90 |
90 |
88 |
87 |
75 |
0 |
|
Bacillus sp. |
97 |
91 |
90 |
88 |
85 |
82 |
65 |
0 |
|
Pseudomonas sp |
90 |
87 |
85 |
78 |
64 |
58 |
0 |
0 |
|
Enterobacter sp. |
96 |
94 |
90 |
84 |
60 |
0 |
0 |
0 |
|
Aspergillus sp. |
97 |
95 |
93 |
93 |
88 |
66 |
58 |
0 |
|
Mucor sp. |
90 |
65 |
60 |
0 |
0 |
0 |
0 |
0 |
|
Penicillium sp. |
96 |
89 |
85 |
81 |
56 |
51 |
0 |
0 |
|
Fusarium sp. |
90 |
85 |
83 |
66 |
54 |
0 |
0 |
0 |
Примечание. 81–100 % – интенсивный рост, 51–80 % – хороший рост, 0 – отсутствие роста.
Как следует из представленных данных, установлено, что M. roseus интенсивно растет на среде с 3–10 % NaCl, на среде с 13 % NaCl наблюдается хороший рост, а на среде с 17–25 % NaCl рост отсутствует. Micrococcus sp. интенсивно растет на среде с 3–5 % NaCl, на среде с 10–17 % NaCl растет хорошо, а на среде 20–25 % NaCl наблюдается отсутствие роста. M. luteus и Bacillus sp. интенсивно растут на среде с 0–17 % NaCl, на среде 20 % NaCl наблюдается хороший рост, при увеличении процентного содержания NaCl до 25 % рост отсутствует. Культуры Pseudomonas sp и Enterobacter sp. интенсивно растут на среде с 3–10 % NaCl, при увеличении концентрации NaCl до13–17 % культура Pseudomonas sp. растет хорошо, при дальнейшем увеличении концентрации соли до 20 % и выше рост данной культуры прекращается, а рост Enterobacter sp. подавляется уже на среде с 17–25 % NaCl. Aspergillus sp. интенсивно растет на среде с 3–13 % NaCl, на среде с 17–20 % NaCl наблюдается хороший рост, а на среде с 25 % NaCl рост отсутствует. Mucor sp. на среде с 3–5 % NaCl наблюдается хороший рост, в остальных вариантах рост данной культуры отсутствует. На среде с 3–10 % NaCl Penicillium sp. растет интенсивно, хороший рост наблюдается на среде с 13–17 % NaCl. Fusarium sp. интенсивно растет на среде с 3–5 % NaCl, при увеличении процентного содержания NaCl на 10–13 % наблюдается хороший рост, а при увеличении от 17 % до 25 % рост полностью отсутствует.
Выводы
1. Установлено, что микрофлора солесодержащего сырья отобранных из Южного бассейна Аральского моря и Приаралья, Джаксы-Клычского месторождения озерных солей и месторождения Буга-Джайлы состоит из гетеротрофных микроорганизмов со степенью 104 КОЕ/г и энтеробактерий 103 КОЕ/г, а численность микромицетов характеризуется наименьшим количеством, только в пробах Буга-Джайлинского месторождения численность микромицетов составляет до 104 КОЕ/г.
2. Из исследованных образцов было изолировано 10 культур микроорганизмов. Доминирующую часть гетеротрофной микрофлоры составили представители родов – Micrococcus, Bacillus, Pseudomonas. Род Micrococcus представлен тремя доминирующими видами – M. luteus, M. roseus, Micrococcus sp. Энтеробактерии представлены одним видом – Enterobacter sp. Микромицеты представлены родами Aspergillus, Mucor, Penicillium и Fusarium.
3. В ходе изучения галорезистентности изолированных культур микроорганизмов к различным концентрациям NaCl выявлено, что культуры M. luteus, Bacillus sp, Aspergillus sp., Penicillium sp. и Fusarium sp. являются устойчивыми к 17–20 % NaCl.
Библиографическая ссылка
Успабаева А.А., Исаева А.У., Бишимбаев В.К. МИКРОФЛОРА СОЛЕСОДЕРЖАЩЕГО СЫРЬЯ ЮЖНОГО РЕГИОНА КАЗАХСТАНА // Международный журнал прикладных и фундаментальных исследований. 2018. № 10. С. 121-125;URL: https://applied-research.ru/ru/article/view?id=12428 (дата обращения: 05.01.2026).
DOI: https://doi.org/10.17513/mjpfi.12428

