Одной из актуальных задач в области биотехнологии воспроизводства крупного рогатого скота является отбор коров-доноров, наиболее чувствительных к процедуре гормональной стимуляции овуляции и способных произвести в результате максимальное количество зрелых ооцитов [1]. С помощью методики стимуляции суперовуляции в мире ежегодно получают более 500000 эмбрионов крупного рогатого скота [2]. Несмотря на то, что в последние десятилетия в технологию трансплантации эмбрионов был внедрен ряд новых высокотехнологичных методов, эффективность процедуры стимуляции суперовуляции у коров-доноров существенно не увеличилась. Одним из основных лимитирующих факторов развития технологии является высокая вариабельность ответа со стороны организма коров-доноров на гормональную обработку. Физиологический эффект обработки коров-доноров гонадотропинами по-прежнему остается индивидуальным и непредсказуемым [3]. Вместе с тем исследования показали, что эффективность стимуляции овуляции тесно связана с аллельными вариантами гена FSHR, кодирующего рецептор фолликулостимулирующего гормона [4, 5]. Таким образом, ген FSHR является перспективным для исследования связи точечных мутаций и способностью коров-доноров к суперовуляции.
FSHR принадлежит к классу мембранных рецепторов, связанных с G-белками, чья активация запускает сигнальный путь циклического аденозинмонофосфата (цАМФ) [6]. В геноме Bos taurus ген FSHR локализован на хромосоме 11 и состоит из 10 экзонов. Первые 9 экзонов кодируют внеклеточный домен рецептора, экзон 10 кодирует трансмембранный домен [7]. В литературе накоплены данные о связи точечных мутаций в гене FSHR (SNP, single nucleotide polymorphism) с суперовуляторным ответом на стимуляцию гонадотропинами. В гене FSHR B. taurus SNP были выявлены в 5-´UTR и кодирующей частях методом SSCP (Single-Strand Conformation Polymorphism) и исследованы на предмет возможных ассоциаций с репродуктивным потенциалом у крупного рогатого скота голштинской породы [4, 8–10]. Особый интерес представляет несинонимичные замены в экзонах, поскольку такого рода изменения в первичной структуре гена влияют на последовательность и конформацию соответствующего белка. В данном контексте особое внимание привлекает однонуклеотидный полиморфизм 337С/G (rs43745234) в экзоне 4 гена FSHR, соответствующая аминокислотной замене P113A [4]. Было выявлено, что особи, гомозиготные по аллелю G (генотип G337G), характеризуются более высоким процентом жизнеспособных эмбрионов; животные с генотипами G337G и гетерозиготы (генотип G337C) имеют меньше неоплодотворенных ооцитов по сравнению с коровами, гомозиготными по аллелю C (генотип C337C) [4].
Цель исследования: разработка метода дифференциации аллелей 337С/G гена FSHR крупного рогатого скота на основе ПЦР в реальном времени.
Материалы и методы исследования
ДНК выделяли из образцов цельной крови 40 коров черно-пестрого голштинизированного скота с помощью набора реагентов «М-сорб» (Синтол, Россия) согласно рекомендациям производителя. Специфичные праймеры разрабатывались на основе последовательности гена FSHR B. taurus (Gene ID 281172) с учетом локализации однонуклеотидной замены 337С>G (rs43745234). Для конструирования праймеров и зондов использовались программы GeneRunner, Multiple primer analyzer (https://www.thermofisher.com/). Олигонуклеотиды и зонды были синтезированы ООО «ДНК-синтез» (Москва, Россия).
Реакцию проводили в 25 мкл реакционной смеси, содержащей 2,5 мкл 10х буфера для HS TaqDNA полимеразы (Евроген, Россия), 2,5 мкл смеси прямого праймера FSHR-F: 5'-GAATTGAAAAGGCCAACAACC-3' и обратного праймера FSHR-R: 5'-CACCAGAATACAGAAGTTCTTACAGA-3' с концентрацией 10 мкМ, 1 мкл зонда FSHR337С: 5'-FAM-CATCGACCCTGATGCC-BHQ1-3' (10 мкМ), 1 мкл зонда FSHR337G: 5'-VIC-CATCGACGCTGATGC-BHQ1-3', 1 мкл смесь дНТФ (5 мМ), 0,3 мкл HS TaqDNA полимеразы (Евроген, Россия), 10–30 нг ДНК. Программа для проведения ПЦР: 1-й цикл: 95 °С – 3 мин; далее 40 циклов при следующих условиях: 95 °С – 20 сек, 55 °С – 30 сек, 72 °С – 20 сек. Детекция флуоресценции проводилась на стадии отжига праймеров и зондов по каналам FAM и VIC. ПЦР и анализ результатов генотипирования проводили с использованием амплификатора LightCycler® с программным обеспечением версии SW1.1.
Валидацию разработанного метода проводили с помощью ПЦР-ПДРФ анализа. Реакционная смесь для ПЦР (общий объем 20 мкл) готовилась с использованием набора HS Taq DNA Polymerase dNTPmix (Евроген, Россия), праймеров 5'-GCTAAACTAAAACCCACCAG-3' и 5'-TGCTTTGTTTGTCTCTGATGA-3' (конечная концентрация 0,2 мкМ каждого) и 10 нг ДНК. Реакцию амплификации проводили при следующих условиях: 3 мин при 95 °С (1 цикл); 15 с при 95 °С, 15 с при 58 °С, 15 с при 72 °С (40 циклов). Рестрикционный анализ проводили в 20 мкл смеси, содержащей полученные ампликоны, 2 мкл буфера G (10х) и 0,5 мкл эндонуклеазы HgaI (СибЭнзим, Россия) в течение 16 часов при 37 °С. Результаты ПЦР-ПДРФ оценивали методом электрофореза в 1,2 % агарозном геле.
Результаты исследования и их обсуждение
На сегодняшний день для дифференциации аллельных вариантов генов наиболее широко используется метод ПЦР-ПДРФ (полиморфизм длин рестрикционных фрагментов). Основными недостатками данного метода являются многостадийность анализа (амплификация полиморфного участка гена, рестрикция полученного ампликона специфической эндонуклеазой, электрофоретическое разделение образующихся фрагментов), его длительность (более 6–8 ч), вероятность недостоверных результатов в случае неоптимального соотношения количества ДНК, рестриктазы и времени рестрикции. Лимитирующим фактором для применения данного метода является отсутствие рестриктаз к необходимому полиморфному участку гена. Эффективной альтернативой ПЦР-ПДРФ анализу является метод ПЦР в реальном времени [11].
В данной работе был разработан метод дифференциации аллельных вариантов 337C/G гена FSHR методом ПЦР в реальном времени. В ПЦР используются два праймера, фланкирующие участок гена FSHR с полиморфным сайтом 337C/G, и два аллель-специфичных флуоресцентно-меченых зонда TaqMan. В ходе ПЦР происходит амплификация фрагмента гена FSHR крупного рогатого скота длиной 96 п.н. Дифференциация аллелей G337C гена FSHR основана на эффективности гибридизации аллель-специфичных флуоресцентно-меченых зондов FSHR337С: 5'-FAM-CATCGACCCTGATGCC-BHQ1-3' и FSHR337G: 5'-VIC-CATCGACGCTGAT-G-BHQ1-3' на участок ампликона, содержащего полиморфную позицию 337C/G. Идентификация аллелей 337C и 337G проводится по наличию флуоресценции красителей FAM и VIC соответственно. Анализ результатов генотипирования проводили с использованием программного обеспечения для амплификатора LightCycler® 96 SW1.1, которое представляет результаты генотипирования в виде графика распределения аллелей (рис. 1, Г). Для гомозиготных образцов по аллелю C337 (C337C) происходит нарастание флуоресценции по каналу FAM (рис. 1, А). Для гомозиготных образцов по аллелю G337 (генотип G337G) детектируется сигнал по каналу VIC (рис. 1, Б). Для гетерозиготного образца (генотип G337C) наблюдается нарастание флуоресценции обоих красителей (рис. 1, В). Таким образом, результаты ПЦР в реальном времени с использованием аллель-специфичных зондов TaqMan позволяют определить присутствие каждого из исследуемых аллелей 337C/G гена FSHR в анализируемом образце ДНК и генотип животного.
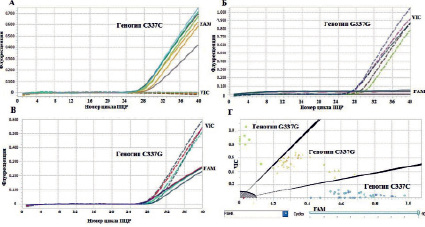
Рис. 1. А – кривые флуоресценции для гомозиготных образцов по аллелю C (генотип C337C). Б – кривые флуоресценции для гомозиготных образцов по аллелю G (генотип G337G). В − кривые флуоресценции для гетерозигот G337C. Г – график распределения аллелей 337C/G гена FSHR
Разработанный нами метод был апробирован на 40 образцах ДНК. Валидацию метода проводили с помощью ПЦР-ПДРФ анализа. Гомозиготный генотип по аллелю G (генотип G337G) характеризуется наличием на электрофореграмме одного фрагмента ДНК длиной 475 пар нуклеотида (п.н.). В электрофоретическом спектре образцов, гомозиготных по аллелю С (генотип C337C), определяются два рестрикционных фрагмента (195 и 280 п.н.). Для гетерозиготных образцов (генотип C337G) характерно наличие всех трех фрагментов ДНК (195, 280 и 475 п.н.) (рис. 2).
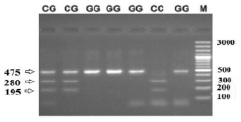
Рис. 2. Пример результатов генотипирования КРС по аллелям 337C/G гена FSHR методом ПЦР-ПДРФ
Результаты обоих методов совпали, однако разработанный нами метод на основе ПЦР в реальном времени с флуоресцентно-мечеными зондами TaqMan позволяет значительно сократить время получения результатов (до 1,5 ч) по сравнению с ПЦР-ПДРФ анализом и может быть использован для единовременного генотипирования большой выборки животных − до 480 в зависимости от модели амплификатора.
Выводы
Нами разработан эффективный метод дифференциации аллельных вариантов 337C/G гена FSHR крупного рогатого скота методом ПЦР в реальном времени с использованием аллель-специфичных зондов, который позволяет проводить крупномасштабное генотипирование популяций крупного рогатого скота с целью отбора коров, наиболее чувствительных к процедуре индукции суперовуляции.
Библиографическая ссылка
Ковальчук С.Н., Бабий А.В., Бурсаков С.А. ДИФФЕРЕНЦИАЦИЯ АЛЛЕЛЕЙ 337C/G ГЕНА FSHR КРУПНОГО РОГАТОГО СКОТА МЕТОДОМ ПЦР В РЕАЛЬНОМ ВРЕМЕНИ // Международный журнал прикладных и фундаментальных исследований. 2018. № 11-2. С. 325-328;URL: https://applied-research.ru/ru/article/view?id=12499 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12499

