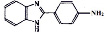Соединения, содержащие ядро бензимидазола, проявляют биологическую [1, 2], антивирусную [3], антимикробную активность [4]. В справочнике М.Д. Машковского более 80 лекарственных средств являются производными бензимидазола [5]. Красители на основе фенилбензимидазола – перспективные флуоресцентные зонды для диагностики и ДНК-лиганды [6]. На основе комплексов металлов с фенилбензимидазолом изготавливают органические светоизлучающие диоды [7]. Датчики на основе фенилбензимидазола служат для селективного определения сульфид-ионов в воде [8]. Диамины бензимидазольного ряда используются в качестве мономеров для производства полимеров с уникальными свойствами [9]. В связи с вышесказанным сведения о спектрально-люминесцентных свойствах этих соединений чрезвычайно важны для их успешного использования в прикладных разработках и фундаментальных исследованиях гетероциклических соединений.
Работа посвящена изучению спектров поглощения и флуоресценции фенилбензимидазола е его производных.
Материалы и методы исследования
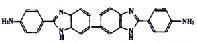
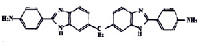
Объектами исследования были 2-фенилбензимидазол (ФБИ), 1,2-дифенилбензимидазол (ДФБИ), 4´-амино-2-фенилбензимидазол (АФБИ), 6-амино-2-фенилбензимидазол (ФАБИ), 6,4´-диамино2-фенилбензимидазол (ДАФБИ), 1,4-ди-(бензимидазолил-2)-бензол (ДБИБ), 1,4-ди-(6-диаминобензимидазолил-2) бензол (ДАБИБ), 5,5´-бис(4-амино-2-фенилбензимидазолил-3) (бис-АФБИ), ди-(4´-амино-2-фенилбензимидазолил-5) метан (ДАФБИМ), 1,3-диамино(4,6-бензимидазолил-2)- бензол (ДАДБИБ). Использовали ФБИ (Aldrich Chemical, 99 %), другие производные фенилбензимидазола были синтезированы и очищены в ИНЭОС. Все растворители имели квалификацию «для спектроскопии». Чистоту объектов исследования и растворителей проверяли по спектрам поглощения и на присутствие люминесцирующих примесей. Концентрация исследуемых растворов варьировалась от 5·10-5 до 2·10-7 моль/дм3. Спектры поглощения записывали на спектрофотометре Perkin Elmer 554 и UV-1800 Shimadzu. Спектры флуоресценции и возбуждения флуоресценции регистрировали на спектрофлуориметре MPF 44 Perkin Elmer и СМ2203 Solar с термостатом в кварцевых кюветах с толщиной поглощающего слоя 1 см.
Результаты исследования и их обсуждение
Фенилбензимидазол и его аминопроизводные в растворителях различной природы и полярности обладают интенсивными полосами поглощения и яркой видимой флуоресценцией. Нижним Т-состоянием аминопроизводных ФБИ является состояние πιπ*- типа с энергией около 21000 см-1. Нижнее S-состояние имеет также πιπ* природу. Во всех исследованных растворителях эти соединения относятся к V типу систематики молекул по относительному положению уровней nπ* и ππ* природы [10]. Аминороизводные бензимидазола чувствительны к природе растворителя и кислотности среды [11–13]. Незамещенный ФБИ, а также ДБИБ обладают интенсивными полосами поглощения с грубой колебательной природой в апротонных растворителях, которая сохраняется также и в этаноле (рис. 1).
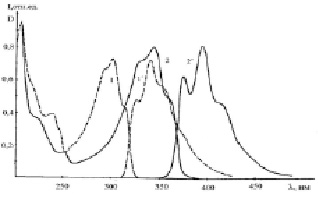
Рис. 1. Спектры поглощения (1, 2) и флуоресценции (1´, 2´) этанольных растворов ФБИ (1, 1´) и ДБИБ (2, 2´). СФБИ = 2,7·10-5 М; СДБИБ = 1,4·10-5 М
В водных растворах колебательная структура полос поглощения и флуоресценции нарушается. Полосы S1 – S0 переходов ФБИ и ДБИБ имеют более выраженную колебательную структуру, чем полосы S0 – S1 переходов, что может быть объяснено планаризацией молекул при фотовозбуждении. Согласно [14] частота колебаний ФБИ в S0-состоянии 1391 см-1, а в S1-состоянии она составляет 922 см-1. Первое возбужденное синглетное состояние формируется из первого локального возбужденного состояния бензимидазольного ядра и конфигурации переноса заряда с фенильного кольца на бензимидазольный цикл, причем доля последнего составляет 25 %. Протонирование бензимидазольного цикла усиливает его акцепторные свойства, что должно привести к усилению переноса заряда и изменению природы S1 – S0 перехода. Если в молекуле ФБИ это ππ*- переход, то в катионе – переход с переносом заряда [14]. Присоединение протона к имидазольному циклу молекулы ФБИ не оказывает существенного влияния на полосу поглощения. Наблюдается лишь небольшое ее коротковолновое смещение. В водных растворах максимум полосы поглощения ФБИ испытывает гипсохромный сдвиг от 302 до 296 нм, в то время как максимум полосы флуоресценции смещается батохромно от 350 до 355 нм [13]. Спектральные эффекты протонирования аминопроизводных фенилбензимидазола описаны в [13, 15].
Спектры поглощения и флуоресценции ДБИБ по форме повторяют спектры ФБИ, однако сдвинуты батохромно на 40 нм вследствие увеличения π-системы молекулы. Батохромный сдвиг спектров ДФБИМ относительно невелик и составляет 6 нм. Увеличение вероятности электронных переходов в молекулах ДБИБ и ДФБИМ приводит также к повышению коэффициента молярного погашения. Замена атома водорода на фенильный радикал в молекуле ДФБИ приводит к гипсохромному сдвигу полосы поглощения и утрате ее колебательной структуры.
Полосы поглощения и флуоресценции аминопроизводных ФБИ смещены батохромно относительно полос незамещенного соединения. При пара-аминозамещении в фенильном фрагменте молекулы ФБИ батохромный сдвиг электронных спектров составляет порядка 1300 см-1, в водных растворах и 1500 см-1 в этаноле. В случае введения аминогруппы в положение 6 бензимидазольного цикла – 2200 см-1 и 2700 см-1 соответственно. Наблюдаемые изменения обусловлены образованием межмолекулярных водородных связей с участием аминогрупп. Поскольку основность аминогруппы бензимидазольного цикла выше [13], то образование водородной связи происходит в первую очередь по этой группе. В результате донорные свойства аминогруппы бензимидазольного цикла в водных растворах выражены слабее, чем в этаноле. В случае введения двух аминогрупп в молекулу ФБИ величина смещения несколько меньше суммы смещений, вызываемых каждой аминогруппой в отдельности, и составляет в молекуле ДАФБИ 2800–3300 см-1.
Полосы поглощения и флуоресценции ДАФБИМ и бис-АФБИ повторяют по форме полосы поглощения и флуоресценции АФБИ (рис. 2), а полосы поглощения и флуоресценции ДАБИБ – полосы ФАБИ, но сдвинуты в более длинноволновую область. В случае ДАФБИМ величина смещения максимумов полос поглощения и флуоресценции по сравнению с АФБИ составляет 3–5 нм, а в случае бис-АФБИ – 28 нм. Полоса S0 – S1 перехода ДАБИБ расположена на 35 нм длинноволновее соответствующей полосы ФАБИ. Малая величина сдвига полос поглощения и флуоресценции ДАФБИМ по сравнению с АФБИ при существенном увеличении π-системы молекулы обусловлена разобщающим эффектом метиленового мостика на систему сопряженных связей [15].
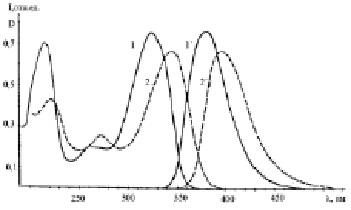
Рис. 2. Спектры поглощения (1, 2) и флуоресценции (1´, 2´) этанольных растворов ДАФБИМ (1, 1´) и бис-АФБИ (2, 2´). СФБИ = 1,1·10-5 М; СДБИБ = 1,2·10-5 М
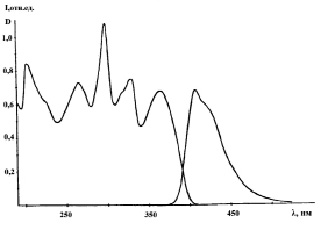
Рис. 3. Спектры поглощения и флуоресценции этанольного раствора ДАДБИБ. С = 2,2·10-5 М
Спектр поглощения ДАДБИБ имеет сложный характер. Он состоит из четырех хорошо разрешенных полос (рис. 3). Полоса длинноволнового перехода не имеет колебательной структуры и является полосой перехода с переносом заряда. Полосы с максимумами при 295 и 326 нм представляют собой расщепление длинноволновой полосы поглощения АФБИ. Максимумы полос поглощения и флуоресценции этанольных растворов производных ФБИ представлены в таблице.
Стоксово смещение флуоресценции при пара-аминозамещении в фенильном кольце возрастает по сравнению с незамещенным ФБИ, что указывает на усиление переноса заряда с фенильного кольца на бензимидазольный цикл. По данным квантовохимических расчетов [11], вклад состояния переноса заряда с фенильного кольца на имидазольный цикл в S1-состоянии молекулы АФБИ возрастает по сравнению с ФБИ с 25 % до 60 %. Величина стоксова смещения этанольных растворов АФБИ и ДАФБИМ составляет около 5000 см-1, в то время как ∆νст. бис-АФБИ на 1000 см-1 меньше, и практически не отличается от величины стоксова смещения флуоресценции ФБИ и его производных, не содержащих аминогрупп (таблица).
Максимумы спектров поглощения и флуоресценции этанольных растворов соединений бензимидазольного ряда
|
Соединение |
λпогл., нм |
ε·10-3, л моль-1 см-1 |
λфл., нм |
∆νст., см-1 |
|
ФБИ
|
302* 242 |
25,3 13,6 |
342* |
3860 |
|
ДФБИ
|
292 |
22,9 |
347 |
5430 |
|
ДБИБ
|
342* 251 |
56,2 9,4 |
394* |
3860 |
|
ДФБИМ
|
308* 242 |
49,5 34,9 |
350* |
3900 |
|
АФБИ
|
316 264 |
26,0 6,0 |
375 |
4980 |
|
ДАФБИМ
|
322 266 |
67,0 16,6 |
378 |
4600 |
|
Бис-АФБИ
|
342 270 220 |
5,3 20,0 55,0 |
395 |
3920 |
|
ФАБИ
|
329 260 |
18,3 9,6 |
442 |
7780 |
|
ДАФБИ
|
336 279 216 |
31,0 13,3 31,8 |
423 |
6120 |
|
ДАБИБ
|
374 272 236 |
45,0 9,0 21,8 |
520 |
7510 |
|
ДАДБИБ
|
362 326 295 262 |
29,3 31,4 50,3 31,8 |
420* 405 |
2930 |
Примечание. * – полосы с колебательной структурой.
Введение аминогруппы в бензимидазольный цикл значительно усиливает перенос заряда в молекулах. Величина стоксова смещения молекул с аминогруппой в бензимидазольном цикле составляет 6000–8000 см-1 [12]. При введении двух аминогрупп – в фенильное кольцо и бензимидазольный цикл стоксово смещение несколько меньше, чем в молекуле ФАБИ. Данный эффект может быть интерпретирован в предположении, что влияния аминогрупп в возбужденном состоянии на дипольный момент в молекуле ДАФБИ противоположны, при этом эффект аминогруппы в бензимидазольном цикле превалирует.
Небольшая величина стоксова сдвига в молекуле ДАДБИБ свидетельствует об образовании внутримолекулярных водородных связей между третичным атомом азота имидазольного цикла и атомами водорода аминогрупп, вследствие чего образование межмолекулярных водородных связей затруднено.
Выводы
Спектры поглощения и флуоресценции производных фенилбензимидазола, не содержащих аминогрупп, имеют грубую колебательную структуру. Введение аминогрупп в молекулу приводит к усилению переноса заряда в молекуле, батохромному сдвигу полос поглощения и флуоресценции и увеличению стоксова смещения флуоресценции. Образование межмолекулярных водородных связей между аминогруппами производных фенилбензимидазола и молекулами растворителя уменьшает стоксово смещение флуоресценции.
Библиографическая ссылка
Некрасова Л.П. СПЕКТРЫ ПОГЛОЩЕНИЯ И ФЛУОРЕСЦЕНЦИИ СОЕДИНЕНИЙ ФЕНИЛБЕНЗИМИДАЗОЛЬНОГО РЯДА // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-1. С. 36-41;URL: https://applied-research.ru/ru/article/view?id=12517 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12517