Способность к прикреплению и распластыванию на субстрате – фундаментальное свойство клеток, влияющее на процессы развития, органогенеза и гомеостаза организма. Нарушения этих процессов влияют на скорость регенерации поврежденных тканей, иммунного ответа организма, а кроме того могут быть причиной развития опухолей [1].
В ранних работах показано, что процесс распластывания клеток на субстрате имеет линейную динамику [2], что может быть объяснено асинхронностью начала распластывания в разных клетках и гетерогенностью популяции по стадиям распластывания. Синхронизация клеток по началу распластывания позволила выявить нелинейность этого процесса. В нем выделяют 3 фазы: прикрепления (Р0), быстрого распластывания (Р1) и медленного распластывания с дальнейшей поляризацией (Р2) [3]. Первая фаза распластывания достаточно короткая, её продолжительность составляет всего несколько минут и зависит от степени адгезивности субстрата и присутствия сыворотки в среде культивирования [4]. Вторая стадия также непродолжительна, характеризуется быстрым ростом площади клетки за счет образования значительных по размерам протрузий и незначительных ретракций [5]. Третья стадия является самой продолжительной и характеризуется медленным ростом средней площади клетки, ее периодическими значительными сокращениями, а также образованием стабильных клеточных адгезий.
Распластывание клеток на субстрате начинается с выдвижения коротких плоских выростов плазматической мембраны – ламеллиподий – и зависит от скорости полимеризации актина на краю клетки [6]. Быстро увеличив свою площадь на первых стадиях распластывания, клетка поляризуется за счет формирования актомиозиновых комплексов и их сокращения [7]. Таким образом, роль актина и актомиозиновых комплексов на ранних этапах распластывания является ведущей и подтверждается в опытах с использованием их селективных ингибиторов. Латранкулин А, связываясь с мономерным актином, предотвращает его полимеризацию. Разрушение пучков актина с помощью цитохолазина D или латранкулина B приводит к потере способности клетки к поляризации, движению и переориентации при изменении направления растяжения субстрата [8].
Микротрубочки также играют существенную роль в распластывании, поляризации и последующем движении клеток. Так, растущие микротрубочки на краю клеток стимулируют формирование ламеллиподий [9]. Деполимеризация микротрубочек в распластанных и распластывающихся клетках приводит к усилению актомиозинового сокращения [10] и гипертрофии стресс-фибрилл в клетках. К таким же последствиям приводит не только полная разборка микротрубочек, но и подавление их динамической нестабильности [11]. Динамичные микротрубочки в движущихся клетках стимулируют разборку фокальных контактов [12], подавляя актомиозиновое сокращение. Таким образом, различные элементы цитоскелета обеспечивают прикрепление, распластывание и передвижение клеток по субстрату, а динамика этих процессов определяется взаимодействием системы микротрубочек и актиновых филаментов.
В настоящее время для регенерации поврежденных тканей все шире используются мезенхимальные стволовые клетки. Их культивирование и дифференцировка проводятся in vitro. Известно также, что при ряде патологических состояний наблюдаются повреждения цитоскелета и его функциональные нарушения в клетках. В связи с этим важно определить динамические свойства разных компонентов цитоскелета в распространенной in vitro модели культивирования нормальных мезенхимальных стволовых клеток КРС для разработки экспериментальных и клинических моделей заболеваний, связанных с патологиями цитоскелета.
Цель исследования: анализ процесса прикрепления и распластывания мезенхимальных стволовых клеток КРС в нормальных условиях и в условиях нарушений цитоскелета под действием селективных ингибиторов.
Материалы и методы исследования
Культура клеток
Мезенхимальные стволовые клетки крупного рогатого скота (МСК КРС) 5–7 пассажей (получены из банка Центра экспериментальной эмбриологии и репродуктивных биотехнологий, Москва, Россия) культивировали при 37 °С в атмосфере 5 % СО2, в среде DMEM/F12(1:1) с добавлением 10 % телячьей эмбриональной сыворотки (ПанЭко, Россия), гентамицина в концентрации 0,09 мг/мл, 2,5 мкг/мл амфотерицина В и 2 мМ глутамина. Для детального анализа распластывания полученную при помощи раствора трипсин-ЭДТА (ПанЭко, Россия) суспензию клеток помещали в чашки Петри. Концентрацию клеток подбирали таким образом, чтобы в ходе распластывания соседние клетки не контактировали. Прижизненные наблюдения вели при помощи системы Nikon BioStation IM-Q, изображения записывались с интервалом 1 минута в течение 3,5 часов.
Ингибиторы
Для деполимеризации микротрубочек (МТ) использовали нокодазол (Sigma-Aldrich, USA) в концентрации 1 мкМ. Для стабилизации МТ использовали 1 мкМ паклитаксела (таксол) (Sigma-Aldrich, USA). Для ингибирования полимеризации актина клетки инкубировали с 30 нМ цитохалазином Д (Sigma-Aldrich, США) или 200 нМ латрункулином Б (Sigma-Aldrich, США). Ингибитором Rho-ассоциированной киназы (ROCK) являлся 10 мкМ Y-27632 (Sigma-Aldrich, США).
Флуоресцентная микроскопия
Клетки фиксировали 2.5 % раствором глутарового альдегида на PBS (pH = 7,2) при +4 °C в течение 20 минут, трижды отмывали PBS и проводили пермеабилизацию клеток смесью 0,01 % Triton-X114 и 0.01 % Tween-20 на PBS в течение 60 минут при комнатной температуре. После трехкратной отмывки буфером клетки обрабатывали 1 % раствором боргидрида натрия. Затем клетки окрашивали первыми антителами к α-тубулину (клон DM1A, Invitrogen, США) в соотношении 1:150 при температуре 37 °C 60 минут и вторыми антителами, конъюгированными с флуоресцентным красителем Cy-2 (Invitrogen, США). Затем клетки окрашивали с помощью ActinReadyProbes 555 (Invitrogen,Thermo Fisher Scientific, США) 30 минут при комнатной температуре, для контрастирования ядер использовали флуоресцентный краситель DAPI (разведение 1:500, окрашивание в течение 10 минут при комнатной температуре). Препараты заключали в мовиол и производили съемку на инвертированном флуоресцентном микроскопе NikonEclipseTI (Nikon, Япония) с помощью фазовоконтрастного объектива планапохромат 60х/1.4 (Nikon, Япония), используя кубики светофильтров для FITC, DAPI и Texas Red. Изображения записывались на компьютер с помощью охлаждаемой КМОП камеры ORCAFlash 4.2 (Hamamatsu, Япония), управляемой программой MicroManager.
Анализ данных
Обработку и анализ полученных фильмов производили в программе ImageJ (NIH Image, США). Скорость распластывания рассчитывали как скорость увеличения площади клеток в единицу времени. Статистический анализ производили в программе SigmaPlot 3.0 (Jandel Scientific, США). Окончательную обработку изображений проводили в программе Photoshop CS (Adobe Inc., США).
Результаты исследования и их обсуждение
Распластывание – это нелинейный процесс
Для описания поведения МСК КРС при распластывании были построены кривые кинетики распластывания. Распластывание клеток на субстрате может идти двумя путями: изотропно и анизотропно. Изотропное распластывание характеризуется быстрым образованием симметричной кольцевой ламеллы, тогда как при анизотропном распластывании происходит одновременное формирование нескольких ламелл, и весь процесс идет медленнее. Для большинства МСК КРС характерно анизотропное распластывание, в некоторых клетках распластывание было изотропным.
Кинетика распластывания МСК может быть описана в виде сигмовидной кривой. Начальная скорость распластывания была максимальной в первые 10 минут (фаза Р1) (рис. 1, табл. 1). Дальнейшее распластывание (фаза Р2) проходило медленнее, и в конце первого часа общая площадь клеток увеличилась в 6,21 ± 0,82 раз по сравнению с начальными значениями (табл. 2). Далее, скорость распластывания продолжала снижаться, в то время как некоторые клетки частично поджимались. Площадь клеток к концу третьего часа увеличилась в 10,16 ± 1,62 раз относительно начальной площади (рис. 2).
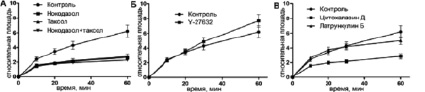
Рис. 1. Кинетика распластывания МСК КРС в контроле и при воздействии ингибиторов цитоскелета в интервале 0–60 минут
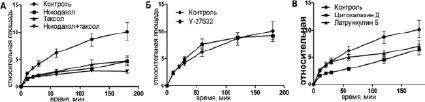
Рис. 2. Кинетика распластывания МСК КРС в контроле и при воздействии ингибиторов цитоскелета в интервале 0–180 минут
Распластывание сопровождалось изменениями морфологии клеток. В момент прикрепления круглые клетки имели ровный контур (рис. 3), к третьему часу края клеток становились изрезанными. После детального анализа кинетики и морфологии распластывания МСК мы перешли к описанию цитоскелета. Для анализа роли МТ мы использовали 3 воздействия: полную деполимеризацию МТ в высокой концентрации нокодазола (1 мкМ), полную стабилизацию МТ в высокой концентрации паклитаксела (1мкМ) и подавление динамической нестабильности МТ сочетанием наномолярных доз нокодазола и паклитаксела. Для анализа роли актина в распластывании МСК мы использовали ингибиторы полимеризации актина (30 нМ цитохалазин Д и 200 нМ латрункулин Б). Для анализа роли миозина II мы ингибировали миозин II-фосфорилирующую киназу ROCK специфическим ингибитором Y-27632 в концентрации 10 мкМ.
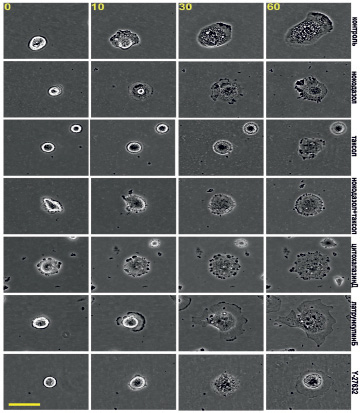
Рис. 3. Распластывание мезенхимальных стволовых клеток в норме и в присутствии ингибиторов цитоскелета. Масштабный отрезок – 10 мкм
Распластывание МСК при деполимеризации МТ
Клетки с деполимеризованными МТ были круглыми, распластывание сопровождалось активным блеббингом. Некоторые клетки так и не начали распластываться в течение всего времени (3,5 ч). Распластывание начиналось с образования небольших псевдоподий, которые сплющивались при прикреплении, а затем образовывали небольшие пластинки. Блеббинг не прекращался после образования ламеллы и продолжался в течение 1–3 ч (рис. 3). Процесс распластывания клеток с разрушенными МТ всегда был анизотропным и мог быть описан линейной зависимостью (рис. 2). Распластывание клеток проходило медленнее относительно контроля. К концу первого часа площадь клеток увеличилась в 2,64 ± 0,19 раз, а к концу третьего часа в 4,74 ± 0,65. Кроме того, площадь клеток под воздействием нокодазола была меньше в любой временной точке относительно контроля (табл. 2).
Таким образом, полная деполимеризация МТ приводит к возникновению блеббинга, который сопровождает выдвижение ламеллы, замедлению распластывания и отсутствию клеток с широкими ламеллами и к исчезновению быстрой фазы распластывания. Поскольку многие эффекты, связанные с отсутствием МТ, могут происходить и в случае стабилизации МТ, мы дополнительно оценивали поведение клеток после стабилизации МТ высокими дозами паклитаксела.
Распластывание МСК в условиях стабилизации МТ
При полной стабилизации МТ блеббинг начинается еще до момента прикрепления клеток и продолжается в течение всех 3,5 часов наблюдения (рис. 3). Клетки начинают распластываться изотропно, но кривая распластывания описывается линейной зависимостью (рис. 2). Через 60 минут площадь клеток увеличивается в 2,76 ± 0,39 раз. К концу третьего часа площадь клеток увеличивается в 4,78 ± 0,86 раз относительно площади в момент прикрепления. Площадь клеток под воздействием паклитаксела всегда ниже, чем в контроле (табл. 2). Скорость распластывания клеток со стабильными МТ всегда ниже, чем в контроле, однако статистически достоверно отличаются скорости только в течение первого часа распластывания (табл. 1).
Таблица 1
Скорость распластывания МСК КРС
|
Скорость (мкм2/мин) |
Временной интервал, мин |
|||||
|
0–10 |
10–20 |
20–30 |
30–60 |
60–120 |
120–180 |
|
|
Контроль |
181 ± 24 |
137 ± 21 |
105 ± 27 |
82 ± 18 |
51 ± 16 |
28 ± 18 |
|
ЦитохалазинД |
111 ± 19 |
78 ± 17 |
34 ± 9 |
45 ± 9 |
54 ± 10 |
56 ± 16 |
|
ЛатрункулинБ |
242 ± 24 |
165 ± 26 |
60 ± 21 |
39 ± 12 |
17 ± 5 |
7 ± 9 |
|
Y-27632 |
190 ± 20 |
199 ± 27 |
194 ± 29 |
141 ± 26 |
29 ± 4 |
11 ± 5 |
|
Нокодазол |
56 ± 7 |
41 ± 9 |
32 ± 5 |
23 ± 3 |
15 ± 3 |
30 ± 10 |
|
Таксол |
87 ± 13 |
42 ± 9 |
40 ± 9 |
25 ± 7 |
33 ± 12 |
14 ± 5 |
|
Нокодазол + таксол |
96 ± 17 |
33 ± 6 |
26 ± 5 |
18 ± 3 |
17 ± 4 |
3 ± 3 |
Таким образом, полная стабилизация МТ приводит к возникновению блеббинга, который сопровождает распластывание в течение всего времени наблюдения, значительному замедлению процесса распластывания и уменьшению площади клеток.
Поскольку выдвижение ламеллы главным образом связано с работой актомиозинового комплекса, далее мы проанализировали процесс распластывания мезенхимальных стволовых клеток при нарушении активации миозина II и при ингибировании полимеризации актина наномолярными дозами цитохалазина Д и латрункулина Б.
Распластывание в условиях подавления миозин II-зависимого каскада
В присутствии Y-27632 клетки демонстрировали нормальную кинетику распластывания в течение всего времени наблюдения. Распластывание происходило за счет формирования протрузий в нескольких направлениях, поэтому ламелла была изрезанной и рассеченной, а клетки к 3 часу приобретали звездчатую форму с многочисленными выступами, которые продолжали удлиняться.
Кинетика распластывания для всех трех фаз: P0, P1 и P2 – была почти одинаковой для клеток в присутствии Y-27632 и контрольных клеток во все моменты времени (рис. 2). Под воздействием ингибитора края клеток становились более изрезанными (через 3 ч значение округлости составляло 0,55 ± 0,05).
Таким образом, при ингибировании миозина II происходят значительные изменения в морфологии клеток. В связи с тем, что кинетика распластывания под воздействием Y-27632 не изменяется, мы дополнительно оценивали поведение клеток при подавлении полимеризации актина цитохалазином Д и латрункулином Б в наномолярных концентрациях.
Процесс распластывания при нарушении полимеризации актина
Под воздействием цитохалазина Д распластывание сопровождается активным блеббингом, который начинается до прикрепления клеток к субстрату и продолжается в течение всего времени наблюдения. В момент прикрепления клетки имеют круглую форму, но к концу первого часа клетки имеют несколько зон активности (рис. 3). Кинетика распластывания описывается нелинейно, клетки распластывались с максимальной скоростью в первые 10 минут (рис. 1, табл. 1). К концу первого часа площадь клеток увеличилась в 2,86 ± 0,37 раз. Через 3 часа площадь клеток увеличилась в 6,42 ± 1,03 раза относительно начального значения.
Под воздействием латрункулина Б блеббинг появлялся с момента прикрепления, но к концу первого часа пузырей становилось меньше. Распластывание шло анизотропно за счет образования нескольких ламелл. Через 20 минут клетки имели значительно более изрезанный контур по сравнению с контролем, за счет образования вогнутых участков (округлость 0,74 ± 0,03). В ходе дальнейшего распластывания вогнутые участки были стабильными, а ламелла продолжала выдвигаться, что способствовало увеличению изрезанности ламеллы (округлость к концу первого часа – 0,64 ± 0,04) (рис. 3). Таким образом, ингибирование полимеризации актина цитохалазином Д замедляет процесс распластывания и изменяет морфологию клеток. Ингибирование полимеризации актина латрункулином Б значительно влияет на морфологию клеток и замедляет распластывание клеток в часовом интервале.
Морфология систем цитоскелета в контрольных клетках
В контрольных клетках уже через 10 минут после прикрепления начинают полимеризоваться МТ (рис. 4). Актин тонкой полосой окаймляет клеточную ламеллу, а также распределен по всей цитоплазме (рис. 4).
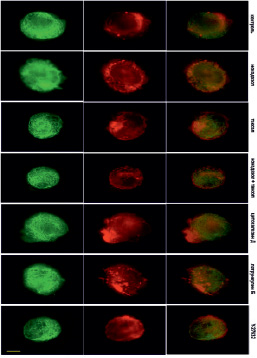
Рис. 4. Микротрубочки (зеленые) и актин (красный) через 10 мин после прикрепления клеток к субстрату в норме и при ингибировании цитоскелета. Масштабный отрезок – 10 мкм
Через 30 минут в клетках формируется густая радиальная сеть микротрубочек, но большинство растут дугообразно, замыкаясь в кольцевую структуру, которая не дорастает до края клеток (рис. 5).
В это же время начинает полимеризоваться актин, и по периферии клетки располагаются короткие радиально направленные пучки актиновых микрофиламентов. Через 60 минут после начала распластывания МТ образуют густую сеть, большинство МТ направлены перпендикулярно краю клетки (рис. 6). Также в клетке формируются актиновые стресс-фибриллы, которые располагаются по всей цитоплазме, а кроме того, актин распределен по самому краю клетки, образуя окаймление (рис. 6).
Цитоскелет в условиях деполимеризации МТ
Под воздействием высоких доз нокодазола МТ в клетках отсутствуют на всех стадиях распластывания (рис. 4–6). При полной разборке микротрубочек в клетках наблюдается блеббинг, актин сосредоточен в пузырях и окаймляет их (рис. 4). Через 30 минут после посадки актин также находится в блебсах, а актин распределен по цитоплазме. В отличие от контрольных клеток, стресс-фибриллы на данном этапе распластывания отсутствуют (рис. 5). Через 60 минут после посадки крупные актиновые стресс-фибриллы располагаются циркулярно, а небольшие пучки актина распределены по всей цитоплазме.
В условиях полной деполимеризации МТ содержание полимерного актина (собранного в стресс-фибриллы и в пучки) меньше, по сравнению с контролем (рис. 6).
Цитоскелет при полной стабилизации МТ
Под воздействием паклитаксела в высокой концентрации МТ образуют более редкую сеть в любой момент распластывания. Кроме того, по сравнению с контрольными клетками, МТ сильно не дорастают до края клетки (рис. 4–6). Актин, через 10 мин после посадки, располагается преимущественно в пузырях (рис. 4). Через 30 мин после начала распластывания актин сосредоточен на периферии клетки, а также выявляются скопления актина в цитоплазме. Стресс-фибриллы в отличие от контрольных клеток отсутствуют (рис. 5). Через 60 мин после начала распластывания, в клетках с полностью стабилизированными МТ формируются полигональные актиновые стресс-фибриллы (рис. 6).
Цитоскелет при ингибировании полимеризации актина
Под воздействием цитохолазина Д актин сконцентрирован в пузырях клеток, распластывание которых сопровождается активным блеббингом (рис. 4–6). Система МТ на раннем этапе распластывания (через 10 мин после посадки) такая же как и контроле. При этом во время блеббинга микротрубочки врастают в пузыри (рис. 4). Через 30 минут после посадки сеть МТ более редкая, чем в контроле. Актин сконцентрирован по клеточной периферии и рассеян по цитоплазме.
Цитоскелет в условиях подавления миозин II-зависимого каскада
При ингибировании ROCK через 10 мин после начала распластывания МТ выглядят также как и контроле. Актин сконцентрирован в блебсах клеток (рис. 4). Через 30 мин МТ образуют густую кольцевую сеть, при этом, в отличие от контрольных клеток, под воздействием Y-27632 выявляются МТ, которые сильно изгибаются и образуют петли. Актин сконцентрирован в пузырях и распределен по цитоплазме, пучки и стресс-фибриллы отсутствуют (рис. 5). Под воздействием Y-27632 стресс-фибриллы формируются на стабильных краях клетки и в цитоплазме. В отличие от контрольных клеток стресс-фибриллы в центральной части клетки отсутствуют (рис. 6).
Распластывание мезенхимальных стволовых клеток КРС на субстрате является сложным многостадийным процессом. Кинетика распластывания носит нелинейный характер и состоит из фаз быстрого (Р1) и медленного (Р2) распластывания. Эти же фазы распластывания описаны для клеток, завершивших процесс дифференцировки: клетки из эпителия почки мартышки линии Vero [11], клетки сердечного эндотелия лягушки XTH-2 [3]. Фаза быстрого распластывания МСК КРС длится всего 10 мин и характеризуется максимальной скоростью. Далее наступает фаза медленного распластывания, которая не прекращается в течение 3 ч, и характеризуется постепенным уменьшением скорости распластывания. Подавляющее большинство МСК распластывается асинхронно, поляризуется через 1–2 ч и переходит к активной миграции, что в наибольшей степени соответствует динамике клеток Vero [11]. Стоит отметить, что поляризация нормальных фибробластов в других моделях наступает гораздо позднее: через 6–8 часов после начала распластывания [1, 13].
Полная деполимеризация МТ в значительной степени подавляет процесс распластывания МСК, кривая распластывания приобретает линейный вид. Распластывание клеток сопровождается блеббингом в течение всех 3,5 ч наблюдения. По истечении 30 мин активные участки ламеллы начинают разделяться вогнутыми стабильными краями. В клетках под воздействием нокодазола существенно снижается скорость распластывания (табл. 1). Площадь клеток по истечении 3 ч оказывается меньше, чем в контрольных клетках (табл. 2). Однако для фибробластов показано, что конечная площадь распластанных клеток не изменяется при деполимеризации МТ [14]. Эффект полной стабилизации МТ проявляется похожим образом, клетки подвергаются продолжительному блеббингу. Таким образом, баланс системы МТ критичен для нормального процесса распластывания, поскольку даже частичное подавление динамики МТ приводит к значительному замедлению процесса распластывания.
Известно, что киназа ROCK ингибирует ацетилирование МТ, что способствует активной миграции и инвазии клеток [15]. Таким образом, можно предположить, что ингибирование киназы ROCK может замедлять распластывание клеток, опосредованно, через стабилизацию МТ. Однако на стадии распластывания клеток подавление киназы ROCK в значительной степени влияет только на морфологию клеток, когда клетки приобретают звездчатую форму, но не замедляет процесса распластывания (табл. 1). Кроме того, высокие дозы ингибитора на стадии распластывания МСК приводят к значительному увеличению их площади, что также было показано для фибробластов крысы [13]. Таким образом, ингибирование киназы ROCK не влияет на кинетику распластывания, но существенно изменяет морфологию клеток.
Таблица 2
Изменение площади МСК КРС в процессе распластывания
|
Площадь, мкм2 |
Временная точка, мин |
||||||
|
0 |
10 |
20 |
30 |
60 |
120 |
180 |
|
|
Контроль |
524 ± 73 |
1263 ± 151 |
1820 ± 204 |
2250 ± 269 |
3259 ± 430 |
4565 ± 620 |
5329 ± 851 |
|
Цитохалазин Д |
788 ± 79 |
1243 ± 110 |
1563 ± 164 |
1701 ± 194 |
2253 ± 290 |
3571 ± 499 |
5058 ± 808 |
|
Латрункулин Б |
599 ± 41 |
1583 ± 113 |
2256 ± 204 |
2501 ± 225 |
2986 ± 317 |
3387 ± 389 |
4236 ± 578 |
|
Y-27632 |
611 ± 52 |
1384 ± 107 |
2193 ± 205 |
2984 ± 308 |
4705 ± 544 |
5417 ± 569 |
5602 ± 625 |
|
Нокодазол |
529 ± 37 |
759 ± 53 |
971 ± 69 |
1104 ± 80 |
1396 ± 101 |
1765 ± 151 |
2507 ± 345 |
|
Таксол |
572 ± 44 |
926 ± 83 |
1100 ± 109 |
1263 ± 145 |
1576 ± 220 |
2389 ± 452 |
2734 ± 489 |
|
Нокодазол + таксол |
686 ± 65 |
1079 ± 116 |
1215 ± 112 |
1323 ± 117 |
1554 ± 127 |
1982 ± 192 |
1930 ± 202 |
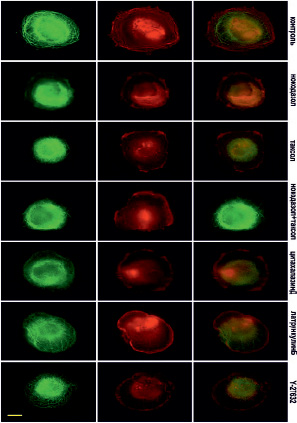
Рис. 5. Микротрубочки (зеленые) и актин (красный) через 30 мин после прикрепления клеток к субстрату (стекло) в норме и при ингибировании цитоскелета. Масштабный отрезок – 10 мкм
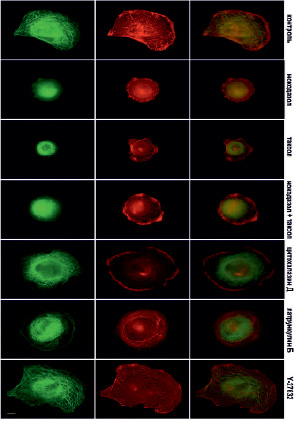
Рис. 6. Микротрубочки (зеленые) и актин (красный) через 60 мин после прикрепления клеток к субстрату в норме и при ингибировании цитоскелета. Масштабный отрезок – 10 мкм
Заключение
Выдвижение ламеллы в процессе распластывания осуществляется за счет полимеризации актина на активном краю. Наши данные показывают, что воздействие цитохалазина в низких дозах также замедляет процесс распластывания, способствует изменению морфологии клеток, но не влияет на форму кинетической кривой самого процесса. Похожий эффект проявляет воздействие другого ингибитора полимеризации актина – латрункулина Б. Таким образом, наши результаты укладываются в общие представления о функции актина в процессе распластывания.
Однако стоит отметить, что системы МТ и актинового цитоскелета тесно связаны между собой, поскольку при любом воздействии на систему МТ наблюдаются изменения в формировании актинового цитоскелета. Так, в случае полной разборки и подавлении динамической нестабильности МТ замедляется формирование стресс фибрилл. При этом полная стабилизация МТ приводит к формированию мощных стресс фибрилл. В то же время при неполном ингибировании полимеризации актина изменяется морфология системы МТ. Интересно, что при подавлении активности киназы ROCK, изменения затрагивают в большей степени актиновый цитоскелет, но также и систему МТ.
Таким образом, основную роль в процессе распластывания играют динамичные микротрубочки. Кроме того, важным фактором для правильного распластывания и поддержания морфологических характеристик МСК КРС является взаимодействие систем цитоскелета, а именно микротрубочек и актомиозинового комплекса.
Библиографическая ссылка
Ковалева А.В., Творогова А.В., Саидова А.А. МЕХАНИЗМЫ РАСПЛАСТЫВАНИЯ МЕЗЕНХИМАЛЬНЫХ СТВОЛОВЫХ КЛЕТОК КРУПНОГО РОГАТОГО СКОТА // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-1. С. 70-79;URL: https://applied-research.ru/ru/article/view?id=12524 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12524

