В последние десятилетия из-за обострившейся в мире проблемы множественной лекарственной устойчивости микроорганизмов очень актуальны исследования по разработке новых антимикробных средств, лишенных недостатков традиционных антибиотиков. В лечении и профилактике кишечных заболеваний в медицине и ветеринарии все чаще используются комплексные биопрепараты пробиотических бактерий, в том числе продуцентов антимикробных пептидов и протеолитических ферментов. Вместе с тем влияние продуктов биосинтеза пробиотиков на конкурентные отношения в микробиоценозе, на развитие резистентности у патогенов к антимикробным соединениям исследовано не в полной мере [1, 2].
Нами из окружающей среды были выделены новые штаммы Enterococcus и Bacillus, синтезирующие антимикробные бактериоциноподобные субстанции (BLIS) и другие биологически активные вещества [3, 4]. При этом антимикробные соединения штамма E. mundtii ингибируют рост некоторых грамположительных (Гр+) бактерий, а штамма B. lentus – в большей части грамотрицательных (Гр-) бактерий.
Создание композиции штаммов, обладающих способностью синтезировать антимикробные вещества, полезные метаболиты и ферменты, является важной научной и практической задачей на пути получения лечебно-профилактических препаратов пробиотической направленности.
Цель исследования: изучение характера и условий взаимодействия BLIS продуцируемых представителями энтерококков – E. mundtii и бацилл – B. lentus, взятых как по отдельности, так и в сочетании, в отношении тестовых бактериальных патогенов (Гр+) и (Гр-) природы.
Материалы и методы исследования
Объект исследования – штаммы E. mundtii В-7424, B. lentus В-7150, их метаболиты, обладающие антимикробной и протеолитической активностью, а также тестовые штаммы бактериальных патогенов – Listeria monocytogenes 766, Salmonella Enteritidis rif92 и Escherichia coli R3, полученные из Государственной коллекции патогенных микроорганизмов и клеточных культур «ГКПМ – Оболенск».
Пассирование штамма E. mundtii В-7424 осуществляли на питательном агаре (ГРМ-агар, ГНЦ ПМБ, Россия), на MRS-агаре (HiMedia, India) при температуре 36 °С в течение 24 ч. Глубинное культивирование штамма E. mundtii проводилось в 10 л ферментере BioFlo 110 (NBS, США) с 5,0 л питательной среды следующего состава (г/л): гидролизат казеина – 10,0; дрожжевой экстракт – 5,0; глюкоза – 20,0; натрия цитрат – 5,0; натрия хлорид – 5,0; магния сульфат – 0,5; калий фосфорнокислый 2-зам. – 1,0 (рН среды – 6,8 ед.). Выращивание осуществляли при температуре 36 °С с перемешиванием, аэрациией и рН-статированием (5,9–6,0 ед. рН) в течение 14–16 ч.
Пассирование штамма Bacillus lentus В-7150 осуществляли на питательном агаре (ГРМ-агар, ГНЦ ПМБ, Россия) и на Starch Agar (HiMedia, India) при температуре 29–30 °С в течение 36–48 ч. Глубинное культивирование штамма проводилось в 10 л ферментере BioFlo 110 (NBS, США) с 5,0 л питательной среды следующего состава (г/л): дрожжевой экстракт – 5,0; глюкоза – 1,5; аммоний виннокислый – 7,0; калий хлористый – 1,0, калий фосфорнокислый 2-зам. – 2,6; глицерин – 1,0; магний сернокислый – 0,1. рН среды 7,2. Выращивание проводили при температуре 29–30 °С в условиях интенсивной аэрации и перемешивания в течение 24–36 ч.
Выделение из культуральной жидкости (КЖ) фракции, ответственной за бактерицидную активность, производилось методом мембранной фильтрации на половолоконном картридже типа АР (Россия, Кириши) с отсечением по молекулярному весу в 100 кДа. Бесклеточные фильтраты смешивали с безводным дихлорметаном (ДХМ) в отношении 1:1. Смесь гомогенизировали при помощи миксера (700 об/мин, 5 мин) при комнатной температуре, полученную эмульсию разливали в металлические стаканы и центрифугировали (5000 об/мин, 10 мин) для разделения водной и гидрофобной фаз. Интерфазную пленку, формируемую на границе раздела фаз, извлекали из центрифужного стакана после удаления сначала верхней – водной фазы, а затем нижней фазы – ДХМ. Пленочную массу, включающую грубую BLIS, высушивали конвективно при температуре 60 °С, взвешивали и помещали в герметичный флакон для последующего использования.
Определение бактерицидной активности пленочной массы проводили с использованием свежеприготовленных газонов тест-штаммов путем титрования проб в серии двукратных разведений (спот-тест). Активность пленочной массы, обозначенной далее как фракция BLIS, выражали как АЕ/мл или АЕ/мг. Присутствие в пленочной массе антимикробных пептидов и их молекулярную массу определяли по результатам электрофореза в полиакриамидном геле (Tris-tricine SDS–PAGE, ПААГ) с использованием молекулярных маркеров (Page Ruler) и последующего биотестирования выявленных полос, состоящем в наслоении на ПААГ питательного агара с L. monocytogenes и E. coli [3, 4].
Наличие и активность протеаз, присутствующих в составе BLIS, оценивали по размерам зон гидролиза казеина, образующихся после нанесения проб на поверхность молочного агара с различными показателями рН (6-10). Специфичность протеаз и их классификация делались на основе рН-зависимости и чувствительности к ингибитору сериновых протеаз – фенилметилсульфонил фториду (PMSF, Sigma-Aldrich).
Для сравнения использован коммерческий препарат субтилизин (Carlsberg, Sigma-Aldrich) с концентрацией 1 мг/мл, протеолитическая активность которого была принята за 100 %. Опыты проведены на агаровой среде с казеином (1 %) в чашках Петри.
Статистическую обработку результатов проводили с использованием программного пакета BioStat v5 (Analyst Soft, США).
Результаты исследования и их обсуждение
Взаимоотношения штаммов E. mundtii и B. lentus были исследованы в опытах перекрестного антагонизма при совместном выращивании на плотной питательной среде ГРМ с дрожжевым экстрактом (рис. 1).
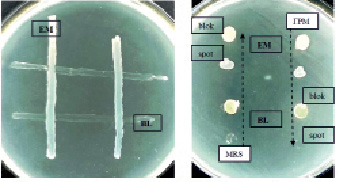
А) Б)
Рис. 1. Исследование взаимного антагонизма штаммов E. mundtii и B. lentus на ГРМ-агаре методами перпендикулярных штрихов (а) блоков и спотов (б). А – чашка засеяна двумя вертикальными штрихами штамма энтерококков (EM) и перпендикулярно им сделаны два штриха штамма бацилл (BL): учет результатов производился через 24 ч. Б – на свежий газон B. lentus нанесены блоки (bloks) и споты (spots) суточных культур E. mundtii (EM) и B. lentus (BL), выращенных на MRS-агаре (левая вертикаль) и на ГРМ-ДЭ агаре (правая вертикаль)
Штаммы E. mundtii и B. lentus, как следует из фотографий (рис. 1, а и б), не проявляют антагонизма в отношении друг друга независимо от того, были ли они выращены на простой (ГРМ), обогащенной (ГРМ-ДЭ) либо специальной (MRS) средах. Использование MRS среды для культивирования бактерий дает возможность вырабатывать клетками органические кислоты и перекись водорода, являющиеся известными природными антисептиками.
Для оценки уровня биосинтеза BLIS штаммы E. mundtii и B. lentus были выращены в ферментерах, затем пробы КЖ разделены центрифугированием или ультрафильтрацией на биомассу и бесклеточный ферментат. Из ферментата методом межфазного разделения с использованием ДХМ далее выделяли фракции BLIS. В полученных BLIS-EM и BLIS-BL уточняли молекулярные массы, оценивали противомикробную активность, выявляли присутствие протеаз, а также исследовали взаимное влияние компонентов BLIS в смешанных композициях.
При биотестировании ПААГ рост тестовых штаммов L. monocytogenes и E. coli отсутствовал вокруг полос с молекулярными массами 5–6 кДа и 4 кДа соответственно. При этом полоса на 5–6 кДа соответствует BLIS B. lentus, а на 4 кДа – BLIS E. mundtii, что полностью совпадает с данными полученными нами ранее [3, 4]. Характерно, что BLIS-EM подавлял рост только грамположительных листерий, а BLIS-BL – преимущественно грамотрицательных бактерий, в частности, E. сoli и Salmonella Enteritidis. Таким образом, было подтверждено, что исследованные штаммы E. mundtii и B. lentus являются продуцентами низкомолекулярных бактериоциноподобных пептидов.
Мы предположили, что отсутствие взаимного антагонизма бацилл и энтерококков могло быть связано с наличием в среде факторов, отвечающих за развитие резистентности к бактериоцинам. Таким фактором, учитывая пептидную природу исследуемых бактериоцинов, могли быть протеолитические ферменты в КЖ. В этой связи проведено изучение протеолитической активности фракций BLIS из бесклеточных супернатантов B. lentus и Е. mundtii с использованием 1 % казеина в составе агара.
Протеолизная активность исходных образцов BLIS оценивалась после термообработки (+80 °С, 30 мин) и после действия ингибитора PMSF. В качестве контроля использовали коммерческую протеазу – субтилизин (Sigma-Aldrich). Полученные результаты по гидролизу казеина с помощью сериновой протеазы B. lentus и субтилизина представлены на рис. 2. Во фракции BLIS-BL действительно присутствует протеаза, сходная по активности с коммерческим ферментом субтилизином (Sub). Активность протеазы из BLIS-BL, так же как и субтилизина, подавлялась под воздействием высокой температуры (80 °С) и в присутствии ингибитора сериновых протеаз – PMSF. Факт подавления протеолитической активности фракции BLIS-BL в результате обработки ингибитором PMSF и реакция на термообработку свидетельствуют о том, что фермент B. lentus с высокой долей вероятности является сериновой протеазой.
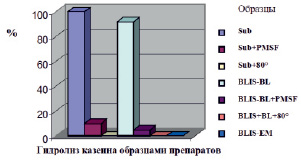
Рис. 2. Сравнение протеолитической активности фракций BLIS и коммерческой протеазы – субтилизина. Споты образцов препаратов в объеме 10 мкл наносили на чашку Петри с агаром, содержащим 1 % казеина, и после суточной инкубации при 30 °С определяли диаметры зон гидролиза; для субтилизина размер зоны гидролиза принимали за 100 %. Sub – субтилизин (1 мг/мл); Sub+PMSF – субтилизин, обработанный ингибитором PMSF; Sub+80 ° – термообработанный при 80 °C Sub; BLIS-BL – образец BLIS из B. lentus; BLIS-BL+PMSF – то же, обработанный ингибитором PMSF; BLIS+BL+80 ° – то же, термообработанный при 80 °C; BLIS-EM – образец BLIS из E. mundtii
Характеристика фракций BLIS, выделенных из Е. mundtii и B. lentus
|
Фракции BLIS из |
Устойчивость |
Спектры активности* |
Продукция секретируемой протеазы |
Действие химотрипсина (10 мг/мл) |
|
|
в зоне рН |
при нагреве |
||||
|
Е. mundtii |
2–10 |
до 100 °C |
Гр(+) |
нет |
разрушающее |
|
B. lentus |
2–10 |
до 100 °C |
Гр(-) |
есть |
не действует |
|
(*) против Гр(+) Listeria monocytogenes, Гр(-) E. coIi, Salmonella Enteritidis |
|||||
Одновременно было отмечено, что фракция BLIS-EM не способна осуществлять гидролиз казеина, следовательно, штамм Е. mundtii В-7424 не является продуцентом секретируемой протеазы, а производит бактериоцин, чувствительный к действию химотрипсина и действующий на (Гр+) бактерии. Основные функциональные свойства фракций BLIS, вырабатываемых штаммами B. lentus и Е. mundtii, представлены в таблице.
Далее были проведены опыты по изучению возможности протеолитического разрушения бактериоцина BLIS Е. mundtii в смеси фракций в условиях воздействия ингибитора PMSF и высокой температуры (80 °С). Для этого регидратированные сухие фракции BLIS-EM и BLIS-BL в концентрации 10 мг/мл по отдельности и в смеси (1:1) были разделены на четыре равные части. Все они были подвергнуты 60 минутному воздействию температуры и рН: +30 °С и +80 °С, рН 6 и рН 10 соответственно. Для оценки антимикробного действия обработанные пробы BLIS в объеме по 10 мкл наносили на поверхность свежезасеянного газона тестового штамма L. monocytogenes в чашке Петри, которые инкубировали при 37 °С в течение 20 ч.
Из представленных на рис. 3 данных, видно, что BLIS Е. mundtii дает четкую зону ингибирования (проба 1) L. monocytogenes, чего не наблюдается у BLIS B. lentus (проба 2); после смешивание образцов BLIS-EM и BLIS-BL из-за протеазы бацилл происходит полная потеря антилистериозной активности (проба 3); активность бактериоцина против Listeria остается, если к BLIS-EM добавляли прогретый (80 °С) BLIS-BL (проба 4) или проводили обработку PMSF (проба 5).
Известно, что устойчивость у бактерий к бактериоцинам, в отличие от антибиотиков, практически не развивается [5–7]. Однако еще в 1967 г. был установлен факт и природа резистентности некоторых видов Bacillus к низину – первому из недавно открытых бактериоцинов. Было определено, что устойчивость была обусловлена ферментом, названным «низиназой». При этом сам фермент не влиял на антибиотики пептидной природы – полимиксин, грамицидин или бацитрацин, но инактивировал лишь лантионин-содержащие бактериоцины – низин и субтилин.
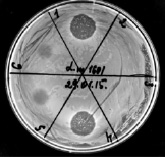
Рис. 3. Бактерицидная активность фракций BLIS-EM и BLIS-BL против Listeria monocytogenes. 1 – BLIS из E. mundtii; 2 – BLIS из B. lentus; 3 – BLIS-EM+BLIS-BL (1:1); 4 – BLIS-EM+BLIS-BL после прогрева при 80 °С; 5 – BLIS-EM+BLIS-BL после обработки PMSF; 6 – PMSF. Объемы проб BLIS – по 10 мкл
Таким образом, причиной инактивации бактериоцина Е. mundtii В-7424 в составе композиции является секретируемая протеаза B. lentus В-7150, которая может быть инактивирована нагреванием (80 °С) или добавлением PMSF.
Заключение
В работе показано свойство штамма B. lentus В-7150 вырабатывать сериновую протеазу, способную инактивировать бактериоцин штамма E. mundtii В-7424. Полученные результаты согласуются с ранее опубликованными данными, объясняющими причину устойчивости некоторых видов бактерий к антимикробным веществам. Кроме литического действия на низкомолекулярный пептид, из которого, собственно, и состоит бактериоцин E. mundtii, показаны и основные свойства сериновой протеазы B. lentus – ее разрушаемость при нагревании (80 °С), а также от воздействия специ- фического ингибитора – PMSF.
Полученные данные дают основание предполагать, что секретируемые протеазы бацилл могут выступать в роли факторов регулирования активности антимикробных пептидов в микробиоме.
Библиографическая ссылка
Перелыгин В.В., Похиленко В.Д., Левчук В.П., Калмантаев Т.А., Светоч Э.А. ПРОТЕАЗЫ КАК ВЕРОЯТНЫЕ ФАКТОРЫ РЕГУЛЯЦИИ КОНКУРЕНТНЫХ ОТНОШЕНИЙ СРЕДИ МИКРООРГАНИЗМОВ // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-1. С. 98-102;URL: https://applied-research.ru/ru/article/view?id=12529 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12529

