Исследования физико-химических свойств медно-аммиачно-аммонийных растворов, образующихся при экстрагировании оксида меди аммиачной водой, содержащей хлорид аммония, необходимы для создания основ технологии извлечения соединений меди из первичных промышленных отходов производства черных и цветных металлов, химии и нефтехимии, электронной промышленности и последующей переработки полученных электролитов на порошковую медь [1, 2]. Фундаментальные и прикладные исследования по комплексному решению вопросов утилизации вторичных руд, содержащих цветные металлы, актуальны вследствие возможности экономии первичного сырья и уменьшения экологической нагрузки на районы расположения добывающих и перерабатывающих предприятий отрасли.
На основании экспериментальных результатов, аналитических и графических расчетов определить оптимальные соотношения молей аммиака и хлорида аммония для экстремальных точек в условиях постоянства электродного потенциала и рН-раствора для выдачи исходных данных и проектирования узлов промышленного извлечения меди гидрометаллургическим способом из промышленных отходов (вторичных руд) и электролитической или гидролитической переработки полученных экстрактов.
Методом исследования является регистрация изменения потенциала электрода на границе с образуемым раствором в процессе массопереноса через границу раздела жидкой и твердой фаз при химическом растворении оксида меди (II). Метод исследования аналогичен изучению имманентных свойств тетрааммиакатов цинка [3] с естественным отличием в использовании оксида меди квалификации «ЧДА» по ГОСТ 16539-90. Концентрацию меди оценивали по сумме навесок, внесенных в раствор, и определяли фотоколориметрически [4].
Результаты исследования и их обсуждение
Для возможности сравнения результатов настоящей работы с упомянутой ранее [3] были приготовлены и использованы растворы с исходными концентрациями аммиака и хлорида аммония, приведенными выше. Максимальная концентрация оксида меди в водно-аммиачно-аммонийном растворе практически соответствовала растворимости тетрааммонийного комплекса.
В процессе массопереноса и химического растворения оксида меди (СCuO, моль/л) фиксировали изменение электродного потенциала и рН образующегося раствора. На основании полученных результатов установлено, что растворение сопровождается изменением электродного потенциала и концентрации ионов водорода, что представлено в виде графиков j = f( ), рН = f(
), рН = f( ) и уравнений для исходных растворов в 5 %-ной (рис. 1), в 10 %-ной (рис. 2), 15 %-ной (рис. 3) и 20 %-ной аммиачной воде (рис. 4), приведенных в табл. 1.
) и уравнений для исходных растворов в 5 %-ной (рис. 1), в 10 %-ной (рис. 2), 15 %-ной (рис. 3) и 20 %-ной аммиачной воде (рис. 4), приведенных в табл. 1.
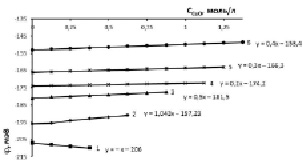
Рис. 1. Изменение электродного потенциала медно-аммиачно-аммонийного раствора с исходной концентрацией аммиака 5 % (3,014 моль/л) и хлорида аммония, моль/л: 1 – 0,935; 2 – 1,871; 3 – 2,806; 4 – 3,741; 5 – 4,677; 6 – 5,613 при растворении оксида меди
Таблица 1
Аппроксимация изменения рН при химическом растворении оксида меди
|
№ п/п |
Концентрация NH4Cl в растворе, моль/л |
рН при концентрации аммиака в растворе, % мас. (моль/л) |
|||
|
5 % (3,04) |
10 % (5,71) |
15 % (8,56) |
20 % (11,4) |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
|
2 |
0,935 |
10,41 + 0,0075х2 – 0,0252х |
10,54 + 0,01х |
10,65 + 0,01х |
10,65 + 0,01х |
|
3 |
1,871 |
10,27 + 0,0017х2 – 0,0252х |
10,43 + 0,008х |
10,39 + 0,0041х |
10,39 + 0,0041х |
|
4 |
2,806 |
10,01 + 0,0002х2 – 0,0082х |
10,19 – 0,01х |
10,11 + 0,0047х |
10,11 + 0,0047х |
|
5 |
3,741 |
9,91 – 0,0108х |
10,06 – 0,01х |
9,97 – 0,0098х |
9,97 – 0,0098х |
|
6 |
4,677 |
9,76 – 0,01х |
9,99 – 0,01х |
9,81 – 0,01х |
9,81 – 0,01х |
|
7 |
5,613 |
9,63 – 0,01х |
9,89 – 0,01х |
9,79 – 0,012х |
9,79 – 0,012х |
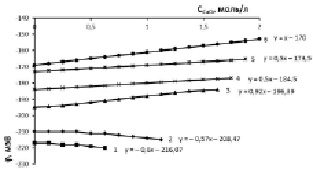
Рис. 2. Изменение электродного потенциала медно-аммиачно-аммонийного раствора с исходной концентрацией аммиака 10,1 % (5,71 моль/л) и хлорида аммония, моль/л: 1 – 0,935; 2 – 1,871; 3 – 2,806; 4 – 3,741; 5 – 4,677; 6 – 5,613 при растворении оксида меди
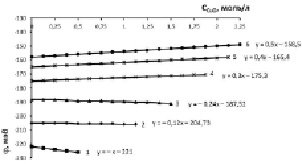
Рис. 3. Изменение электродного потенциала медно-аммиачно-аммонийного раствора с исходной концентрацией аммиака 15,2 % (8,56 моль/л) и хлорида аммония, моль/л: 1 – 0,935; 2 – 1,871; 3 – 2,806; 4 – 3,741; 5 – 4,677; 6 – 5,613 при растворении оксида меди
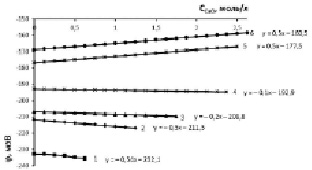
Рис. 4. Изменение электродного потенциала медно-аммиачно-аммонийного раствора с исходной концентрацией аммиака 20 % (11,4 моль/л) и хлорида аммония, моль/л: 1 – 0,935; 2 – 1,871; 3 – 2,806; 4 – 3,741; 5 – 4,677; 6 – 5,613 при растворении оксида меди
При химическом растворении оксида меди в 5 %-ном водно-аммиачном растворе (3,014 моль/л) при начальной концентрации хлорида аммония 0,935 моль/л (рис. 1, кривая 1) происходит постепенное увеличение отрицательной величины электродного потенциала и рост рН-раствора (табл. 1, строка 2, столбец 3). Растворение при увеличенной концентрации хлорида аммония в два и более раза приводит к уменьшению абсолютной величины электродного потенциала [j] и уменьшению рН-раствора. Следовательно, функции dj = f(CNH4Cl) и d(рН) = f(CNH4Cl) при СCuO = const имеют экстремум dj/d(CNH4Cl) = ±0 и d(рН)/d(CNH4Cl) = ±0, положение которого аналитически и графически определяется равным CNH4Cl = 1,565 моль/л. Уравнение графика изменения рН при постоянном количестве растворенного оксида меди, например 0,625 моль/л, соответствует выражению
y = – 0,4654ln(x) + К, (1)
в котором: х – концентрация хлорида аммония, а свободный член уравнения К представляет собой экспериментальное значение рН исходного аммонийно-аммиачного раствора, соответствующее определяемому по уравнению Гендерсона – Гассельбаха [5]. Выражение, в общем виде характеризующее изменение рН раствора в процессе образования тетрааммиаката меди, записывается следующим образом:
рН = рКН2О – рКNH4OH + lg(СNH4OH/CNH4Cl) +
+ K1ix2 + K2ix, (2)
где КН2О – ионное произведение воды 1∙10-14; КNH4OH – константа диссоциации гидрата аммиака, равная 1,76∙10-5 при 293 К; СNH4OH – концентрация гидрата аммиака, моль/л; CNH4Cl – концентрация хлорида аммония, моль/л, x – концентрация оксида меди, моль/л. Приведенное уравнение пригодно для концентраций хлорида аммония от 0,935 до 2,806 моль/л при концентрации аммиака 5 %. Для данного аммиачного раствора повышение мольной концентрации хлорида аммония выше 2,806 упрощает уравнение, описывающее изменение рН в процессе образования тетрааммиаката:
рН = рКН2О – рКNH4OH +
+ lg(СNH4OH/CNH4Cl) + K2ix. (3)
Вид уравнений и значения коэффициентов К1 и К2 приведены в табл. 1.
Увеличение исходной концентрации аммиака в 2 раза (рис. 2) приводит к увеличению исходной отрицательной величины электродного потенциала и росту рН-раствора, вызывает увеличение растворимости оксида меди в процессе образования медно-аммиачно-аммонийного раствора (МААР) в области концентраций хлорида аммония 0,935–1,871 моль/л. Такой характер протекающих процессов обусловлен увеличением доли несвязанного аммиака.
Для серии опытов с исходной концентрацией аммиака 10,1 % (5,71 моль/л) экстремум функции dj/d(CCuO) = f(CNH4Cl) лежит в области 1,871÷2,806 моль/л NH4Cl. Координаты экстремума CNH4Cl = 2,34 моль/л. Для серии опытов с исходной концентрацией аммиака 15,2 % (8,56 моль/л) координаты экстремума 3,39 моль/л NH4Cl, а для раствора с концентрацией аммиака 20 % (11,4 моль/л) экстремальная точка имеет координату 4,209 моль/л NH4Cl.
Концентрация аммиака 15,2 % в исходном водно-аммиачном растворе (рис. 3) приводит к увеличению потенциала до 220 мВ и рН до 10,65 при концентрации хлорида аммония 0,935 моль/л. Одновременно возрастает растворимость оксида меди, т.е. движущая сила процесса растворения, при котором рост отрицательной величины потенциала наблюдается в области 0,935–2,806 моль/л хлорида аммония, соответственно, растет рН-МААР (табл. 1, столбец 3, строки 1, 2, 3). Для 20 %-ного раствора (рис. 4) аналогичный рост отрицательной величины потенциала проявляется в диапазоне 0,935–3,741 моль/л хлорида аммония.
Из приведенных рисунков и табл. 1 следует, что кратное увеличение исходной концентрации аммиака и хлорида аммония вызывает рост растворимости оксида меди, определяет при этом соответствующее изменение j, мВ и рН. рН тетрааммиакатного раствора меди с ее соответствующим растворимости содержанием, определяется из уравнения
j = j5 % + К·СCuO, (4)
рН = рН5 % – К·СCuO, (5)
где рН5 % – значение рН раствора, определенное из уравнения (2); К – коэффициент пропорциональности, характеризующий влияние растворяемого оксида меди на кислотность среды. Пользуясь уравнениями (4) и (5), можно определить j и рН раствора, образованного аммиаком и хлоридом аммония с промежуточными концентрациями и концентрациями, превышающими верхний предел изученного интервала концентраций аммиака. Так, значение рН раствора, полученного при растворении оксида меди в 25 %-ной аммиачной воде, содержащей 4,677 молей хлорида аммония, при растворимости оксида меди 2,6 моль/л составит 9,95, а j = –219,83 мВ. Изменение рН раствора в процессе комплексообразования соответствует расходу реагентов по уравнению
CuO + 2 NH4OH + 2 NH4Cl →
[Cu(NH3)4]Cl2 + 3 H2O. (6)
Для экстремальных точек соотношение молей NH3 и NH4Cl приведено в табл. 2, из которой следует, что для поддержания постоянного потенциала и рН раствора в процессе растворения оксида меди целесообразно поддерживать отношение молей аммиака к хлориду аммония больше двух, увеличивая это отношение в области повышенных концентраций аммиака.
Таблица 2
Соотношение молей NH3 и NH4Cl в условиях постоянства j, мВ и рН
|
Концентрация NH3, моль/л |
3,014 (5 %) |
5,71 (10 %) |
8,56 (15 %) |
11,4 (20 %) |
|
Концентрация NH4Cl в экстремальной точке, моль/л |
11,565 |
2,34 |
3,39 |
4,21 |
|
NH3/NH4Cl |
1,93 |
2,44 |
2,53 |
2,71 |
Проведенные расчеты свидетельствуют, что оптимальные соотношения между аммиаком и хлоридом аммония в процессе растворения не сохраняются. В результате растворения количество несвязанного хлорида аммония уменьшается и система становится значительно ненасыщенной аммонийной солью. Привести систему в состояние равновесия можно путем введения дополнительных количеств хлорида аммония, что вновь будет способствовать растворению оксида меди до тех пор, пока в системе не наступит равновесие между тетрааммиакатом и хлоридом аммония. Поддержание оптимального соотношения количества аммиака и хлорида аммония в процессе растворения [NH3]:[NH4Cl] = 2:1 может быть осуществлено компенсацией израсходованного на образование тетрааммиаката хлорида аммония (рис. 5).
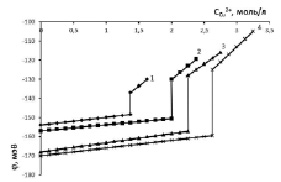
Рис. 5. Потенциал медно-аммиачно-аммонийного раствора с исходной концентрацией аммиака, моль/л: 1 – 3,01; 2 – 5,83; 3 – 10,84; 4 – 12,52; хлорида аммония – 5,44 моль/л
В результате восполнения хлорида аммония и установления физического равновесия между тетрааммиакатом меди и хлоридом аммония растворимость тетрааммиаката достигла 214,25 г/л (3,37 моль/л) в пересчете на Cu2+. Общее содержание хлорида аммония в растворе возросло до 328 г/л Cl-. Из графической зависимости j = f(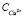 ) видно, что добавление в растворы хлорида аммония привело к резкому увеличению потенциала. Дальнейшее насыщение растворов оксидом меди также приводит к повышению j вследствие уменьшения доли несвязанного аммиака. Рис. 5 свидетельствует о положительном влиянии компенсации израсходованного хлорида аммония на образование комплексного соединения меди. Таким образом, при поддержании соотношения [NH3]:[NH4Cl] = 2:1 можно достичь растворимости оксида меди более 3,3 моль/л (рис. 5, кривая 4) для концентрированного водно-аммиачного раствора 12,52 моль/л. Дальнейшее увеличение растворимости оксида меди возможно при восстановлении соотношения [NH3]:[NH4Cl], равного экстремальным значениям табл. 2.
) видно, что добавление в растворы хлорида аммония привело к резкому увеличению потенциала. Дальнейшее насыщение растворов оксидом меди также приводит к повышению j вследствие уменьшения доли несвязанного аммиака. Рис. 5 свидетельствует о положительном влиянии компенсации израсходованного хлорида аммония на образование комплексного соединения меди. Таким образом, при поддержании соотношения [NH3]:[NH4Cl] = 2:1 можно достичь растворимости оксида меди более 3,3 моль/л (рис. 5, кривая 4) для концентрированного водно-аммиачного раствора 12,52 моль/л. Дальнейшее увеличение растворимости оксида меди возможно при восстановлении соотношения [NH3]:[NH4Cl], равного экстремальным значениям табл. 2.
Выводы
1. Определены электродный потенциал и рН растворов медно-аммиачно-аммонийных комплексов в аммиачной воде, содержащей хлорид аммония.
2. Установлено наличие экстремальных точек, имманентных для исходных концентраций аммиака и хлорида аммония при химическом растворении оксида меди на изменение электродного потенциала и рН среды. Установлены оптимальное соотношение между аммиаком и хлоридом аммония, обеспечивающее постоянство потенциала и рН раствора, и дискретный характер изменения электродного потенциала и рН раствора при введении компенсирующих добавок хлорида аммония, а также.
3. Поддержание оптимального соотношения целесообразно осуществлять компенсацией израсходованного иона аммония, это позволяет увеличить растворимость на 30–40 % и увеличивает движущую силу процесса экстрагирования соединений меди из промышленных отходов и первичных руд.
Библиографическая ссылка
Перетрутов А.А., Петровский А.М., Чубенко М.Н., Ким П.П., Калачев Н.А., Литова Т.В. ИММАНЕНТНЫЕ СВОЙСТВА АММИАЧНО-АММОНИЙНЫХ ВОДНЫХ РАСТВОРОВ АММИАКАТОВ МЕДИ // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-2. С. 219-224;URL: https://applied-research.ru/ru/article/view?id=12549 (дата обращения: 09.02.2026).

