К настоящему времени отмечаются прогрессирующие и практически непрерывно рецидивирующие заболевания пародонта, которые обусловлены отсутствием единой концепции этиологии, патогенеза, диагностики и лечения воспалительного процесса, распространенностью [1, 2]. В основе болезней пародонта лежит воспалительный процесс от острой с переходом в хроническую фазу [3, 4]. Считается, что микробный фактор является определяющим в развитии воспалительных процессов в пародонте. Их внедрение в ткани вызывают развитие аутоиммунных реакций или иммунодефицитных состояний, приводящее к сдвигам в синтезе белков [5–7] и при отсутствии лечения острая фаза воспалительного процесса сменяется на хронический период заболевания [8].
Клинико-экспериментальные исследования и анализ литературных данных констатируют представления о том, что основным моментом воспалительно-деструктивных процессов является чрезмерная активация полиморфноядерных лейкоцитов (ПМЯЛ) в очагах поражения пародонта [9, 10], которые индуцируют развитие в тканях гипоксического состояния, обуславливающие глубокие патологические изменения с последующей элиминацией зубов [6]. В связи с появлением деструктивно-воспалительных проявлений для лечения пародонтита на фоне иммунной недостаточности стоит необходимость использования иммунологической коррекции [3]. Имеются клинико-экспериментальные исследования, направленные на патогенетические разработки и применения разнообразных категорий иммуномодуляторов и их комбинаций [5, 11, 12].
Имеется целый ряд лечебных препаратов, имеющих широкий спектр иммуномодулирующих и иммуностимулирующих свойств. К последним относится отечественный препарат «Азоксимера бромид». Спектр действия препарата, в отличие от других иммуномодуляторов, наряду с иммуностимулирующим и детоксирующим эффектом, способен увеличивать иммунную резистентность организма.
Энергетическая способность ПМЯЛ регулируется ферментами, которые являются маркерами аккумуляции и локальной дегрануляции ПМЯЛ, активность или пассивность которых в отношении «Азоксимера бромида» остаются открытыми. Требуется дальнейшее исследование влияния препарата на накопление в пораженных тканях ПМЯЛ [10].
Цель исследования: проведение сравнительного анализа применения препарата «Азоксимера бромид» при лечении пародонтита на фоне иммунодефицитных состояний в различные сроки динамического наблюдения.
Материалы и методы исследования
98 человек с пародонтитом легкой и средней тяжести в возрастном диапазоне от семнадцати до пятидесяти пяти лет. Больные были поделены на 2 группы. 1-я группа – лица с пародонтитом легкой степени тяжести (ПЛСТ) (48 человек). 2-я группа – больные с пародонтитом средней степени тяжести (ПССТ) (50 человек). Обе группы были разделены на 2 подгруппы. Пациенты 1-й подгруппы составили ПЛСТ (23 человека) и ПССТ (22 человека), лечение которым ограничивалось традиционной медикаментозной терапией (ТМТ) с применением препарата «Метрогил-Дента». 2-й подгруппе соответственно ПЛСТ (25 пациентов) и ПССТ (28 пациентов) на фоне ТМТ инъецировали внутримышечно в течение 20 дней через день препарат «Азоксимера бромид» по 6,0 мг, что в суммарной дозе составило 60 мг. 40 пациентов образовали контрольную группу с интактной зубо-челюстной системой, которые служили фоном на предмет выявления исходной функциональной активности нейтрофилов. Состояние тканей пародонта до и после лечения оценивали на основе следующих индексов: индекс ONI-S по Russel и РМА в модификации Parma, индекс SBI. Глубина деструкции тканей пародонта оценивалась методом зондирования в 6-ти точках каждого зуба. Проводилась рентгенографическое исследование отдельных зубов и при необходимости челюстных костей. Для исследования осуществляли забор крови микрошприцем из пародонтальных карманов или десневых сосочков у всех пациентов с их согласия. Содержание катионных белков (КБ) осуществляли по В.Е. Пигаревскому, миелопероксидазу (МПО) по Р. Лилли, щелочную фосфатазу (ЩФ) по L.S. Kaplow, кислую фосфатазу (КФ) и сукцинатдегидрогеназу (СДГ) по Р.П. Нарциссову.
Применялась вариационная статистика по И.А. Ойвину, средний цитохимический коэффициент (СЦК), средние величины (М) и их ошибки (m), среднее квадратическое отклонение (ϭ), достоверные отличия критерия t Стьюдента (Р не более 0,05). Обработка проведена на компьютере фирмы Intel Pentium 4.
Результаты исследования и их обсуждение
Рассмотрение результатов исследования показало, что пациенты на фоне ТМТ, несмотря на соблюдение гигиены полости рта, отмечали в дальнейшем ухудшение пародонтологического статуса. Удовлетворительное состояние гигиены полости рта отмечалось в течение 30 суток после терапевтических мероприятий. В дальнейшем наблюдалось увеличение показателей, которое приводили к ухудшению индивидуальной гигиены.
При оценке динамики индексов SBI и РМА также отмечались в ближайшие сроки после окончания лечебных мероприятий усиление воспалительного процесса с сохранением показателя глубины деструкции пародонтальных тканей практически на весь период наблюдения. Оставались на среднем уровне показатели индекса гигиены в течение от 3 месяцев до 1 года наблюдения.
У пациентов, которым на фоне профессиональной гигиены применялся азоксимера бромид, отмечался положительный ход лечения, параллельное снижение пародонтальных индексов, цифровые значения постепенно умеренно увеличивались. Пародонтальные индексы к концу наблюдения увеличивались, особенно у пациентов с пародонтитом средней степени тяжести.
В процессе динамического наблюдения цитохимические результаты были разными у пациентов с ПЛСТ и ПССТ. На 20 сутки у пациентов первой группы 1-й и 2-й подгруппы содержание и активность КФ, СДГ, КБ превышали средние значения нормы и фоновой активности. Усиление активности КБ и КФ отражается на состояние воспалительной реакции. Во второй подгруппе уменьшение активности МПО, возможно, выглядит как задержка выхода энзима из красного костного мозга, компенсируется на весь период наблюдения высоким подъемом СДГ и ЩФ (рис. 1, 2). К 30 суткам после лечения у пациентов 1-й группы 2-й подгруппы отмечалось максимальное увеличение содержания КБ (2,02 ± 0,06; р < 0,05) с постепенным снижением (1,69 ± 0,10; р < 0,1) к концу наблюдения (рис. 2).
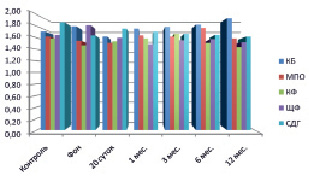
Рис. 1. Динамическое исследование активности ферментов у пациентов 1-й группы 1-й подгруппы
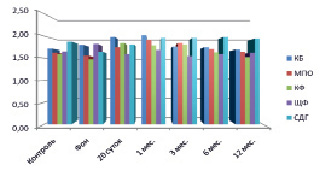
Рис. 2. Динамическое исследование активности ферментов у пациентов 1-й группы 2-й подгруппы
Повышение активности МПО и КФ, а также снижение активности ЩФ отмечалось у пациентов 2-й группы с последующей нормализацией к исходному уровню (р < 0,1). Функциональная пластичность высокоспециализированных клеток рассматривается при высокой активности МПО и КФ и повышении КБ [8], препарат действовал на гранулоцитарную систему нейтрофильных лейкоцитов [12]. Положительное действие препарата подтверждается достоверной статистической динамикой активности ЩФ и КБ к 12 месяцам исследования, что свидетельствует об уменьшении воспалительных процессов (р < 0,05) (рис. 3, 4).
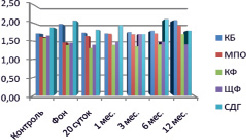
Рис. 3. Динамическое исследование активности ферментов у пациентов 2-й группы 1-й подгруппы
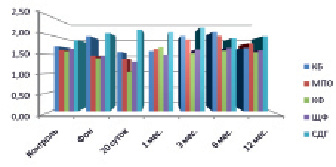
Рис. 4. Динамическое исследование активности ферментов у пациентов 2-й группы 2-й подгруппы
Синхронное увеличение активности КФ, МПО у пациентов 2-й группы в сравнении с 1-й связано с более агрессивным внутриклеточным уничтожением бактерий нейтрофилами и подтверждается повышением содержания КБ. У больных 2-й группы 1-й подгруппы для МПО и КФ выявлена одинаковая динамика активности, что нехарактерно для пациентов 1-й группы, обеспечивающая увеличение функции фагоцитарного аппарата, направленной на уничтожение микробных ассоциаций. КБ в течение всего наблюдения не изменялись, приближаясь к показателям контрольных цифр (р > 0,1) и фоновой патологии. Щелочная фосфатаза на протяжении всего периода исследования имела активность характерной для альтернативной фазы воспаления.
В структуре популяции клеток для СДГ на фоне снижения активности фермента отмечалось нарушение клеточного баланса. К концу наблюдения (12 месяцев после лечения) средняя активность фермента мало отличалась от нормальных значений (р > 0,1). Различия, в сравнении с цифровыми показателями фоновой активности, были достоверны (р < 0,05).
Активность СДГ была в пределах нормы даже через шесть, двенадцать месяцев в динамике лечения. У пациентов с ПССТ исходные показатели ЩФ и КБ отличались от результатов цифровых показателей больных с интактным пародонтом (р > 0,05). Значения КФ и МПО были значительно ниже контрольных величин (соответственно 1,46 ± 0,09 и 1,39 ± 0,09).
По окончанию лечения у больных 2-й группы, 2-й подгруппы отмечалось снижение содержания активности КБ и ЩФ в течение 30 дней от начала терапевтических мероприятий с повышением КБ к 3-му и 6–му месяцам, повышение МПО и КФ (1,98 ± 0,12 и 1,60 ± 0,05 соответственно, р < 0,05), ЩФ в течение всего периода лечения, превышающих показатели фоновой патологии.
Увеличение КФ, КБ, МПО связано с воздействием препарата на выброс из красного костного мозга биологически активных веществ ПМЯЛ. К 6-му месяцу из-за иммуномодулирующего действия препарата наблюдается высокая активность бактерицидных систем гранулоцитов в результате повышения фагоцитарной активности нейтрофилов, изменяется структурно-функциональная организация ферментов. Через 3 и 6 месяцев у пациентов отмечалось повышение содержания КБ и к концу лечения нормализация ЩФ и КФ (1,61 ± 0,10 и 1,56 ± 0,10), а также высокие цифровые значения для СДГ, в сравнении с пациентами с ПЛСТ. Увеличение средней активности СДГ нередко сопровождалось пониженной активностью и дефицитом резерва клеток с типичной активностью. При декомпенсации и истощении резервного запаса клеток с типичной активностью наблюдалось повышение СДГ. Средняя активность КФ, ЩФ и МПО, приближающаяся к контрольным показателям, нивелировала ферментативную активность гранулярного аппарата структурных образований пародонта после наблюдения, приводила к повышению сбалансированной СДГ. После окончания наблюдения сохранялась на отметке верхней границы нормы (1,80 ± 0,11).
Снижение активности СДГ может обуславливать нормализацию обменных процессов за счет нарушения тканевой биоэнергетики и истощения резервного запаса клеток [8]. Нарушение окислительно-восстановительных процессов на фоне ацидоза и гипоксии характерно для больных первой группы, что не присуще пациентам второй группы. Общесоматическая патология может изменять иммуноцитохимические реакции и тем самым спровоцировать прогрессирование патологического процесса у отдельных больных [9].
К году наблюдения отмечалось увеличение МПО и КБ с незначительным повышением контрольных цифр (р > 0,1) на фоне уменьшения ЩФ и КФ. Уменьшение ЩФ в динамике наблюдения указывает на снижение концентрации иммунокомпетентных клеток, что является основой патогенеза пародонтита.
Заключение
Анализируемый цитохимический состав ферментов крови указывает на положительное влияние препарата на динамику пародонтологического лечения, а также показателей местной неспецифической защиты. В стадии обострившегося пародонтита отмечается выброс высоких концентраций провоспалительных соединений, что, по- видимому, способствует выделению противовоспалительных интерлейкинов. Скорость их секреции, конвертация в крови увеличивается на фоне уменьшения медиаторов воспаления. Развивается компенсаторный противовоспалительный ответ, сочетающийся с повышением фагоцитарной активности иммунокомпетентных клеток, что способствует усилению клинической эффективности ТМТ у пациентов пародонтитом на фоне иммунного дефицита.
Библиографическая ссылка
Майборода Ю.Н., Хорев О.Ю., Безроднова С.М., Белая Е.А. ЦИТОХИМИЧЕСКИЕ АСПЕКТЫ ПРИМЕНЕНИЯ «АЗОКСИМЕРА БРОМИДА» В КОМПЛЕКСНОМ ЛЕЧЕНИИ ХРОНИЧЕСКОГО ПАРОДОНТИТА // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-2. С. 246-250;URL: https://applied-research.ru/ru/article/view?id=12554 (дата обращения: 05.01.2026).

