Болезни системы мозгового кровообращения являются проблемой особой медицинской и социальной значимости, по уровню фактически соответствующей эпидемии в мировом масштабе [1]. В общей структуре заболеваний нервной системы, нарушения мозговой гемодинамики составляют от 15 до 24,6 %, занимая второе место после ишемической болезни сердца по смертности в России. Учитывая демографическое старение населения, рост факторов риска и распространенности проблем кровообращения мозга, по данным Всемирной Организации Здравоохранения, прогнозируется увеличение количества пациентов с нарушениями церебрального кровообращения.
Применяемые в практическом здравоохранении препараты для больных с ОНМК отличаются дороговизной и большим перечнем противопоказаний [2]. При этом hydrogen peroxide, уже известный своими положительными свойствами нейропротекции и широко применяемый в других странах для лечения ОНМК, в России на современном этапе не исследован в качестве возможного аналога и альтернативного средства дорогим нейропротекторным препаратам [3–5].
Токсикокинетика и токсикодинамика hydrogen peroxide практически не изучена [6, 7]. Наличие немногочисленных положительных результатов по воздействию препарата в условиях ишемии лабораторных животных (мышей) и птиц, а также на клеточные культуры нейроцитов говорят о реальных возможностях использования hydrogen peroxide в условиях клиники. Это послужило основанием для выбора нами именно этого направления исследований в изучении нейропротекторной роли hydrogen peroxide на модели лабораторных беспородных крыс.
Цель исследования: выявить нейропротекторное воздействие hydrogen peroxide на нейроны мозга в эксперименте на модели крысы в условиях ишемии.
Задачами исследования явилось проведение анализа реакции нейронов сенсорной и моторной коры на воздействие hydrogen peroxide при ишемии головного мозга крысы.
Материалы и методы исследования
Патоморфологические исследования проведены с учётом приказа Минздравмедпрома РФ от 29.04.94 № 82 «О порядке проведения патологоанатомических вскрытий». Исследование было выполнено для получения оценки церебропротекторной активности hydrogen peroxide. Ишемия головного мозга была вызвана у 10 самцов беспородных белых крыс временной двусторонней окклюзией внутренней сонной артерии (BCAO) в течение 30 мин. Животные были разделены на 3 группы: 1 крыса служила контролем, в 3-х экспериментальных группах по 3 крысы в каждой производили ишемию с последующим применением hydrogen peroxide и физраствора для сравнения и анализа результатов применения hydrogen peroxide. В одной из экспериментальных групп проводилось введение 3 мг/кг hydrogen peroxide в течение 10 дней до экспериментов и после ВСАО.
Группа I: энтерально вводили физраствор (10 мл/кг), без индукции ишемии (контроль).
Группа II: вводили физраствор (10 мл/кг), с последующей двусторонней окклюзией внутренней сонной артерии (BCAO) в течение 30 мин, затем 10 дней энтерально вводили препарат hydrogen peroxide;
Группа III: Производили окклюзию BCAO в течение 30 мин и затем 10 суток энтерально применяли hydrogen peroxide в дозе 10 мл р-ра на 1 кг веса при разведении 1 т .в 250 мл дистиллированной воды (стандарт);
Группа IV: энтерально вводили hydrogen peroxide (3 мг/кг/день) в течение 10 дней, производили BCAO в течение 30 мин и затем 10 суток энтерально применяли hydrogen peroxide (стандарт).
Перед проведением эксперимента с BCAO крысам был произведён наркоз с тиопенталом натрия (40 мг/кг) на хирургической платформе со стороны спинки; на вентральной поверхности по срединной линии был сделан надрез в области шеи для обнажения трахеи животного; после этого, каждая из общих сонных артерий была тщательно изолирована от смежного блуждающего нерва. Хлопчатобумажную нить продели под каждую сонную артерию и закрепили хирургический узел на обе артерии для 30 минутной индукции ишемии. После 30-минутной ишемии ВСА были освобождены от узлов для восстановления кровотока через сонные артерии (реперфузия) в течение 4 с. Температуру тела крыс сохраняли около 37 °С ± 5 °C в течение всего хирургического вмешательства с помощью хирургической платформы с автоматическим подогревом. Контрольные животные получали те же хирургические процедуры, за исключением BCAO. После завершения реперфузионного периода, мозги вырезали под наркозом для определения в ткани морфологических показателей гистопатологии, и получения сравнительной оценки размера инфаркта головного мозга и пластичности ткани мозга крыс в IV экспериментальной группе относительно I, II и III группы.
В исследовании применен классический гистологический метод окрашивания гематоксилином и эозином, позволяющий получить как общую морфологическую картину нейронов двигательной и сенсорной коры, так и выявить пластичность структур мозга с анализом функционирующих сосудов микроциркуляторного русла мозга. Для анализа материала и изготовления иллюстративного материала использован микроскоп Olympus – Bx82 с цифровой камерой CDх82 с фирменным программным обеспечением.
Результаты исследования и их обсуждение
Структура коры в группе контроля соответствует морфологической картине мозга, описанной другими исследователями (рис. 1).
В экспериментальной группе, получавшей физиологический раствор, было установлено, что в части нейронов в области экспериментальной острой ишемии и развившегося инфаркта мозга формируется светлоокрашенное окружающее ядро пространство, свидетельствующее о вступлении клеток в апоптоз (рис. 2). Идентифицируются апоптозирующие не только нервные клетки, но и нейроглия. Как результат апоптоза, индуцированного ишемией, в поле зрения выявляются апоптические тельца. Анализ структуры ядер в корковых нейронах показал различный уровень дезорганизации хроматина, разрушение кариолеммы, дегенерацию и гибель нейронов. В части нейронов ядра не идентифицируются, отмечено расширение венозных сосудов (рис. 2).
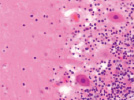
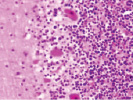
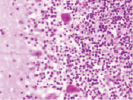
а) б) в)
Рис. 1. Контроль. А, б, в – двигательная кора. Микрофото. Окраска. гематоксилином и эозином. Ув. х100
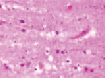

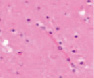
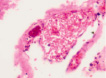
а) б) в) г)
Рис. 2. Нервные клетки двигательной коры в условиях экспериментального ишемического инсульта. а – апоптические клетки; б – нейроны с гранулами. Апоптоз и расширенные капилляры; в – капилляр, г – вена мозга крыс после ишемии. Окраска. гематоксилином и эозином. Микрофото. Ув. х100
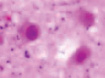
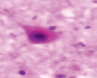
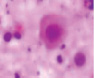

а) б) в) г)
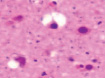
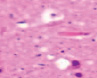
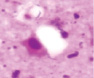
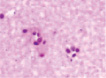
д) е) ж) з)
Рис. 3. а–г – кора головного мозга интактных крыс; д–з – кора головного мозга экспериментальных крыс. Микрофото. Окраска гематоксилином и эозином. Ув. х100
Сенсорная кора группы контроля характеризуется крупными нейронами с базофильными ядрами круглой и овальной формы (рис. 3, а–г). В группах эксперимента ВСАО сопровождается апоптозом нейронов и нейроглии (рис. 3, д–з).
Нами отмечено, что часть кровеносных сосудов крыс групп II и III имела в просвете сосудов лейкоциты и эритроциты (рис. 4, а), в группе II наблюдалась гипертрофия и гибель эндотелия (рис. 4, б), идентифицировались расширенные капилляры в зоне артерио-венулярных анастомозов (рис. 4, в), артериолы имели буллёзные выпячивания стенки (рис. 4, г, д), гипертрофированный эндотелий (рис. 4, е, ж).
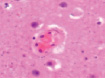
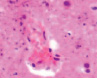
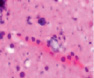
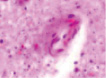
а) б) в) г)
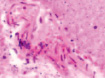
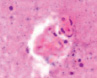
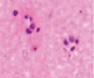
д) е) ж)
Рис. 4. Кровеносные сосуды головного мозга крыс в условиях острой ишемии. Микрофото. Окраска гематоксилином и эозином. Ув. х100. а) в просвете сосудов лейкоциты и эритроциты; б) гипертрофия и гибель эндотелия в группе II; в) расширенные капилляры в зоне артерио-венулярных анастомозов; г, д) артериолы с буллёзными выпячиваниями стенки; е, ж) гипертрофированный эндотелий
Нами отмечено, что степень повреждения нервной ткани в группе контроля, а также в группах, получавших гидрогена пероксид до и после ВСАО, имеет статистически достоверные отличия, свидетельствующие о том, что применение hydrogen peroxide оказывает нейропротекторное действие. При этом более выраженная защита нейронов при применении hydrogen peroxide отмечена при введении препарата до и после ВСАО (таблица).
Анализ результатов повреждения нейронов в группах контроля и эксперимента
|
№ группы |
I |
II |
III |
IV |
|
Структуры в поле зрения |
||||
|
Нейроны |
2 |
2 |
4 |
6 |
|
Нейроглия |
3 |
3 |
7 |
9 |
|
Расширены или закупорены сосуды |
4 |
4 |
2 |
1 |
|
Гипертрофия эндотелия |
100 % |
100 % |
50 % |
40 % |
|
Апоптоз |
5 |
5 |
3 |
2 |
Примечание. *P < 0,05.
Таким образом, анализ количественных данных показывает, что hydrogen peroxide оказывает не только нейропротекторный эффект, но и сосудосберегающий в сравнении с группой контроля от 20 до 60 %, что позволяет предположить, что препарат проявляет защитное действие за счет антиоксидантного эффекта и уменьшения митохондриальной дисфункции в ишемизированных нейронах мозга крыс. Это требует дальнейшей более глубокой расшифровки механизмов нейропротекции для использования гидрогена пероксида в качестве альтрнативного антиишемического препарата, как для лечения, так и профилактики инсультов. Механизм нейропротекторного действия hydrogen peroxide может быть рассмотрен с точки зрения биохимических каскадов, возникающих при ишемии, и химических свойств препарата [8–10]. Ишемия, возникшая вследствие ВСАО, обуславливает кислородное голодание клеток всех отделов ЦНС. В результате критического снижения гемоперфузии наступает ишемическое повреждение [11]. Закономерности развития ишемического повреждения мозга объясняются чувствительностью нейронов к недостатку кровоснабжения («дисгемический этап»), активацией метаболических реакций клеточных элементов нервной системы в условиях дегенерации (этапы «глутамат-кальциевого каскада»). Отмечено, что повреждение гематоэнцефалического барьера в условиях ишемии имеет характерные признаки, связанные не только с апоптозом нейроглии, но и эндотелия стенки кровеносных сосудов.
Приобретаемая нейроглией, окружающей нейроны, яркая ядерная базофилия является следствием апоптических изменений. Подобные изменения могут проявляться не только в условиях ишемии мозга, но и быть следствием других нарушений клеточного дыхания и при гипогликемии. Морфологические изменения клеток характерны для хронической недостаточности кислорода, характеризуются специфической гистологической картиной, отражающей патологию в системе передачи кислорода клеткам гемоглобином.
Некоторыми авторами были отмечены включения элементов металлов в нейронах корковых формаций пациентов, страдающих нейродегенеративными заболеваниями [12]. Авторы провели эксперименты с применением воздействия на клетки Н2О2 и Ар-42 пептида в его олигомерной форме. Было установлено, что второй вариант терапии вызывает повышение содержания маркеров окислительного стресса, окисленных белков и липидов, а также нарушений в структуре ДНК. Клетки в условиях применения Н2О2, характеризовались повышенным уровнем Zn и более низким содержанием ядерного Са в сравнении с контролем без каких-либо окислительных обработок. Нейроны и глия, обработанные с A – 42 пептида в олигомерной форме имеют повышенный уровень ядерных Mg, Ca, Fe и Zn в сравнении с контролем. Данные показали, что механизм влияния Н2О2 на поток металлов в клеточных структурах отличается от механизмов воздействия других препаратов, применяемых в современном лечении нейродегенеративных заболеваний.
В связи с ключевой ролью нейроглии в гематоэнцефалической защите мозга от нейротоксических воздействий, в том числе в условиях окислительного стресса, S. Singh с соавторами (2017) в качестве перспективного нейропротекторного терапевтические средства, повышающего функциональную активность астроцитов путем усиления функции митохондрий предложен H2O2 [13]. Авторы изучили влияние hydrogen peroxide, прототипичную активной форме О2, аффилированного с воспалительной реакцией, на концентрацию С-реактивного белка (СРБ). Результаты исследования показали, hydrogen peroxide может быть использован в качестве биологического модификатора функции и структуры СРБ. J. Zhao с соавторами (2017), напротив, считают Н2О2 средством для индукции окислительных процессов в клетках в условиях пробирки. При этом в исследовании было показано, что геном имеет разную чувствительность к окислительному стрессу, индуцированному экзогенным Н2О2 [14].
F.R. De Santana с соавторами (2017), показали, что в зависимости от уровня перехода Fe2+ в Fe3+ наблюдается сниженная миграция макрофагов и их способность к фагоцитозу вследствие изменения электропотенциалов, что объясняет клиническое ухудшение состояния на фоне ишемии, связанное с переходом 2-валентного железа в Fe3+ , обладающим меньшей способностью отдавать кислород тканям. Известно, что большая часть окислительно-восстановительных реакций происходит в присутствии иона металла, переносчика одного электрона, как при реакции взаимодействии перекиси водорода с ионом Fe2+ с генерированием гидроксильных радикалов, открытой Фентоном в 1894 г. Гидроксильные радикалы в комбинации с солями железа окисляют альдозы до озонов. Нарушение каскада реакций является следствием превращения иона двухвалентного железа в ион трехвалентного железа, что усугубляет ишемическое повреждение клеток.
Большинство авторов утверждают, что выделяемая клетками Н2О2 оказывает токсический эффект, но не отрицают положительной роли экзогенного воздействия [15, 16], в отличие от S. Sutariya, H. Patel (2017), получивших положительные результаты после воздействия на изолят сывороточного белка (WPI) растворами с различной концентрацией H2O2 в диапазоне концентраций 0–0,144 в деионизированной воде. К выводам о положительном воздействии hydrogen peroxide пришли Y. He с соавторами (2017), предложившие консервативное лечение онкологических заболеваний с использованием реакции Фентона, имеющие в своей основе световое облучение ткани, способствуещее передаче электронов к Fe3+ из FeOxH для ускорения их реакции с О2, с образованием супероксидных анион-радикалов, подвергающихся реакции диспропорционирования и генерирования Н2О2 [17]. За этим следует реакция Н2О2 с Fe2+ с образованием FeOxH, посредника в реакции Фентона, с производством гидроксильных радикалов. Авторами показана возможность использования GO-FeOxH в качестве наноагента в эффективной консервативной терапии рака.
Выполнение фагоцитарной функции эффекторными иммуноцитами реализуется через каскад реакций с образованием hydrogen peroxide. Для выполнения защитных функций фагоциты обладают распознающими рецепторами, кислородозависимыми и кислородонезависимыми механизмами киллинга микроорганизмов с генерированием активных форм неорганических окислителей, вызывающих деструкцию фагоцитируемого объекта: hydrogen peroxide, супероксид анион (О2-), синглетный кислород (1O2) и другие. В качестве результата реакций, катализируемых ферментом супероксидисмутазой (СОД), две молекулы СОД дают перекись водорода, обладающую высоким антимикробным действием. Усиливает эффект окислением хлоридов hydrogen peroxide благодаря присутствию миелопероксидазы (МПО) с формированием мощного цитотоксического агента – гипохлорной кислоты HOCl, при окислени которой супероксидным радикалом выделяется гидроксильный радикал ОН. Дальнейшее окисление гипохлорит-иона перекисью водорода способствует синтезу синглетного кислорода 1О2, являющегося источником синтеза озона О3, ещё более усиливающего мощный антимикробный ответ.
Заключение
Анализ собственных и литературных данных свидетельствует, что при поражениях мозга, когда повышается уровень «активной формы» железа, необходима стимуляция образования ОН- радикала, выполняющего роль прооксиданта. В присутствии металлов переменной валентности происходит образование из тиолов восстановленной формы реактивных тиоловых радикалов – соединений типа RS и ОН- [18]. Активные формы кислорода (АФК), генерируемые Н2О2 и другими источниками, участвуют как вторичные посредники, выполняя роль в регуляции процессов клеточного роста, программированной гибели и клеточной адгезии. Получены данные о влиянии на пролиферативные процессы низких (микромолярных) наноконцентраций hydrogen peroxide и подавление антиоксидантами нормальной клеточной пролиферации. Не исключено, что ОН-, генерируемый реакцией Фентона, служит фактором усиления клеточной пролиферации и активности митоген-активируемой протеинкиназы (МАР-киназы). Это подтверждается фактами того, что ловушки ОН- (маннитол, диметилсульфоксид) и хелаторы железа способны тормозить регенераторный потенциал, стимулируемый hydrogen peroxide. Также известно, что с АФК связана передача сигнала от тромбоцитарного фактора роста, эпидермального фактора роста, трансформирующего фактора роста Р-1, фактора некроза опухолей (ФНО-а) [19]. Участие интерлейкина-1 и интерферона в сигнальной транедукции связывают с образованием активной формы кислорода, а фактора некроза опухолей (ФНО-а) – с Н2О2 [20]. Установлено, что в нейроглиальных клетках, окружающих нейроны, интерлейкин-lfl повышает образование Н2О2, вызывающее снижение фосфатазной активности и активации МАР-киназы. ФНО-а через повышение образования АФК активирует факторы транскрипции NF-kp и АР-1, а также программированную гибель нейронов.
Мнение об источниках О2, как НАДН и НАДФН-оксидазы, активируемых ангиотензином, противоречит данным о способности Н2О2, индуцировать рост клеток гладкой мускулатуры сосудов [21]. Спектр механизмов влияния на клеточные процессы hydrogen peroxide широк, о чём говорят полученные данные о роли Н2О2 в сигнальной трансдукции тромбоцитарного фактора роста (PQGF) и трансформирующего фактора роста TGF-*pi. Одним из механизмов влияния Н2О2 предполагают его действие через инактивацию протеинтирозин фосфатаз, как и эпидермального фактора роста [22].
Однако вопрос о реальном значении hydrogen peroxide в процессе внутриклеточной сигнализации требует дальнейших исследований. Имеющиеся на современном этапе полученные данные противоречивы и неоднозначны. Только комплексный анализ с учетом специфики функционирования нейронов, в том числе и с учётом геномных изменений, позволит реально показать роль Н2О2 в механизмах регуляции пролиферации и нейропротекции нервных клеток [23].
С учётом низкой стоимости hydrogen peroxide, не подлежащий запатентованию, не имеющий фактически никакой коммерческой значимости, можно принять в качестве наиболее перспективного средства после дополнительного изучения механизмов его влияния на гистофизиологию нервных клеток в целях дальнейшего стратегического решения о его применении в профилактике, лечении и реабилитации нейродегеративных процессов в корковых формациях головного мозга человека.
Работа выполнена при поддержке Научного фонда ДВФУ, в рамках государственного задания 17.5740/2017/6.7.
Библиографическая ссылка
Рева И.В., Ямамото Т., Гульков А.Н., Язутано Такафуджи, Балдаев С.Н., Пикула К.С., Индык М.В., Лемешко Т.Н., Вершинина С.С., Багрянцев В.Н., Рева Г.В. НЕЙРОПРОТЕКТОРНАЯ РОЛЬ HYDROGEN PEROXIDE // Международный журнал прикладных и фундаментальных исследований. 2018. № 12-2. С. 346-352;URL: https://applied-research.ru/ru/article/view?id=12573 (дата обращения: 09.02.2026).
DOI: https://doi.org/10.17513/mjpfi.12537

