Наночастицы оксидов многих металлов находят широкое применение в различных областях науки и техники, медицине: в качестве керамики, катализатора химических реакций, очистителя органических загрязнений, активного элемента солнечных батарей, газовых сенсоров, фармакологии и др. (например, [1–3] и библиография в них).
Важнейшая характеристика наночастиц – это температура плавления. Первой экспериментальной работой по этой проблеме является, пожалуй, работа [4], а вот первая теоретическая работа появилась еще в 1909 г. [5]. В последние годы интерес к этой проблеме не ослабевает [6–9].
В настоящей работе экспериментально определена температура плавления некоторых наночастиц оксидов металлов по методике [10–12] и предложена универсальная эмпирическая зависимость, справедливая и для более сложных наноструктур.
Материалы и методы исследования
В основе нашего подхода [11, 12] лежит размерная зависимость некоторого физического свойства [10]. В рассматриваемом случае – это размерная зависимость рентгенолюминесценции оксидов некоторых металлов [11]:
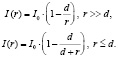 (1)
(1)
Здесь I0 – начальная интенсивность рентгенолюминесценции, I(r) – интенсивность свечения частицы радиусом r, d – параметр, который равен [11]:
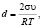 (2)
(2)
где σ – поверхностное натяжение оксида, υ – молярный объем оксида, R – газовая постоянная, Т – температура.
Способ применяли для определения поверхностного натяжения диэлектрических кристаллов KCl, с примесью ионов таллия в качестве люминесцирующего зонда. Интенсивность рентгенолюминесценции определялась стандартным фотоэлектрическим методом. Размер зерна диэлектрика определялся с помощью металлографического микроскопа Эпиквант. Результаты показаны на рис. 1. В координатах 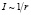 экспериментальная кривая спрямляется в соответствии с (1), давая значение d = 0,02 мкм. Для KCl ϑ = 37,63 см3/моль и из (2) для поверхностного натяжения получено: σ = 0,221∙Дж/м2. Температура плавления оксида определялась по формуле [13]:
экспериментальная кривая спрямляется в соответствии с (1), давая значение d = 0,02 мкм. Для KCl ϑ = 37,63 см3/моль и из (2) для поверхностного натяжения получено: σ = 0,221∙Дж/м2. Температура плавления оксида определялась по формуле [13]:
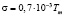 , (Дж/м2), (3)
, (Дж/м2), (3)
Tm – температура плавления.
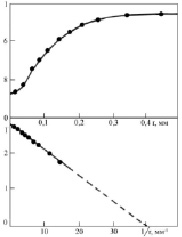
Рис. 1. Зависимость интенсивности рентгенолюминесценции KCl – Tl от размера зерна люминофора
Результаты исследования и их обсуждение
По методике, описанной выше, были исследованы размерные зависимости оксидов некоторых металлов. Пример такой зависимости показан на рис. 2.
В табл. 1 приведены значения температуры плавления массивных образцов оксидов некоторых металлов и образцов размером r = 10, 25 и 50 нм.
Таблица 1
Температура плавления наночастиц оксидов металлов
|
Соединение |
d, нм |
T0, K |
Т(r), K r = 10 нм |
Т(r), K r = 25 нм |
Т(r), K r = 50 нм |
|
Li2O |
2,059 |
1873 |
1498 |
1723 |
1798 |
|
Na2O |
3,131 |
1405 |
984 |
1236 |
1321 |
|
K2O |
4,210 |
1013 |
608 |
851 |
932 |
|
Rb2O |
4,876 |
778 |
389 |
622 |
700 |
|
Cs2O |
6,115 |
633 |
253 |
481 |
557 |
|
BeO |
4,011 |
2803 |
1682 |
2355 |
2579 |
|
MgO |
3,241 |
3098 |
2169 |
2726 |
2912 |
|
CaO |
5,817 |
2843 |
1137 |
2160 |
2502 |
|
SrO |
7,053 |
2703 |
811 |
1946 |
2325 |
|
BaO |
8,254 |
2193 |
439 |
1491 |
1842 |
|
Al2O3 |
7,376 |
2317 |
695 |
927 |
1993 |
|
Ga2O3 |
2,876 |
2013 |
1409 |
1771 |
1892 |
|
In2O3 |
5,117 |
2183 |
1092 |
1746 |
1965 |
|
Tl2O3 |
8,151 |
1107 |
221 |
753 |
930 |
|
SiO2 |
11,907 |
2001 |
910 |
1041 |
1521 |
|
GeO2 |
8,670 |
1389 |
731 |
889 |
1139 |
|
SnO |
3,460 |
1353 |
812 |
1137 |
1245 |
|
PbO |
4,528 |
1159 |
580 |
927 |
1043 |
|
CuO |
5,286 |
1720 |
360 |
1376 |
1548 |
|
Ag2O |
12,700 |
553 |
166 |
266 |
394 |
|
Au2O3 |
15,189 |
428 |
171 |
268 |
300 |
|
ZnO |
3,072 |
2073 |
1451 |
1824 |
1949 |
|
CdO |
2,994 |
1273 |
891 |
1120 |
1197 |
|
CrO3 |
24,453 |
2708 |
797 |
1381 |
1829 |
|
MoO3 |
27,537 |
1074 |
290 |
516 |
697 |
|
WO3 |
37,211 |
1743 |
371 |
703 |
1001 |
|
MnO2 |
8,280 |
808 |
161 |
485 |
679 |
|
TcO2 |
14,492 |
1373 |
572 |
880 |
989 |
|
ReO2 |
19,814 |
577 |
192 |
321 |
346 |
|
Fe2O3 |
17,269 |
1839 |
681 |
1034 |
1214 |
|
CoO |
6,297 |
2208 |
883 |
1678 |
1943 |
|
NiO |
5,944 |
1955 |
782 |
1486 |
1720 |
|
Ce2O3 |
17,269 |
2673 |
990 |
1591 |
1764 |
|
Pr2O3 |
17,718 |
2273 |
812 |
1322 |
1455 |
|
Nd2O3 |
18,744 |
2593 |
894 |
1473 |
1608 |
|
Sm2O3 |
19,230 |
2543 |
877 |
1445 |
1577 |
|
Eu2O3 |
17,654 |
2564 |
916 |
1491 |
1641 |
|
Gd2O3 |
24,133 |
2623 |
771 |
1348 |
1786 |
|
Tb2O3 |
22,472 |
2432 |
760 |
1294 |
1689 |
|
Dy2O3 |
24,738 |
2681 |
766 |
1341 |
1787 |
|
Ho2O3 |
71,797 |
2632 |
321 |
678 |
1079 |
|
Er2O3 |
24,281 |
2653 |
780 |
1354 |
1793 |
|
Yb2O3 |
14,610 |
2703 |
1081 |
1689 |
1892 |
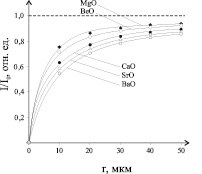
Рис. 2. Размерная зависимость относительной рентгенолюминесценции от размера зерна люминофора
Оксиды Cs2O, Tl2O3, Ag2O, Au2O3, MnO2, ReO2, как следует из табл. 1, оказываются при комнатной температуре нестабильны – Tm < 0 °С = 273,15 К. Оксид цезия Cs2O – оранжево-красные гексагональные кристаллы. В виде минерального сырья в природе эти оксиды не встречаются, а получаются искусственным путем. Оксид таллия Tl2O3 – тёмно-коричневые кристаллы. Не растворяется в воде, щелочах. Реагирует с кислотами. Оксид серебра Ag2O – порошок коричнево-черного цвета. Ag2O практически нерастворим в большинстве известных растворителей, исключая те, с которыми он взаимодействует химически. Оксид золота Au2O3 – аморфен. Имеет красный или красно-бурый цвет. Оксид марганца MnO2 – порошок тёмно-коричневого цвета, нерастворимый в воде. Наиболее устойчивое соединение марганца, широко распространённое в земной коре – минерал пиролюзит. Оксид рения ReO2 – светло-жёлтые диамагнитные кристаллы ромбической сингонии.
Из табл. 1 также следует, что температура большей части оксидов уменьшается на тысячу градусов и более при уменьшении размеров наночастиц менее 10 нм. Это необходимо учитывать при многих технологических процессах.
Если теперь уравнение (3) подставить в (2) при T = Tm, то получим
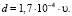 (4)
(4)
Уравнение (4) показывает, что размерный параметр d определяется только фундаментальной величиной – атомным объемом вещества υ, который изменяется периодически в соответствии с таблицей Д.И. Менделеева (рис. 3).
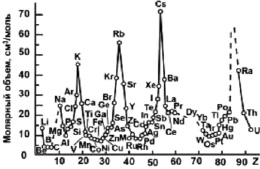
Рис. 3. Периодическое изменение молярного объема
Уравнение (3) может быть использовано также для оценки энергии диспергирования оксидов металлов, которые входят в состав большого количества минералов и руд. Самая затратная операция в горной промышленности – это измельчение руд. Соответствующие расчеты даны в табл. 2.
Таблица 2
Работа диспергирования для оксидов металлов
|
Соединение |
Поверхностное натяжение |
Удельная поверхность частиц S, см2/г |
||||
|
1х104 |
5х104 |
1х105 |
5х105 |
1х106 |
||
|
Li2O |
0,173 |
173 |
865 |
1730 |
8650 |
17300 |
|
Na2О |
0,143 |
143 |
715 |
1430 |
7150 |
14300 |
|
К2О |
0,131 |
131 |
655 |
1310 |
6550 |
13100 |
|
Rb2О |
0,121 |
121 |
605 |
1210 |
6050 |
12100 |
|
Cs2О |
0,118 |
118 |
590 |
1180 |
5900 |
11800 |
|
BeО |
0,602 |
602 |
3010 |
6020 |
30100 |
60200 |
|
MgО |
0,359 |
359 |
1795 |
3590 |
17950 |
35900 |
|
CaО |
0,436 |
436 |
2180 |
4360 |
21800 |
43600 |
|
SrО |
0,399 |
399 |
1995 |
3990 |
19950 |
39900 |
|
BaО |
0,384 |
384 |
1920 |
3840 |
19200 |
38400 |
|
Al2О3 |
0,360 |
360 |
1800 |
3600 |
18000 |
36000 |
|
Ga2О3 |
0,124 |
124 |
620 |
1240 |
6200 |
12400 |
|
In2О3 |
0,165 |
165 |
825 |
1650 |
8250 |
16500 |
|
Tl2О3 |
0,225 |
225 |
1125 |
2250 |
11250 |
22500 |
|
SiO2 |
0,655 |
655 |
3275 |
6550 |
32750 |
65500 |
|
GeO2 |
0,437 |
437 |
2185 |
4370 |
21850 |
43700 |
|
SnO |
0,199 |
199 |
995 |
1990 |
9950 |
19900 |
|
PbO |
0,231 |
231 |
1155 |
2310 |
11550 |
23100 |
|
CuO |
0,523 |
523 |
2615 |
5230 |
26150 |
52300 |
|
Ag2O |
0,488 |
488 |
2440 |
4880 |
24400 |
48800 |
|
Au2O |
0,524 |
524 |
2620 |
5240 |
26200 |
52400 |
|
ZnO |
0,264 |
264 |
1320 |
2640 |
13200 |
26400 |
|
CdO |
0,237 |
237 |
1185 |
2370 |
11850 |
23700 |
|
HgO |
0,090 |
90 |
450 |
900 |
4500 |
9000 |
|
CrO3 |
0,854 |
854 |
4270 |
8540 |
42700 |
85400 |
|
MoO3 |
1,119 |
1119 |
5595 |
11190 |
55950 |
111900 |
|
WO3 |
1,443 |
1443 |
7215 |
14430 |
72150 |
144300 |
|
Fe2O3 |
0,707 |
707 |
3535 |
7070 |
35350 |
70700 |
|
Окончание табл. 2 |
||||||
|
Соединение |
Поверхностное натяжение |
Удельная поверхность частиц S, см2/г |
||||
|
1х104 |
5х104 |
1х105 |
5х105 |
1х106 |
||
|
CoO |
0,676 |
676 |
3380 |
6760 |
33800 |
67600 |
|
NiO |
0,662 |
662 |
3310 |
6620 |
33100 |
66200 |
|
Ce2O3 |
0,423 |
423 |
2115 |
4230 |
21150 |
42300 |
|
Pr2O3 |
0,467 |
467 |
2335 |
4670 |
23350 |
46700 |
|
Nd2O3 |
0,503 |
503 |
2515 |
5030 |
25150 |
50300 |
|
Sm2O3 |
0,511 |
511 |
2555 |
5110 |
25550 |
51100 |
|
Eu2O3 |
0,456 |
456 |
2280 |
4560 |
22800 |
45600 |
|
Gd2O3 |
0,615 |
615 |
3075 |
6150 |
30750 |
61500 |
|
Dy2O3 |
0,646 |
646 |
3230 |
6460 |
32300 |
64600 |
|
Ho2O3 |
0,673 |
673 |
3365 |
6730 |
33650 |
63700 |
|
Er2O3 |
0,684 |
684 |
342 |
6840 |
3420 |
68400 |
|
Tm2O3 |
0,705 |
705 |
3525 |
7050 |
35250 |
70500 |
|
Yb2O3 |
0,424 |
424 |
2120 |
4240 |
21200 |
42400 |
|
Lu2O3 |
0,746 |
746 |
3730 |
7460 |
37300 |
74600 |
Заключение
В работе предложены:
– метод определения поверхностного натяжения оксидов металлов по размерной зависимости интенсивности люминесценции от размера зерна люминофора;
– метод определения температуры плавления наночастицы при различных ее размерах;
– метод оценки энергии диспергирования оксидов металлов, которые входят в состав большого количества минералов и руд.
В работе показано, что размерный параметр d определяется только фундаментальной величиной – атомным объемом вещества.
Полученная в работе связь между температурой плавления и поверхностной энергией может быть использована для определения ее величины. Это важно, поскольку определение поверхностной энергии твердых тел очень непростая задача.
Работа выполнена по программе МОН РК. Гранты № 0118РК000063 и № Ф.0780.
Библиографическая ссылка
Юров В.М., Лауринас В.Ч., Гученко С.А. ОЦЕНКА ТЕМПЕРАТУРЫ ПЛАВЛЕНИЯ НАНОЧАСТИЦ НЕКОТОРЫХ ОКСИДОВ МЕТАЛЛОВ // Международный журнал прикладных и фундаментальных исследований. 2019. № 1. С. 38-42;URL: https://applied-research.ru/ru/article/view?id=12637 (дата обращения: 08.01.2026).

