В целях нормализации микрофлоры сельскохозяйственных животных рекомендуется применять синбиотики – препараты содержащие пробиотики или живые микроорганизмы и их метаболиты, а также пребиотики или вещества различной природы, стимулирующие рост и физиологическую активность микрофлоры животных [1, 2].
Для того, чтобы пробиотики оказывали необходимый профилактический или терапевтический эффект, количество живых клеток пробиотических микроорганизмов в одной дозе должно быть не менее 1×107КОЕ/мл. Это связано с негативным влиянием внешних факторов на пробиотики при их хранении и применении, преодолением ими агрессивной среды желудка и т.д. Повысить жизнеспособность, стабильность пробиотических микроорганизмов и высокую биологическую доступность биотехнологического продукта можно посредством использования мягких методов иммобилизации, например, адсорбции. Микроорганизмы, прочно сцепленные с частичками сорбента (например активированного угля), беспрепятственно проникают в желудок. Энтеросорбент служит надежной защитой бактериям, притягивая к своей поверхности агрессивные вещества. Пробиотики, полученные методом иммобилизации, попадают в толстый кишечник, сохранив большую часть микроорганизмов. Наличие в составе препаратов энтеросорбента оказывает влияние не только на биодоступность, но и на лечебную активность препаратов: пробиотические бактерии крепятся к внутренней стенке кишечника; ускоряется рост и размножение полезных микроорганизмов; быстро снижается популяция бактерий, принадлежащих к условно-патогенной и патогенной микрофлоре. Жизнедеятельность микробов из полезного биоценоза сопровождается выделением в просвет ЖКТ метаболитов, создающих кислую среду pH. В таких условиях способна существовать только кишечная палочка, а численность стафилококков и клостридий постепенно снижается. Нормализация микробиоценоза приводит к восстановлению оптимального пищеварения и перистальтики [3–5].
По мнению А.В. Корочинского и других, для иммобилизации клеток микроорганизмов могут быть использованы вещества органической (хитин, древесина, целлюлоза) или неорганической (глины, песок, кремнеземы, угли) природы, искусственные неорганические носители (углеродные материалы, металлические сплавы, керамика) и синтетические полимеры (полиэтилен, нейлон, полиуретаны), а также природные биодеградируемые полимеры (пектин, альгинат, хитозан, каррагинан, фукоидан). Распространенные методы иммобилизации клеток можно разделить на три группы: связывание на твердом носителе, включение в пространственную структуру носителя и иммобилизация с использованием мембранной технологии [5].
Цель исследования: усиление и стабилизация пробиотических свойств кормовых препаратов за счет адсорбции микроорганизмов на макропористых сорбентах.
Материалы и методы исследования
Объект исследования – консорциум культур молочнокислых бактерий Lb. casei 22+ Lactobacillus pontis 67+ Lb. paracasei 104, составляющий основу пробиотического препарата.
Для иммобилизации лактобацилл использовали макропористые сорбенты: модифицированный высокоуглеродистый шунгит и аморфный кремний в хелатной форме.
Поддержание и исследование культур микроорганизмов, консорциума на их основе и пробиотического препарата, осуществляли стандартными методами, принятыми в микробиологии и биотехнологии.
Иммобилизация клеток молочнокислых бактерий на шунгите и кремнии (жидкие пробиотики). В суточный, физиологически активный консорциум молочнокислых бактерий в питательной среде МРС с титром 1·109 КОЕ/мл добавляли сорбент (высокоуглеродистый шунгит или аморфный кремний) в количестве 0,05 %; 0,1 %; 0,5 %. Иммобилизацию проводили в течение 24 ч при температуре 37 °С, периодически встряхивая для перемешивания. Через час после внесения сорбентов пипеткой отделяли супернатант от сорбента и высевали методом Коха на плотную среду МРС для подтверждения уменьшения количества свободных клеток в культуральной жидкости. Далее жидкие препараты синбиотика, содержащие клетки лактобактерий и макропористых сорбентов, помещались на хранение в условиях бытового холодильника при температуре 4–6 °С на 5 месяцев для оценки стабилизирующего эффекта сорбентов и определения их оптимального количества. Динамику роста иммобилизованных культур определяли, проводя последовательное разведение иммобилизатов в жидкой среде МРС и/или с высевом разведений на плотную среду МРС.
Статистическую обработку результатов прводили стандартными методами [6].
Результаты исследования и их обсуждение
Основу препарата составляет консорциум высокоактивных культур молочнокислых бактерий с коллекционными номерами – (В-449) Lactobacillus pontis 67, (В-7) Lb. casei 22, (В-446) Lb. paracasei 104. Эти культуры были выделены с поверхности зерна пшеницы из различных регионов Казахстана и исследованы в Казахском НИИ перерабатывающей и пищевой промышленности, имеют генетические паспорта с идентифицированной последовательностью фрагмента гена 16S r RNA.
У всех культур, составляющих консорциум, была исследована антагонистическая активность по отношению к условно-патогенным и патогенным микроорганизмам: B. subtilis ATCC 6633, Escherichia coli-1257, Staphylococcus sp.209-P, Salmonella typhimurum. Оценка антагонистической активности методом отсроченного антагонизма показала, что у штаммов Lactobacillus pontis 67, Lb. casei 22 и Lb. paracasei 104 антагонистическая активность по отношению ко всем тест-культурам была высокой (табл. 1).
Таблица 1
Оценка антагонистической активности молочнокислых бактерий
|
Штамм |
Зоны угнетения роста индикаторных культур (мм) |
|||
|
Escherichia coli-1257 |
Staphylococcus sp. 209-P |
B. subtilis ATCC 6633 |
Salmonella typhimurium |
|
|
Lb. pontis 67 |
21 ± 1,0 |
17 ± 0,5 |
21 ± 1,3 |
19 ± 0,5 |
|
Lb. casei 22 |
23 ± 1,1 |
16 ± 0,5 |
22 ± 1,0 |
19 ± 0,3 |
|
Lb. paracasei 104 |
20 ± 0,8 |
16 ± 0,4 |
21 ± 1,2 |
17 ± 0,5 |
|
Консорциум Lactobacillus pontis 67+Lb. casei 22 + Lb. paracasei 104 |
23 ± 1,2 |
18 ± 0,2 |
22 ± 0,5 |
20 ± 0,4 |
Консорциум культур молочнокислых бактерий Lb. casei 22+ Lactobacillus pontis 67+ Lb. paracasei 104 обладает высокой кислотообразующей, биохимической и антагонической активностью, т.е. способностью подавлять рост условно-патогеннных и патогенных микрооогранизмов, вызывающих заболевания ЖКТ сельскохозяйственных животных, а также споровых бактерий, загрязняющих корма. Не менне важным свойством, которым должны обладать пробиотические культуры, является устойчивость к антибиотикам. Отобранные нами культуры МКБ устойчивы к действию канамицина, гентомицина, ванкомицина и фуразолидона. Физиолого-биохимическая характеристика консорциума на среде МРС: титруемая кислотность – 14,6 ± 0,8 °Н, титр клеток – 2,5×109 КОЕ/мл, антагонистическая активность (диаметр зоны подавления роста B. subtilis) – 22 ± 0,5мм. Штаммы культивируются в смешанной культуре в соотношении 1:1:1 в течение 48 ч. При совместном культивировании отобранных культур достигнут принцип комплексного пробиотика – культуры микроорганизмов биосовместимы, их соотношение в консорциуме стабильно в течение длительного культивирования, они дополняют и усиливают активность друг друга, повышается их антагонистическая активность.
Наиболее простым, технологичным и экономичным способом иммобилизации для кормовых пробиотиков, на наш взгляд, представляется способ адсорбции на энтеросорбентах или пребиотиках, что позволит усовершенствовать компонентный состав пробиотического препарата по типу «синбиотика», усилить и стабилизировать пробиотические свойства препарата. В связи с этим нами была исследована возможность введения в состав жидкой питательной среды различных макропористых сорбентов: аморфного кремния в хелатной форме, модифицированного высокоуглеродистого шунгита (в концентрациях 0,05; 0,1; 0,5 %) и проведена оценка их стимулирующего и стабилизирующего эффекта.
Наличие и величина зарядов играют главенствующую роль во взаимодействии клетка – сорбент, а природа адсорбционных сил таких взаимодействий определяется в первую очередь химическим составом клеточных стенок бактерий и функциональными группами самих сорбентов [7].
Известно, что грамположительные бактерии, в том числе и лактобациллы, несут на своей поверхности отрицательный заряд. Исследованиями Н.В. Потехиной показано, что отрицательный заряд клеточной поверхности обуславливается анионными полимерами клеточных стенок. Это в первую очередь относится к пептидогликану (ПГ) – макрополимеру. Отрицательный заряд ПГ формируют карбоксильные группы γ-глютаминовой и мезо-диаминопимелиновой кислот, а также терминальные остатки D-Ala пептидных субъединиц. Значительный вклад в формирование структуры полиэлектролитного геля клеточной стенки вносят тейхоевые кислоты (ТК) и липотейхоевые кислоты (ЛТК), а также другие анионные соединения, такие как тейхуроновые кислоты и сахар-1-фосфатные полимеры [8].
Исследуемые нами сорбенты являются макропористыми, благодаря аморфной структуре и обладают высокой адсорбционной активностью. Аморфность углерода модифицированного шунгита подтверждается неупорядоченным смещением графитоподобных сеток относительно друг друга. Однако, несмотря на то, что в сопоставлении с графитовым монослоем поликонденсированная сетка шунгита дефектна, сильно деформирована, сам шунгит можно считать имеющим довольно высокоупорядоченную структуру. Такую структуру по характеру дифракционной картины можно отнести к турбостратной углеродной структуре, подобно кристаллитам сажи, которым также свойственна двухмерная упорядоченность. Кроме этого, на поверхности обогащенного высокоуглеродистого шунгита обнаруживаются органические соединения, при окислении которых могут появляться карбоксильные группы. Таким образом, при иммобилизации молочнокислых бактерий на высокоуглеродистом шунгите углеродные группы сорбента гидрофобной частью вступают в контакт с поверхностью клеток, а карбоксильные группы шунгита участвуют в хемосорбционных процессах.
Аморфный кремний во многом похож на углерод. Реакционная способность аморфного кремния выше, чем кристаллического.
В ходе исследований нами показано, что кремний и шунгит не оказывают отрицательного влияния на физиологическую активность и жизнеспособность клеток молочнокислых бактерий, более того, введение в среду МРС хелатной формы аморфного кремния и высокоуглеродистого шунгита в концентрации 0,1–0,5 % способствует повышению титра МКБ через 24 ч культивирования до 1011 КОЕ/мл (табл. 2), а также повышению антагонистической активности консорциума МКБ в отношении Bacillus subtilis ATCC 6633 – 23–25 мм (диаметр зоны подавления роста тест-культуры для определения антибиотической активности) (табл. 3).
Таблица 2
Титр клеток молочнокислых бактерий при росте на среде МРС с добавлением различных количеств сорбентов
|
Образцы |
Сроки хранения, титр КОЕ/мл |
|||||
|
Исх. |
1 мес. |
2 мес. |
3 мес. |
4 мес. |
5 мес |
|
|
0,05 % шунгита |
1010 |
1010 |
1010 |
1010 |
1010 |
1010 |
|
0,1 % шунтига |
1011 |
1011 |
1011 |
1011 |
1011 |
1011 |
|
0,5 % шунгита |
1011 |
1011 |
1011 |
1011 |
1011 |
1011 |
|
0,05 % кремния |
1010 |
1010 |
1010 |
1010 |
1010 |
1010 |
|
0,1 % кремния |
1011 |
1011 |
1011 |
1011 |
1011 |
1011 |
|
0,5 % кремния |
1011 |
1011 |
1011 |
1011 |
1011 |
1011 |
|
Контроль (без сорбента) |
109 |
109 |
108 |
107 |
106 |
105 |
Таблица 3
Антагонистическая активность молочнокислых бактерий при росте на среде МРС с добавлением различных количеств сорбентов
|
Образцы |
Антагонистическая активность, диаметр зоны подавления роста Bacillus subtilis ATCC 6633, мм |
||
|
Исх. |
4 мес. |
5 мес |
|
|
0,05 % шунгита |
23 ± 0,6 |
22 ± 0,7 |
22 ± 0,7 |
|
0,1 % шунтига |
25 ± 0,5 |
25 ± 0,4 |
27 ± 0,6 |
|
0,5 % шунгита |
24 ± 0,4 |
25 ± 0,6 |
25 ± 0,6 |
|
0,05 % кремния |
23 ± 0,4 |
22 ± 0,4 |
22 ± 0,6 |
|
0,1 % кремния |
25 ± 0,3 |
26 ± 0,4 |
26 ± 0,7 |
|
0,5 % кремния |
25 ± 0,5 |
25 ± 0,3 |
26 ± 0,3 |
|
Контроль (без сорбента) |
22 ± 0,5 |
19 ± 0,3 |
17 ± 0,3 |
Для оценки стабилизирующего эффекта сорбентов, иммобилизаты, содержащие консорциум молочнокислых бактерий, кремний и шунгит были заложены на хранение при температуре 6 °С в течение 5 месяцев. Нами установлено, что наибольшими стабилизирующими свойствами высокоуглеродистый шунгит обладает в концентрации 0,1 %, а аморфный кремний (хелатная форма) в концентрации 0,1–0,5 %.
Ингибирующими факторами, влияющими на рост микроорганизмов, являются уменьшение в культуральной жидкости питательных веществ и накопление продуктов обмена веществ или метаболитов. Введение же нами в жидкую питательную среду стабилизирующих сорбентов шунгита или кремния, концентрирующих культуры и связывающих метаболиты, способствовало увеличению времени экспоненциальной и линейной фаз роста МКБ и, как следствие, увеличению скорости роста и конечного выхода биомассы, а также повышению антагонистической и пробиотической активности МКБ.
Сорбенты аморфный кремний в хелатной форме и высокоуглеродистый шунгит способствуют стабилизации в течение 5 месяцев в жидкой среде МРС титра клеток консорциума лактобацилл на уровне 1011 КОЕ/мл и повышению их антагонистической активности до 26–27 мм (за счет накопления продуктов метаболизма) (рисунок).
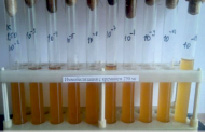
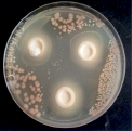
А Б
Влияние внесения 0,5 % хелатной формы аморфного кремния в среду МРС на физиологическую активность консорциума МКБ, после 5 месяцев хранения: А – титр МКБ, 1011КОЕ/мл; Б – антагонистическая активность МКБ в отношении тест-культуры для определения антибиотической активности Bacillus subtilis ATCC 6633
Для получения жидкого пробиотического препарата консорциум молочнокислых бактерий засевали в количестве 5 % в следующую питательную среду: смесь пшеничной и соевой муки + вода (гидромодуль 1:1,5) + 0,1 % сорбент (модифицированный высокоуглеродистый шунгит или аморфный кремний в хелатной форме); культивирование проводили при температуре 35 ± 2 °С в течение 22 ± 2 ч. Данный технологический режим обеспечивал достижение необходимого уровня титруемой кислотности (14–16 град), рН (3,6–3,8), максимального количества жизнеспособных клеток МКБ (1011 КОЕ/мл) и высокого антагонизма (26 мм).
Полученный синбиотик, содержащий молочнокислые бактерии, далее был использован для введения в состав кормовых добавок из отходов пивоваренной, спиртовой и крахмалопаточной промышленности.
Выводы
В ходе исследований нами подобраны стабилизирующие сорбенты – высокоуглеродистый шунгит и аморфный кремний (хелатная форма), которые при добавлении в жидкую форму пробиотического препарата в количестве 0,1 % усиливают и поддерживают на высоком уровне пробиотические свойства кормового синбиотика на протяжении 5 месяцев.
Библиографическая ссылка
Чижаева А.В., Дудикова Г.Н., Велямов М.Т., Потороко И.Ю., Алимкулов Ж.С., Бутыркина Н.П., Велямов Ш.М., Курасова Л.А., Жумалиева Т.М. ИСПОЛЬЗОВАНИЕ МАКРОПОРИСТЫХ СОРБЕНТОВ ДЛЯ УСИЛЕНИЯ И СТАБИЛИЗАЦИИ ПРОБИОТИЧЕСКИХ СВОЙСТВ КОРМОВЫХ СИНБИОТИКОВ // Международный журнал прикладных и фундаментальных исследований. 2019. № 3. С. 71-75;URL: https://applied-research.ru/ru/article/view?id=12686 (дата обращения: 07.03.2026).

