Канцероматоз брюшины является одним из наиболее неблагоприятных вариантов прогрессирования и рецидивирования злокачественных опухолей желудочно-кишечного тракта (ЖКТ). Длительное время развитие канцероматоза брюшины рассматривалось как терминальная стадия онкологического заболевания с медианой выживаемости 3–6 мес., при котором основным методом лечения оставалась лишь системная химиотерапия, несмотря на низкую ее эффективность, особенно при таких опухолях, как рак желудка. Перитонеальный канцероматоз (ПК) встречается у 14–43 % пациентов с раком желудка [1, 2]. При этом из всей группы больных раком желудка брюшина является единственным местом метастазирования для 35 % пациентов [3]. Cамой частой причиной смерти у пациентов с раком желудка является имплантационное метастазирование в брюшину. На момент постановки диагноза уже около 15–40 % пациентов с раком желудка имеют перитонеальное распространение опухоли [4]. После проведения радикальной операции по поводу рака желудка отдаленные метастазы сохраняются у 25–50 % пациентов [5–7]. Из всех случаев рецедивирования заболевания, в 35–45 % причиной становится наличие ПК [6]. Хотя выживаемость после радикальной операции при раке желудка незначительно повышается с помощью адъювантной или неоадъювантной химиотерапии [8, 9], но эти методики остаются безуспешными в снижении частоты метастазирования, включая развитие ПК [10, 11].
В настоящее время «золотым стандартом» паллиативного лечения опухолевого асцита и профилактики его возникновения у больных раком желудка с высоким риском развития ПК, а также для лечения пациентов с уже развившимся ПК в сочетании с циторедуктивной хирургией (ЦРХ) является внутрибрюшинная химиогипертермическая перфузия (ВБХГТП). Основной проблемой в лечении ПК является низкая проницаемость цитостатиков в опухолевые узлы, преимущественно за счёт высокого интерстициального давления жидкости в последних. В связи с этим был предложен принципиально новый способ регионарной химиотерапии ПК – аэрозольная внутрибрюшная химиотерапия под давлением (АВХД), при котором в брюшной полости в условиях карбоксиперитонеума с помощью специальных устройств создаётся аэрозоль из химиопрепарата с последующей экспозицией [12] Новая методика позволяет при меньших дозах химиопрепарата и широких возможностях к повторным процедурам уменьшить диссеминацию перитонеальных очагов, что в дальнейшем может позволить провести циторедуктивную операцию и ВБХГТП.
Цель исследования: морфологическая оценка применения аэрозольной внутрибрюшинной химиотерапии под давлением (АВХД) с использованием цисплатина при развитом карциноматозе на модели экспериментального животного.
Материалы и методы исследования
Исследование проведено на крысах линии Вистар возрастом 3-3,5 месяца с массой тела 340–400 г. Для моделирования перитонеального канцероматоза использован штамм опухоли яичника. Опухоль предварительно перевивали внутрибрюшинно 5 крысам, которые использовались в качестве доноров опухолевых клеток. На 7-й день со времени перевивки развившийся асцит перевивали от крыс-доноров здоровым крысам внутрибрюшинно. Для развития ПК животным вводили внутрибрюшинно 1×107 опухолевых клеток. Экспериментальных животных разделили на две группы. В первой группе (Гр I) заражённых животных оставляли без лечения (n = 5), животных во второй группе (Гр II) на 5-е сут после заражения лечили методом аэрозольной внутрибрюшинной химиотерапии под давлением (АВХД) цисплатином (n = 4). Перед лечением у животных брали биопсию сальника и брыжеечные лимфатические узлы для подтверждения опухолевого процесса, развитие асцита подтверждали цитологическим исследованием.
Животные в Гр I без лечения прожили от 7 суток до 14 суток. У погибших животных забирали аутопсийный материал: солидные пласты опухоли с брюшины, фрагменты брюшины, мышечную ткань передней брюшной стенки, большой и малый сальник, поджелудочную железу с парапанкреатической жировой клетчаткой, печень, почку.
Животные после лечения погибли на 30 сут (n = 3), одна крыса была выведена из эксперимента на 40 сут после лечения. У животных забирали аутопсийный материал: брыжеечные лимфатические узлы, сальник, печень, почку, поджелудочную железу, мышцы передней брюшной стенки с брюшиной. Все эксперименты in vivo выполнены в соответствии с правилами проведения работ с использованием экспериментальных животных (принципы Европейской конвенции, Страсбург, 1986 г., и Хельсинкская декларация Всемирной медицинской ассоциации о гуманном обращении с животными, 1996 г.).
Биопсийный и аутопсийный материал фиксировали в 10 % нейтральном формалине на фосфатном буфере (рН 7,4) не менее 24 ч. Для получения сопоставимых результатов образцы от всех животных обрабатывали параллельно и в одинаковых условиях. После формалиновой фиксации, используя стандартную гистологическую методику со спиртами возрастающей концентрации, материал заливали в парафиновые блоки. Срезы толщиной 5 мкм готовили с помощью микротома Accu-Cut SRT 200 (Sakura, Япония), окрашивали гематоксилином и эозином. Микроскопический анализ проводили на световом микроскопе Leica DM750 (Германия) при увеличении в 100 и 400 раз. Фотосъёмку гистологических объектов выполняли, используя цифровую микрофотокамеру ICC50 (Leica, Германия).
Результаты исследования и их обсуждение
У животных Гр I в аутопсийном материале выявлены имплантированные на сальник опухолевые клетки, имеющие солидный тип роста и образующие экзофитные узлы, покрытые соединительнотканной капсулой. Отметим, что инвазии вглубь сальника не отмечается. В опухолевых узлах клетки располагаются группами, окруженными тонкими соединительнотканными прослойками (рис. 1). Опухолевые клетки имеют округлую и овальную форму с центрально или эксцентрично расположенным крупным гиперхромным ядром. Цитоплазма клеток вакуолизирована вплоть до образования перстневидных клеток. Во всех фрагментах сальника отмечается оментит с образованием грануляционной ткани с выраженной инфильтрацией лимфоцитами, моноцитами, макрофагами, тучными клетками, в меньшей степени – полиморфно-ядерными лейкоцитами. В сосудах разного калибра определяются явления сладжа и стаза. Кровоизлияний и аррозий сосудов не отмечается. В мышечной ткани передней брюшной стенки отмечается инвазивный стелющийся рост опухолевой ткани, сопровождающийся отеком, дистрофическими изменениями мышечных волокон с их незначительной воспалительной инфильтрацией. Во фрагментах брюшины отмечается плотный воспалительный инфильтрат, состоящий из лимфоцитов, макрофагов, моноцитов, на фоне выраженного отека. Мезотелиоциты набухшие, с крупным ядром. В отдельных участках отмечается примыкание к брюшине некротизированной опухолевой ткани, представленной гомогенными эозинофильными массами, содержащими отдельные опухолевые крупные клетки с вакуолизированной цитоплазмой с крупным гипер- или гипохромным ядром, а также апоптотические тельца. Среди некротических масс выявляются лимфоциты и макрофаги. В печени наблюдаются признаки дистрофии гепатоцитов, в синусоидах выявляется большое число лимфоцитов, в сосудах разного калибра – стазы и сладжи, пристеночные фибриновые тромбы. В ветвях печеночной вены определяются отдельные опухолевые клетки. В паренхиме поджелудочной железы наблюдаются признаки дистрофии, в парапанкратической жировой клетчатке встречаются небольшие фокусы некротических масс с клетками в состоянии некробиоза и диффузная выраженная инфильтрация лимфоцитами, моноцитами и небольшим количеством сегментоядерных лейкоцитов.
Таким образом, животные в Гр I, оставленные без лечения, погибли от опухолевой интоксикации на 7–14 сут эксперимента.
В исследованном биопсийном материале Гр II брыжеечные лимфатические узлы с признаками гиперплазии. На грануляционной ткани сальника располагаются некротизированные опухолевые массы (рис. 2).
Биопсийный материал подтвердил, что на 5 сут после перевивки опухоли у животных развился перитонеальный карциноматоз, и АВХД начали проводить у больных крыс. После проведения АВХД продолжительность жизни крыс составила 30 суток, и одно животное вывели из эксперимента на 40 сутки после лечения.
В аутопсийном материале леченых животных практически все фрагменты сальника имеют обычное строение со слабо выраженной воспалительной инфильтрацией, небольшим числом гемосидерофагов и с образованием отдельных мелких плотных инфильтратов, состоящих преимущественно из лимфоцитов. Встречаются участки зрелой грануляционной ткани и фиброза (рис. 3). Опухолевая ткань наблюдается в единичных случаях в виде мелких фокусов гомогенных некротических масс с дегенеративными опухолевыми клетками. Затухание воспалительного процесса также наблюдается в парапанкреатической клетчатке. В лимфатических узлах выявляются признаки неспецифической гиперплазии. Но стоит отметить, что в одном лимфатическом узле обнаружен тотальный метастаз карциномы без инвазии капсулы узла, состоящий из перстневидных клеток. В одном из фрагментов мышечной ткани передней брюшной стенки отмечается наличие опухолевых эмболов в сосудах венозного типа. В гепатоцитах выявлены признаки дистрофии, в синусоидных капиллярах диффузно располагается большое число лимфоцитов. В почке определяются признаки дистрофии эпителия извитых канальцев, в сосудах мелкого калибра наблюдаются фибриновые тромбы и стаз.
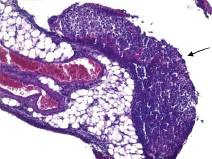 а)
а) 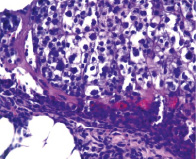 б)
б)
Рис. 1. Сальник с узлом карциномы (указан стрелкой), окраска гематоксилином и эозином. а) ок. ×10, об. ×10; б) ок. ×10, об. ×10
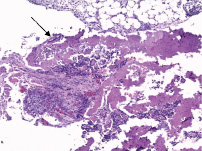 а)
а) 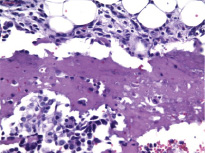 б)
б)
Рис. 2. Сальник с некрозом опухолевой ткани (указан стрелкой), окраска гематоксилином и эозином. а) ок. ×10, об. ×10; б) ок. ×10, об. ×10
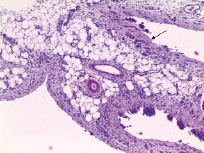
Рис. 3. Сальник после лечения АВХД с участками зрелой грануляционной ткани (указана стрелкой), окраска гематоксилином и эозином. Ок. ×10, об. ×10
Таким образом, проведение АВХД на 5 сутки экспериментального перитонеального канцероматоза привело к развитию частичного регресса опухолевого процесса с уменьшением объема опухолевой ткани в брюшной полости и значительному снижению активности воспалительного процесса, что в совокупности привело к увеличению продолжительности жизни лабораторных животных. Однако сохранился метастатический процесс (метастаз в лимфатический узел и опухолевые эмболы в сосудах), также вносящий вклад в опухолевую интоксикацию с развитием дистрофии паренхиматозных органов.
Работа выполнена в рамках темы государственного задания, № госрегистрации АААА-А18-118112890037-9.
Библиографическая ссылка
Крыжановская Е.А., Юкина Г.Ю., Беляев М.А., Захаренко А.А., Рыбальченко В.А., Томсон В.В., Сухорукова Е.Г., Палтышев И.А., Вервекин И.В. МОРФОЛОГИЧЕСКАЯ ОЦЕНКА ВОЗДЕЙСТВИЯ АЭРОЗОЛЬНОЙ ВНУТРИБРЮШИННОЙ ХИМИОТЕРАПИИ ПОД ДАВЛЕНИЕМ НА КАРЦИНОМУ У КРЫС // Международный журнал прикладных и фундаментальных исследований. 2019. № 7. С. 46-50;URL: https://applied-research.ru/ru/article/view?id=12797 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12797

