Как известно, среди производных карбоновых кислот галогенангидриды имеют наибольшее значение [1]. Ацилгалогениды, ацилхлориды в частности, используются в качестве промежуточных полупродуктов в органическом синтезе. Применение хлоридов фосфора для синтеза хлорангидридов карбоновых кислот, в частности гидроксибензойных кислот, сопряжено с рядом технологических трудностей [2]. Взаимодействие ароматических гидроксикислот с хлористым тионилом [2, 3] дает наиболее высокие выходы хлорангидридов до 89 % при проведении реакции в присутствии каталитических количеств ДМФА или пиридина. Недостатком этого метода являются повышенные требования к качеству хлористого тионила. Хлористый тионил рекомендуется дополнительно очищать. Необходим тщательный контроль температурного режима (около 30 °C, мягкое кипение), снижение или повышение температуры ведет к негативным последствиям. Зачастую избыток тионилхлорида удаляют отгонкой с получением целевого гидроксибензоилхлорида, который используют без дальнейшей очистки [4] во избежание дополнительного нагрева продукта. Для получения химически чистого гидроксибензоилхлорида требуется дополнительная многократная очистка, так как синтезированный с помощью тионилхлорида гидроксибензоилхлорид содержит 1–2 % серосодержащих примесей, образующихся вследствие химического взаимодействия хлористого тионила с фенольным гидроксилом гидроксибензойной кислоты. Это приводит не только к загрязнению целевых продуктов, что является существенным недостатком в процессах синтеза биологически активных веществ и лекарственных препаратов [5, 6], но и к существенному снижению выхода в многостадийных синтезах.
Цель исследования: синтезировать гидроксибензоил хлориды высокой чистоты без снижения выхода целевых веществ и, далее, на их основе получить новые биологически активные N-гидроксибензоил дипептиды и их водорастворимые калиевые соли.
Материалы и методы исследования
Перечисленных выше недостатков позволил избежать способ получения хлорангидридов карбоновых кислот взаимодействием оксалилхлорида с кислотами [2], однако применение этого метода для получения хлорангидридов гидроксибензойных кислот и их амидов с аминокислотами в литературных источниках не описано. Нами впервые применен этот способ в синтезе хлорангидридов 2–, 3– и 4–гидроксибензойных кислот и их функциональных производных (схема).
Процесс осуществляли при молярном соотношении реагентов гидроксибензойная кислота : оксалилхлорид : диметилформамид, равном 1:1,1:0,07 в бензоле, при нагревании до температуры кипения растворителя.
N-ацилированные дипептиды на их основе гидроксибензоил хлоридов получены по методике, описанной в [5]. ЯМР 1H записаны на спектрометре «Bruker DRX500», с рабочей частотой 500 МГц, растворитель ДМСО-d6. Температуры плавления определяли капиллярным методом на приборе Stuart SMP-30 при скорости нагрева 10 град/мин.
Общая методика синтеза 4-(гидроксибензоиламино)бутирил хлоридов. К раствору 20 ммоль 4-(гидроксибензоиламино)бутановой кислоты в 50 мл безводного бензола при перемешивании постепенно прибавляли 60 ммоль оксалил хлорида и 0.2 мл N,N-диметилформамида. Смесь кипятили 1 ч. Выпавший после охлаждения смеси до комнатной температуры осадок хлорангидрида отфильтровывали, промывали холодным гексаном и высушивали.
4-(Салицилоиламино)бутирил хлорид выделяли в виде белого кристаллического вещества. Выход 4.35 г (90 %), т. пл. 56 °С. Содержание активного хлора: вычислено, %: Cl 14.67; найдено, %: Сl 14.67.
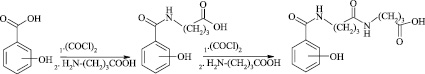
Синтез производных 4-[(4`-гидроксибензоиламино)бутаноиламино]бутановых кислот
Общая методика синтеза 4-[(4`-гидроксибензоиламино)бутаноиламино]бутановых кислот и их калиевых солей. К смеси 20 мл воды, 10 ммоль гамма-аминомасляной кислоты и 25 ммоль NaOH при перемешивании и охлаждении присыпали 10 ммоль 4-(гидроксибензоиламино)бутаноил хлорида, контролируя рН среды (рН>7). Смесь перемешивали 3 ч, подкисляли НСl и образовавшийся осадок отфильтровывали и перекристаллизовывали из этанола.
4-[(4'-Салицилоиламино)бутаноиламино]бутановой кислоты в виде белого кристаллического вещества. Выход 2.34 г (76 %), т. пл. 257 °С. Rf = 0.35 (хлороформ–этилацетат = 1:2). Спектр ЯМР 1Н, δ, м.д. (J, Гц): 9.84 с (1H, OH), 8.35 с (1H, COOH), 7.62 д (1H, Ph), 7.25 с (1H, NH), 7.35-7.27 м (2H, Ph, J 6.3 Гц), 6.93д (1H, Ph), 4.69 с (1H, NH), 3.32-3.16 м (4H, 2CH2, J 12.7 Гц), 2.32–2.13 м (4H, 2CH2, J 9.6 Гц), 1.89–1.68 м (4H, 2CH2, J 7.8 Гц). Найдено, %: С 58.40, Н 6.53, N 9.1. С15Н20N2O5. Вычислено, %: С 58.43, Н 6.54, N 9.09.
Затем в реакторе смешивают 10 ммоль 4-[(4'-гидроксибензоиламино)бутаноиламино]бутановой кислоты, 20 ммоль этилата калия и 50 мл бензола, перемешивают при кипении в течение 30 мин. После охлаждения продукт отделяют фильтрованием, промывают небольшим количеством бензола и сушат.
Дикалиевая соль 4-[(4'-гидроксибензоиламино)бутаноиламино]бутановой кислоты получена с выходом 97 %. Т пл.= 302 °С с разложением. С15Н18К2N2О5: вычислено, %: С 46.85, Н 4.72, К 20.34, N 7.29; найдено, %: С 46.82, Н 4.73, К 20.31, N 7.30.
Определение нейропротекторного действия веществ при недостаточности мозгового кровообращения, вызванного необратимой двусторонней окклюзией общих сонных артерий у крыс. Исследование выполняли на половозрелых беспородных крысах-самках 180–200 г, 3,5–4-месячного возраста, доставленных из питомника ФГУП ПЛЖ «Рапполово» (д. Рапполово, Ленинградская область). Все животные после транспортировки из питомника содержали в стандартных условиях вивария с 12 ч/12 ч свето/темновым циклом, температурой воздуха 20 ± 2 °С и влажностью 40–60 % и проходили двухнедельный карантин, по окончании которого включались в исследование.
В ходе выполнения экспериментов были сформированы следующие группы:
1) ЛО (ложнооперированные) – животные, получавшие физиологический раствор, но лигатуры не затягивали;
2) контроль – животные, получавшие физиологический раствор и которым недостаточность мозгового кровообращения вызывали путем одномоментной двусторонней окклюзии общих сонных артерий (ОСА);
3) исследуемое соединение – животные, которым также перевязывали ОСА, но получавшие изучаемое соединение в дозе 38 мг/кг внутрибрюшинно (профилактически однократно за 30 мин до перевязки и далее начиная с третьего дня после операции каждые 24 ч в течение трех дней;
4) пирацетам – животные, которым перевязывали ОСА, но получавшие пирацетам в дозе 800 мг/кг внутрибрюшинно (в том же режиме, что и тестируемое соединение).
Операционные вмешательства выполнялись с использованием хлоралгидрата (в дозе 400 мг/кг). Для оценки нейропротекторного действия патентуемого соединения при недостаточности мозгового кровообращения использовали модель одномоментной необратимой билатеральной окклюзии ОСА. Статистическую обработку данных проводили с помощью пакета прикладных программ Microsoft Excel и BioStat 2008 5.2.5.0. с использованием критерия Манна – Уитни, точного критерия Фишера. О нейропротекторном действии соединения судили по увеличению выживаемости животных после двусторонней ОСА и уменьшению у них выраженности неврологического дефицита по шкале McGraw, когнитивных нарушений в тестах «Условная реакция пассивного избегания» (УРПИ) и «Экстраполяционного избавления» (ТЭИ) [5, 7].
Результаты исследования и их обсуждение
Впервые примененный способ в синтезе хлорангидридов 2–, 3– и 4–гидроксибензойных кислот позволил не только избежать недостатков способов, освещенных в литературных источниках, но и получить хлорангидриды гидроксибензойных кислот с выходами до 91 % с высокой степенью чистоты.
Таблица 1
Выживаемость животных с недостаточностью мозгового кровообращения, вызванного необратимой одномоментной билатеральной окклюзией общих сонных артерий (ОСА)
|
Группа животных |
N |
Выживаемость животных после ОСА, % |
||||
|
6 ч |
12 ч |
24 ч |
48 ч |
72 ч |
||
|
ЛО |
8 |
100 |
100 |
100 |
100 |
100 |
|
Контроль |
10 |
80 |
60* |
60* |
50* |
40* |
|
дикалиевая соль 4-[(4’-салицилоиламино)бутаноиламино)бутановой кислоты |
10 |
100 |
80 |
80 |
80^ |
80^# |
|
Пирацетам |
10 |
80 |
80 |
70 |
60* |
50* |
Примечание: N – количество животных в группе; ЛО – ложнооперированные животные; * – различия достоверны по сравнению с ЛО группой (p < 0,05); ^ – различия достоверны по сравнению с группой контроль-ишемия; # – различия достоверны по сравнению с группой, получавшей пирацетам (p < 0,05, Хи-квадрат).
Таблица 2
Результаты оценки неврологического дефицита по шкале McGraw (в баллах), тестов «условная реакция пассивного избегания» (УРПИ) и «экстраполяционного избавления» (ТЭИ), исследование животных в которых проводилось через 72 ч после окклюзии ОСА (M ± m)
|
Показатели |
Группы животных |
|||
|
ЛО |
Контроль |
дикалиевая соль 4-[(4'-салицилоиламино)бутаноиламино]бутановой кислоты |
Пирацетам |
|
|
Неврологический дефицит животных по шкале McGraw (в баллах) |
1,3 ± 0,1 |
6,7 ± 1,4* |
2,8 ± 1,2^ |
5,8 ± 1,4 |
|
ЛП захода в ТО в УРПИ |
180 |
74 ± 38,3* |
159,5 ± 16 |
123,6 ± 34,6 |
|
% незашедших животных в темный отсек в УРПИ |
100 |
25* |
75^ |
60 |
|
ЛП подныривания в ТЭИ |
15,8 ± 1,5 |
83,8 ± 34,1* |
24 ± 8,3 |
51,4 ± 32,2 |
Примечание: ЛП захода в ТО в УРПИ – латентный период (с) захода животных в темный отсек в УРПИ; КЗ в УРПИ – количество заходов одного животного в темный отсек в УРПИ; ЛП подныривания в ТЭИ – латентный период (с) подныривания в ТЭИ; ЛО – ложнооперированные животные; * – различия достоверны в сравнении с ЛО (р < 0,05); ^ – различия достоверны по сравнению с контрольной группой (р < 0,05).
Исследования биологической активности показали, что один из лидеров – дикалиевая соль 4-[(4'-салицилоиламино)бутаноиламино]бутановой кислоты – достоверно повышал (в среднем на 20–50 %) выживаемость крыс после перевязки ОСА по сравнению с группой контроля (контроль-ишемия), при этом случаи смерти среди животных данной группы наблюдались только в начальный период (с 6 до 12 ч) (табл. 1). Оказываемое им нейропротекторное действие превосходило таковое у пирацетама. При оценке неврологического дефицита по шкале McGraw отмечено, что у животных с перевязанными ОСА, получавшими соединение-лидер, неврологический дефицит был наименьшим среди всех исследуемых групп (табл. 2). При выполнении и анализе результатов тестов УРПИ и ТЭИ отмечено, что выжившим животным с ОСА, получавшим полученное соединение, в тесте ТЭИ требовалось меньшее время для решения задачи экстраполяционного избавления, а в тесте УРПИ в темную камеру заходило 75 % животных (в группе контроля 25 %), что свидетельствует о сохранении памятного следа, связанного с аверсивным воздействием.
Заключение
Высокий выход хлорангидридов гидроксибензойных кислот, их чистота, использование доступных исходных соединений и легкость оформления процесса обуславливают наибольшую технологичность предлагаемого способа синтеза гидроксибензоил хлоридов, что позволит получать N-гидроксибензоилацилированных пептидов с разным числом и последовательностью аминокислотных остатков. Синтезированные таким путем гидроксибензоилхлориды являются ценными полупродуктами в химии лекарственных препаратов. Учитывая, что дикалиевая соль 4-[(4'-салицилоиламино)бутаноиламино]бутановой кислоты увеличивает выживаемость животных и снижает выраженность неврологических нарушений, в том числе когнитивного дефицита, после окклюзии общих сонных артерий, заявленное соединение может найти применение при создании новых лекарственных средств для лечения нарушений мозгового кровообращения ишемического генеза.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (грант № 15-43-02445).
Библиографическая ссылка
Брель А.К., Лисина С.В., Будаева Ю.Н., Клочкова Е.А., Соколова С.В. АЦИЛХЛОРИДЫ ГИДРОКСИБЕНЗОЙНЫХ КИСЛОТ И ИХ АМИДОВ КАК ПОЛУПРОДУКТЫ В СИНТЕЗЕ N-АЦИЛИРОВАННЫХ ПЕПТИДОВ // Международный журнал прикладных и фундаментальных исследований. 2019. № 7. С. 141-144;URL: https://applied-research.ru/ru/article/view?id=12814 (дата обращения: 07.03.2026).

