Инфекция мочевой системы (ИМС) – распространенная бактериальная инфекция, объединяющая группу заболеваний, с ростом микроорганизмов в мочевой системе. Присутствие не менее 50 000 бактерий и более 25 лейкоцитов в 1 мкл мочи, полученной путем спонтанного мочеиспускания, являются положительным диагностическим признаком [1–3].
У детей ИМС является частой проблемой со здоровьем, причем заболеваемость лишь немного ниже по сравнению с болезнями органов дыхания и кишечной инфекцией. Постановка диагноза затруднена, особенно у детей раннего возраста. Клиническая картина данной возрастной группы часто имеет неспецифические клинические признаки, которые также обычно наблюдаются при многих острых вирусных заболеваниях у детей. Получение качественных проб мочи для анализа также вызывает сложность, поэтому не всегда возможно однозначно подтвердить диагноз. Несмотря на большое количество исследований, подходы к лечению и диагностике инфекции мочевых путей в раннем возрасте остаются противоречивыми [1, 4, 5].
Пиелонефрит – это неспецифическое бактериальное воспаление почечной паренхимы и собирательной системы почек, проявляющееся картиной инфекционного заболевания, особенно у детей раннего возраста, характеризующееся лейкоцитурией и бактериурией, а также нарушением функционального состояния почек [1, 4, 6]. Цистит – инфекция нижних отделов мочевой системы с бактериальным поражением слизистой мочевого пузыря и подслизистого слоя, сопровождающаяся нарушением его функции. Бессимптомная бактериурия – бактериурия свыше 105 колоний микроорганизмов в 1 мл мочи, полученной при свободном мочеиспускании из «средней» струи при отсутствии клинической картины заболевания. Асимптоматическая ИМС – патологически значимая бактериурия и лейкоцитурия без проявления специфических симптомов к болезни [3].
Уросепсис – острый процесс, развивающийся в результате попадания типичных для ИМП бактерий и их продуктов в кровь. Все формы, кроме сепсиса, могут быть острыми, хроническими и рецидивирующими [1, 7, 8].
Термин «хронический» можно использовать только в случае доказанной персистенции микробного присутствия. Хронический пиелонефрит (ПН) – редкое состояние, возникает в результате персистирующей инфекции после острого пиелонефрита и может привести к пионефрозу, ксаногранулематозному пиелонефриту (КГП) и рубцеванию почечной паренхимы с гипертонией и формированием почечной недостаточности. КГП является редким клиническим явлением у детей, поражающим <1 % случаев пиелонефрита. Как и пионефроз, КГП развивается в условиях хронической обструкции и инфекции. Верификация диагноза происходит почти исключительно у пациентов с серьезными анатомическими аномалиями, чаще всего у маленьких детей с пузырно-мочеточниковым рефлюксом [1, 9].
В норме моча и мочевые пути стерильны. Инфицирование происходит путем ретроградной инвазии бактерий из периуретральной области. У детей до года промежность и периуретральная область обычно колонизированы Escherichia coli, Enterobacteriaceae и Enterococcus. Периодически происходит временное проникновение бактерий в мочеиспускательный канал и мочевой пузырь. Периуретральная колонизация уменьшается после 1 года, и в возрасте старше 5 лет встречается довольно редко. Пациенты с анатомическими нарушениями мочевыводящих путей или имеющие функциональные проблемы с мочевым пузырем, стаз мочи, и / или наличие специфических бактериальных факторов вирулентности имеют повышенный риск развития симптоматической ИМС. По крайней мере, 80 % впервые приобретенных ИМС вызваны уропатогенными E. coli [10–12].
Ранняя диагностика и своевременное лечение ИМС играют важную роль в предотвращении прогрессирующего повреждения почек и снижения почечной функции. Предотвращение дальнейших рецидивов требует дальнейшего обследования для выявления урологических и почечных аномалий или дисфункции мочевого пузыря [13–15].
Цель исследования: исследовать частоту, особенности первичных и обструктивных пиелонефритов среди детей раннего возраста (до 3 лет).
Материалы и методы исследования
Под наблюдением находилось 152 детей в возрасте от 1 месяца до 3 лет, поступивших впервые на лечение в отделение нефрологии Областной детской клинической больницы г. Караганды в 2018 г., с диагнозом острый пиелонефрит (оПН).
Из 152 больных девочек было значительно больше – 106 (69,7 %) мальчиков – 60 (30,3 %) (р ≤ 0,05). Известно, что девочек среди пациентов с ИМС больше, к чему предрасполагают в первую очередь анатомо-физиологические особенности женского организма.
Диагноз «острый пиелонефрит» диагностирован всем детям впервые. Но при обследовании эти больные разделены на 2 группы. В первую группу определены пациенты с пиелонефритом, у которых была исключена вторичность ИМС, то есть у этих детей при обследовании не было выявлено каких-либо урологических аномалий/пороков со стороны органов мочевыделения, всего этих детей – 121. Во вторую группу вошли пациенты (31 человек), у которых при обследовании выявили врожденные пороки развития (ВПР), и у этой группы пациентов диагноз «острый пиелонефрит» заменен на диагноз хронический (или обструктивный) пиелонефрит, согласно международным критериям постановки диагноза для пациентов с ИМС [3, 4, 13].
Результаты исследования и их обсуждение
Чаще всего фебрильная ИМС (острый пиелонефрит) возникает в возрасте до 1 года как у детей с обструкцией (45,3 %), так и без нее (49,5 %).
Среди пациентов первой группы отягощающие факторы для развития ИМС отмечены у 39 (32,2 %), во второй группе – у 7 (22,5 %). Отягощающими факторами были болезни мочевыводящей системы у матерей: до беременности – у 4 женщин, во время беременности – у 5 женщин, у 4 – маловодие в период беременности, у 14 женщин – угроза прерывания беременности, у 3 – длительный безводный период, у 8 женщин – беременность протекала с отеками и/или с артериальной гипертензией, у 8 женщин отмечалась анемия различной степени тяжести в период беременности.
Клинические проявления острого пиелонефрита (фебрильной ИМС) в первой группе проявлялись в виде температурной реакции у 117 (96,7 %) детей, общеинтоксикационного синдрома – у 106 (87,6 %), дизурических явлений – у 40 (33,1 %), болевого синдрома или его эквивалента – у 25 (20,7 %) детей. Клинические проявления пиелонефрита во второй группе в виде температурной реакции у 19 (61,5 %), симптомов интоксикации – у 16 (76,2 %), болевого синдрома – у 5 (16,1 %), дизурий – у 4 (12,9 %). Можно отметить, что клинические проявления у детей с вторичными пиелонефритами несколько стерты, «бедны», в сравнении с детьми, у которых пиелонефрит развился без участия врожденного порока. Также определено, что у 12 (9,9 %) детей первой группы температурная реакция держалась на фоне патогенетической антибактериальной температуры более 5 дней, в то время как подобного симптома среди пациентов второй группы нами отмечено не было. При этом фебрильные судороги отмечались у 7 (5,8 %) детей (рис. 1).
Как правило, в обеих группах заболевание возникало на фоне полного здоровья (124 случая – 81,6 %), реже – после перенесенной ОРВИ (15 – 12,4 %), пневмонии (2 – 1,6 %), переохлаждения (3 – 2,5 %), гнойной ангины и парапроктита (по 1 случаю – по 0,8 %), после вакцинации АКДС (2 – 1,6 %). 14 детей (11,6 %) были переведены из инфекционной больницы, куда поступили с клиническими проявлениями острой кишечной инфекции, но при обследовании у них выявлен характерный мочевой синдром, свидетельствующий о наличии активного воспалительного процесса в органах мочевыделения.
Лейкоцитурия была у 99 (81,8 %) детей первой группы. Протеинурия от 0,03 до 2,72 г/л определялась у подавляющего большинства больных – у 98 (80,9 %) больных первой группы и в меньшей степени – у 18 (58 %) второй группы (р ≤ 0,05). Гематурия, достаточно редкий симптом оПН, наблюдался у 5 (4,1 %) пациентов первой группы и у 1 (3,2 %) пациента второй группы. Бактериурия определялась у 114 (94,2 %) в первой группе, но у 6 – бактериологические посевы мочи оказались отрицательными (рис. 2).
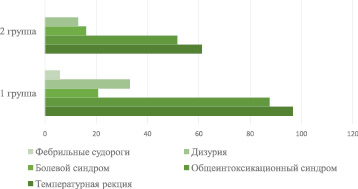
Рис. 1. Клинические проявления пиелонефрита у детей
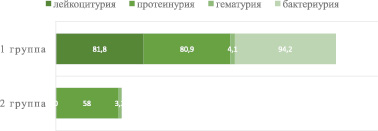
Рис. 2. Показатели мочевого синдрома у обследуемых детей
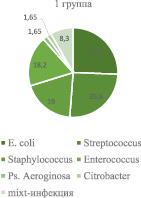
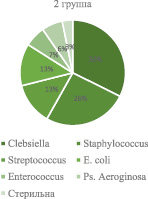
Рис. 3. Распределение результатов выявленных в моче возбудителей
Примечательно, что у тех больных бактериурия могла не сопровождаться лейкоцитурией, но проявлялась клинико-лабораторным комплексом, характерным для острого пиелонефрита. В большинстве случаев бактериурия была диагностически значимой и чаще всего в первой группе определялась E. coli у 32 (26,4 %), микроорганизмы рода Streptococcus – 32 (26,4 %), Staphylococcus – 24 (19,8 %), Enterococcus – 23 (19,0 %), Citrobacter – 2 (1,6 %), Ps. Aeroginosa – 2 (1,6 %), у 12 (9,9 %) – отмечалась mixt-инфекция. Во 2-й группе определялись Clebsiella у 10 (32,2 %), Staphylococcus – 8 (25,8 %), Streptococcus – 4 (12,9 %), E .coli – 4 (12,9 %), Enterococcus – 2 (6,4 %), Ps. Aeroginosa – 2 (6,4 %) и у одного (3,2 %) больного моча была стерильной (рис. 3).
Активность воспалительного процесса оценивали по количеству лейкоцитов, нейтрофильных гранулоцитов и скорости оседания эритроцитов в периферической крови. Так у 113 (93,4 %) детей первой группы отмечалось ускоренное СОЭ от 17 до 68 мм/ч и/или лейкоцитоз от 13*109 до 35*109 со сдвигом лейкоцитарной формулы – у 95 (78,5 %). У больных 2-й группы ускоренное СОЭ определялось сравнительно реже – у 15 (41,9 %) (р ≤ 0,01), нейтрофильный лейкоцитоз – у 13 (41,9 %) (р ≤ 0,05). Анемия легкой степени тяжести определялась у детей первой группы – у 38 (31,4 %), средней степени тяжести – у 18 (14,9 %), тяжелая степень – у одной (0,8 %) девочки. Во второй группе анемия легкой степени тяжести была у 10 (32,3 %), средней степени тяжести – у 5 (16,2 %). Скорость клубочковой фильтрации (СКФ) была снижена у 81 (66,9 %) ребенка первой группы и у 27 (87,1 %) детей второй группы (р ≤ 0,05).
Всем больным с целью диагностики анатомических аномалий проведено ультразвуковое исследование органов мочевыделения и в случае подозрения врожденного порока развития были проведены соответствующие рентгенурологические исследования (экскреторная урография и микционная цистография) [6, 14]. Результаты этих исследований и были основанием для разделения детей по группам. В первой группе, как уже говорилось, данных за врожденный порок развития со стороны органов мочевой системы не было. Во второй группе были выявлены следующие состояния: пузырно-мочеточниковый рефлюкс I–III ст. – у 8 (25,9 %) пациентов, пузырно-мочеточниковый рефлюкс IV–V ст. – у 5 (16,1 %), уретерогидронефроз – у 6 (19,3 %), гидронефротическая трансформация почки – у 3 (9,7 %), удвоение почки – у 3 (9,7 %), мочекаменная болезнь – у 2 (6,4 %), агенезия почки – у 2 (6,4 %) и по одному (3,2 %) случаю мультикистозной почки и обструктивного мегауретера.
Заключение
Таким образом, у детей раннего возраста острый пиелонефрит в каждом четвертом случае (у 20,4 %) возникает на фоне ВПР органов мочевыделения. Конечно, с возрастом частота пороков развития к общему числу пациентов с пиелонефритом будет значительно меньше и больные с ВПР органов мочевыделения диагностируются не иначе как хронический и/или обструктивный пиелонефрит. Почти половина случаев врожденных пороков диагностируются в возрасте до года. Диагностика ВПР со стороны органов мочевыделения в подавляющем большинстве случаев происходит только при наслоении клинических показателей острого пиелонефрита. Острый пиелонефрит без ВПР чаще диагностируется у девочек, врожденные пороки развития – чаще у мальчиков, что согласуется с литературными данными [3, 4, 12]. Клинические проявления у детей с вторичными пиелонефритами несколько стерты, «бедны», в сравнении с детьми, у которых пиелонефрит развился без ВПР. Клинические проявления вторичного пиелонефрита особо не отличаются от клинических проявлений пиелонефрита без ВПР органов мочевыделения. У больных вторичным пиелонефритом реже выделяется E. coli (р ≤ 0,05), чаще Clebsiella, которая не определялась у пациентов без ВПР (р ≤ 0,001), что также согласуется с данными литературы [9, 12, 15]. СКФ чаще снижена у детей с пороками развития, чем у детей без пороков (р ≤ 0,05).
Выражаем благодарность профессору д.м.н. Б.А. Абеуовой за подготовку и помощь над нашей работой.
Библиографическая ссылка
Ребрик И.С., Тракс О.В. ОСТРЫЙ ПИЕЛОНЕФРИТ У ДЕТЕЙ РАННЕГО ВОЗРАСТА // Международный журнал прикладных и фундаментальных исследований. 2019. № 8. С. 76-80;URL: https://applied-research.ru/ru/article/view?id=12829 (дата обращения: 08.03.2026).

