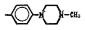
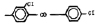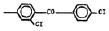В настоящей работе приводятся сравнительные экспериментальные данные протонофорного и энерготропного молекулярного действия соединений фенольного ряда из класса замещенных салицианилидов (ЗСА) на искусственных БЛМ и нативных мембранах Мх печени крыс. Предпосылкой настоящих исследований являлось наличие протонов в гидроксильных группах их химической структуры, способствующих разобщающему эффекту ЗСА, а также высокий коэффициент распределения мембрана/среда, свидетельствующий о мембранотропности этих препаратов. Препараты ЗСА и аспирин являются различными производными салициловой кислоты (СК), проявляющей по нашим данным разобщающие свойства. Химическая структура СК представляет собой бензол, у которого имеются гидроксильная ОН-группа и карбоксильная СООН-группа в качестве заместителей. В структуре аспирина (ацетилсалициловая кислота) протон гидроксильной группы замещен ацетильной группой. СК и аспирин являются нестероидными противовоспалительными препаратами. СК оказывает сосудосуживающее, противовоспалительное действие, применяется наружно для лечения различных кожных заболеваний, входит в состав многих комбинированных средств (випросала, камфоцина, лориндена А). Аспирин в течение многих лет применяется в медицине как жаропонижающий, обезболивающий, противовоспалительный и противоревматический препарат, терапевтическое действие которого обусловлено ингибированием синтеза простагландинов, образующихся при воздействии различных факторов (гормональных, травматических, воспалительных, аллергогенных). При меньших концентрациях (< 325 мг) как антиагрегант, препятствующий тромбообразованию в результате ингибирования циклооксигеназы тромбоцитов, он входит в состав различных фармакологических препаратов – упсарин, кардиомагнил, тромбо АСС. Исследованные автором ЗСА являются анилидами салициловой кислоты, в которой гидроксил карбоксильной группы замещен фениламидной группой, имеются галогенные заместители и дополнительные бензольные кольца. Научный интерес к салициланилидам обусловлен тем, что они также применяются в медицинской практике. Препараты тегалид, никлозамид, рафоксанид, клозантел оказывают противопаразитарное действие, нарушая энергетический обмен и передачу нервного импульса фасциол [1]. Имеются изобретения, в которых представлены доказательства противопаразитарной активности у салициланилидов и их производных [2]. Механизмом этой активности является специфическое ингибирующее действие препарата на нервную, гуморальную и внутриклеточную регуляцию [2], разобщающее – на Мх паразита [3]. Разобщение окислительного фосфорилирования (ОФ) АДФ и дыхания в Мх гельминтов, улиток и опухолевых клеток с помощью ЗСА, показанное зарубежными авторами на примере никлозамида [4], было обнаружено нами ранее [3, 5]. Показана активность препарата никлозамида в отношении опухолей и опухолевых стволовых клеток [4]. Нами были представлены доказательства специфической протонофорной разобщающей эффективности ЗСА и двухосновных кислот (ДОК) на нативных мембранах Мх фасциол как молекулярного механизма их фасциолоцидной эффективности, поскольку указанные активности коррелировали [3, 5, 6]. Ранее полагали, что разобщители ОФ (РОФ) являются клеточными ядами, однако нами выявлено их избирательное бактерицидное, фунгицидное [3], радиозащитное [7, 8] действие в низких концентрациях, ЗСА с подобной активностью применяются в медицинских препаратах, например цинкундам и тегалид соответственно. Возможно фунгицидное действие СК у пшеницы за счет образования перекиси водорода [9].
Цель работы: определение эффективности и молекулярного механизма действия препаратов из класса ЗСА на БЛМ и Мх, в соответствии с которой были поставлены следующие задачи:
1) исследовать влияние ЗСА на протонную проводимость БЛМ;
2) исследовать действие ЗСА на дыхание, процессы ОФ и эффективность запасания энергии в Мх печени крыс;
3) провести сравнительный анализ активности соединений ЗСА на БЛМ и Мх;
4) определить связь химической структуры препаратов с их действием на мембранные системы;
5) выявить структурные перестройки и изменения микровязкости мембран при действии ЗСА с помощью флуоресцентных зондов.
Материалы и методы исследования
Бислойные липидные мембраны (БЛМ) формировали по методу Мюллера из н-деканового раствора обших липидов бычьего мозга с концентрацией 20 мг/мл на отверствии тефлонового стаканчика диаметром 1 мм. Зависимость электропроводности мембран (Gm) от концентрации модификаторов измерялась в водной среде с 20 мМ трис-буфером. Gm мембран в зависимости от рН при добавлении препарата ЗСА исследовалась в забуференной среде, содержащей 20 мМ цитрат, фосфат, борат калия или натрия. При измерениях Gm на мембрану подавалось постоянное напряжение 20 мв. Gm БЛМ определяли путем сравнения падения напряжения на БЛМ и на известном сопротивлении. Напряжение сравнения увеличивалось с помощью усилителя постоянного тока У5-6 с большим входным сопротивлением 1012 ом и регистрировалось автоматическим электронным потенциометром КСП-4, подключенным к выходу усилителя.
Митохондрии (Мх) выделяли методом дифференциального центрифугирования из печени крыс линии Вистар весом 150–180 г. Для изучения влияния препаратов на скорость дыхания использовали Мх в состоянии 4 с высоким дыхательным контролем, равным 4–5. Скорость дыхания Мх определяли по скорости уменьшения содержания кислорода в среде инкубации. Содержание кислорода определяли полярографическим методом в ячейке объемом 1 мл. Использовали среду инкубации следующего состава: 241 мМ сахароза, 20 мМ сукцинат натрия, 1 мМ ротенон, 1 мМ фосфат калия, 2 мМ хлорид магния, 1 мМ ЭДТА, 56 мМ трис-НСl, рН 7,5. Содержание Мх в ячейке составляло от 2–3 до 8 мг белка/мл по методу Лоури. Установка собрана на основе полярографа Lp-7 с самописцем EZ-7.
Антиоксидантная активность измерялась по длительности латентного периода и амплитуде медленной вспышки хемилюминесценции Fe2+ в среде с 20 мМ трис-НСl, рН 7,5 и липосомами из общих фосфолипидов печени крыс в концентрации 1 мг/мл при добавлении исследованных соединений ЗСА. Опыты проводили при температуре 22 ± 1 °С.
Микровязкость мембран теней эритроцитов. В суспензию теней эритроцитов (150 мкг/мл белка) добавляли вначале исследуемое соединение ЗСА, а затем флуоресцентные зонды 2,6-ТНС, ДМХ для исследования структурных перестроек или ДФГТ для измерения микровязкости мембран. Концентрация зондов, вводимых в образцы, была для 2,6-ТНС 5–10 мкМ, для ДФГТ и ДМХ – 0,15 мкМ. Исследования проводили в 15 мМ фосфатном буфере, рН 7,4. Спектры флуоресценции зондов регистрировали на спектрофлуориметре MRF-44B, Perkin-Elmer (США). Время инкубации препарата и зондов ТНС, ДМХ 20 мин, ДФГТ – 1,5–2 ч. Все зонды были фирмы Fluca и Serva, они не взаимодействовали с препаратами.
Тени эритроцитов из крови крыс линии Вистар получали по методу Доджа. Для предотвращения сворачивания кровь животных собирали в большом объеме охлажденного до 2–4 °С физраствора (антикоагулянты не добавляли), гемолиз эритроцитов проводили в среде с 1 мМ ЭДТА, после чего тени эритроцитов трижды отмывали физраствором. Концентрация белка в опытах с флуоресцентными зондами была равна около 150 мкг/мл.
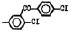
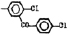
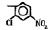
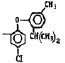
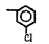
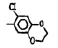
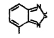
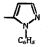
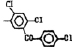
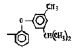
Исследованные соединения. В работе было исследовано 16 соединений из класса ЗСА, являющихся аналогами известного противофасциолезного препарата тегалида и отличающихся от него галогенными (I, Br, Cl) и метильными СН3 заместителями, а также ОН, NH или СООСН3-группами и количеством бензольных колец. Препараты были синтезированы в Институте медицинской паразитологии им. Е.И. Марциновского (г. Москва) проф. Ф.С. Михайлицыным с учетом наших рекомендаций, автор выражает благодарность за любезное безвозмездное предоставление ЗСА для экспериментальных исследований. Выбор растворителя ДМСО обусловлен хорошей липофильностью [10] и растворимостью в нем препаратов ЗСА. При исследовании влияния препаратов на Gm БЛМ и дыхание Мх объем ДМСО в среде не превышал 2 %. Все исследованные препараты были марки х.ч. или о.с.ч. Статистическая обработка результатов исследований проводилась по критерию Стьюдента. Различия считались значимыми при р < 0,05. Структура и шифры ЗСА приведены в таблице.
Результаты исследования и их обсуждение
Влияние соединений ЗСА на электропроводность (Gm) бислойных липидных мембран (БЛМ)
Специфическая химическая структура исследуемых препаратов из класса ЗСА, отличавшаяся наличием ОН-группы во втором положении первого бензольного кольца, позволила предположить, что такие соединения могут переносить протоны через искусственные и нативные мембраны. Это предположение было подтверждено в экспериментах на модельных БЛМ, в которых было показано, что ЗСА способствуют возрастанию Gm мембран при увеличении концентрации препарата в ячейке (рис. 1) [11]. При концентрации 10-5 М для большинства исследованных препаратов величины Gm достигали максимальных значений, которые далее не изменялись: препараты Г-970 и Г-1057 увеличивали Gm на 1–2 порядка, Г-947, Г-882, Г-992 – на 3–4 порядка, а активные протонофоры Г-1021, Г-1024, Г-1028, Г-986, Г-988 и тегалид – на 5–6 порядков. Растворитель ДМСО (2 % в пробе) незначительно увеличивал Gm – от 2,7•10-9 до 6,2•10-9 См/см2.
На рис. 1, а, видно, что некоторые препараты (Г-944, Г-970, Г-1057, кривые 1, 5, 6) слабо увеличивали Gm БЛМ, другие соединения ЗСА (Г-1032, Г-947, Г-882, Г-1024, кривые 2-4,7) – существенно. Из сравнения активности препаратов Г-1057 и Г-1032 (кривые 1, 2), сходных по структуре, но отличающихся наличием гидроксильной группы ОН, видно, что эффективность Г-1032 с ОН-группой на 2 порядка выше, чем у препарата Г-1057, содержащего карбоксиметильную группу вместо активной гидроксильной в основном бензольном кольце. Для проявления активности соединений ЗСА на БЛМ важным было наличие в их структуре галогенных заместителей в основном бензольном кольце, расположенных вблизи от ОН-группы и способствующих диссоциации ее протона. Так, препарат Г-889 (№ 16, таблица), содержащий ОН-группу, но не имеющий таких заместителей, оказывается практически неэффективным, даже при добавлении в среду высоких концентраций Г-889 Gm БЛМ увеличивалась менее чем на порядок. Влияние галогенных заместителей на Gm БЛМ было различным. Роль заместителя брома в увеличении активности препарата можно проследить при сравнении близких аналогов Г-882 и Г-1032 (рис. 1, а, кривые 4 и 2). В формуле Г-882 в третьем и пятом положении бензольного кольца имеются два иона брома. За счет этих заместителей препарат уже при концентрации 10-7 М увеличивает Gm на 1,5 порядка, в то время как Г-1032, имеющий в качестве заместителей ион хлора и метильную группу – лишь на полпорядка, это различие на порядок сохраняется и при более высоких концентрациях (до 10-4 М). Тегалид, имеющий ионы Br- в качестве заместителя в положении R2 в первом бензольном кольце (рис. 2, б), также намного активнее на БЛМ по сравнению с препаратом Г-1028 сходной структуры (рис. 1, б, кривая 4), имеющим ион Cl- (их максимальная электропроводность более 10-2 и 10-3 См/см2 соответственно). Показана также возможность аминогруппы в первом бензольном кольце молекулы препарата Г-1024 индуцировать Gm БЛМ за счет ее диссоциации, Gm увеличивалась за счет заместителей – ионов иода, и была высокой (рис. 1, а, кривая 7). Препараты Г-947 и Г-970, содержащие амфотерную гетерогенную пятичленную имидазольную и пиразольную группировку с двумя атомами азота, проявляли низкую активность. Мы полагаем, что низкие значения Gm БЛМ могут быть связаны со способностью этих группировок к образованию прочных межмолекулярных водородных связей, в том числе с атомами водорода ОН-групп, от которых зависит протонофорный молекулярный механизм активности соединений ЗСА на мембранных системах. Препарат Г-944 (рис. 1, а, кривая 5) индуцировал низкую Gm БЛМ, связанную с наличием гетерогенного кольца с двумя атомами кислорода (токсического соединения 1,4-диоксана), сопряженного со вторым бензольным кольцом. Следует отметить, что зависимость Gm БЛМ от концентрации препаратов, представленных на рис. 1, а, за исключением мало активных препаратов Г-1057 и Г-970 (кривые 1 и 6), является линейной. Это указывает на то, что протон, очевидно, переносится по механизму подвижного переносчика мономерного варианта (А-), описанному Е.А. Либерманом и др. (1968), согласно которому протон Н+ проходит через бислой в виде нейтрального комплекса с отрицательно заряженной молекулой разобщителя, которая возвращается во внешний, положительно заряженный отсек с митохондриями.
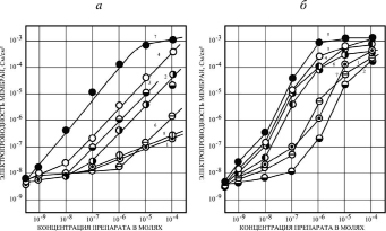
Рис. 1. Зависимость электропроводности БЛМ из ОЛБМ (20 мг/мл в н-декане) от концентрации некоторых ЗСА. Среда – 20 мМ трис-НСl, рН 7.5, t = 22 °С: а) 1 – Г-1057, 2 – Г-1032, 3 – Г-947, 4 – Г-882, 5 – Г-944, 6 – Г-970, 7 – Г-1024. б) 1 – Г-1033, 2 – Г-1037, 3 – 1021, 4 – Г-1028, 5 – Г-988, 6 – Г-986, 7 – Г-992
Химические структуры и шифры исследованных соединений ЗСА 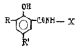
|
№ п/п |
Препарат, шифры |
ОН- |
R |
R1 |
Мол. вес |
Радикал Х |
|
1 |
Тегалид |
ОН |
Br |
Br |
544,4 |
|
|
2 |
Г-1028 |
ОН |
Br |
Cl |
498,5 |
|
|
3 4 |
Г-1032 Г-1057 |
ОН СООСН3 |
СН3 СН3 |
Cl Cl |
341,0 383,0 |
|
|
5 6 7 |
Г-1033 Г-1037 Г-988 |
ОН ОН ОН |
Br - I |
Cl Сl I |
509,0 430,0 647,6 |
|
|
8 |
Г-882 |
ОН |
Br |
Br |
405,5 |
|
|
9 |
Г-944 |
ОН |
Br |
Br |
463,5 |
|
|
10 |
Г-947 |
ОН |
- |
Cl |
305,8 |
|
|
11 |
Г-970 |
ОН |
Br |
Br |
461,0 |
|
|
12 |
Г-986 |
ОН |
Br |
Br |
578,5 |
|
|
13 |
Г-1021 |
OH |
Br |
Br |
544,0 |
|
|
14 |
Г-992 |
ОН |
Cl |
Cl |
430,3 |
|
|
15 |
Г-1024 |
NH |
I |
I |
636,0 |
|
|
16 |
Г-889 |
ОН |
– |
– |
311,0 |
|
На рис. 1, б, представлены данные электропроводности искусственных мембран для других препаратов ЗСА, у которых в структуре имеются два дополнительных бензольных кольца, способствующих более высокой растворимости в липидах и, соответственно, проявлению их мембранотропной активности по увеличению Gm БЛМ. Сравнение препаратов сходной структуры, отличающихся двумя заместителями иода (Г-988) и хлора (Г-992) в первом бензольном кольце, выявляет более высокую Gm БЛМ, индуцированную Г-988. Из сравнения Gm БЛМ, индуцированной препаратами Г-1033, Г-1037, Г-988, Г-992 сходной структуры, можно было сделать вывод о том, что эффективность действия ЗСА на Gm БЛМ возрастает с увеличением количества галогенных заместителей в первом бензольном кольце, зависит от их вида и места расположения в этом кольце. Активность всех исследованных ЗСА (рис. 1, а, б) зависела от галогенных заместителей: I- > Br- > Cl- > СН3. Для ЗСА, показанных на рис. 1, б, и тегалида (рис. 2, б) наблюдалась квадратичная зависимость Gm БЛМ от концентрации препарата в среде, характерная для механизма димерного варианта трехстадийного переноса протонов через мембраны, он был предложен Ли и Крогхен (1969), позднее проанализирован в докторской диссертации Л.Н. Ермишкина (1979), согласно которому протон через мембрану переносит димер НА2--, образующийся на границе мембрана/раствор из анионной (А-) и незаряженной (НА) форм протонофора. Димеризация понижает борновскую энергию, в результате увеличивается скорость и эффективность переноса протонов в водную фазу.
Природа электропроводности (Gm) БЛМ для ЗСА
Для выяснения природы ионной проводимости БЛМ, индуцируемой ЗСА, были поставлены опыты, в которых изучалось изменение Gm мембраны, модифицированной исследуемыми препаратами с различной активностью в зависимости от концентрации протонов в среде, т.е. от рН среды. Результаты опытов показали, что эта зависимость имеет куполообразную форму (рис. 2, а).
Тот факт, что изменение рН раствора приводит к изменению Gm БЛМ (рис. 2, а, б), модифицированной соединениями из класса ЗСА, указывает на то, что исследуемые препараты, за исключением препарата Г-1057, у которого ОН-группа заменена на карбоксиметильную СООСН3-группу, являются эффективными протонофорами. Правильность сделанного вывода подтверждает совпадение максимальных значений Gm БЛМ с ЗСА и максимальных величин их коэффициентов диссоциации рК, измеренных методом буферной емкости [3]. Величина Нернстовского потенциала при создании десятикратного градиента ионов водорода на БЛМ ΔV/ΔрН (мВ) в присутствии 10-5 М концентрации тегалида и других ЗСА, с которой наблюдалась максимальная Gm БЛМ, была 58 мв. Она также свидетельствовала о протонной природе Gm БЛМ, индуцированной этими препаратами, так и ЗСА другой группы [5] и ДОК, исследованными нами ранее [12].
Для суждения о возможной физиологической роли ЗСА в условиях in vivo нами были определены их коэффициенты диссоциации (рК), как в случае более ранних экспериментов с ДОК и классическими разобщителями ОФ [6]. Поскольку величины рК препаратов находятся в области физиологических значений рН 4,0–7,0, при которых была выявлена максимальная Gm БЛМ (исходная Gm БЛМ = 10-9 См/см2), индуцированная ЗСА, был сделан вывод о том, что эти соединения будут сохранять эту максимальную активность также и в условиях in vivo. Для некоторых ЗСА максимальные значения Gm наблюдались в несколько более широком интервале значений рН, для тегалида – 3,5–8,1 (рис. 2. б).
Действие ЗСА на дыхание митохондрий (Мх)
Экспериментальные данные, полученные на БЛМ, указывают на то, что исследуемые соединения ЗСА являются протонофорами, следовательно, согласно хемиосмотической гипотезе Митчела, они должны разобщать ОФ в Мх, шунтируя мембрану Мх по протону без участия АТФ-синтетазы, что приводит к снижению электрохимического потенциала, необходимого для синтеза макроэргических соединений АТФ. Нами было рассчитано высокое значение 350–400 мв потенциала и его уменьшение в зависимости от концентрации природных и синтетических РОФ [3]. Гипотеза объясняет синтез АТФ из АДФ и фосфата в процессе ОФ АТФ-синтетазой за счет трансмембранного градиента протонов, образующегося при выходе их из Мх и переносе электронов ферментами дыхательной цепи от субстратов окисления кислороду. Протонная помпа и АТФ-синтетаза Мх, участвующие в образовании энергии, находятся под гормональным контролем, участвуют в поддержании жизнедеятельности и обмене клетки с внешней средой веществами, энергией и информацией. На рис. 3 представлены результаты полярографических исследований ЗСА.
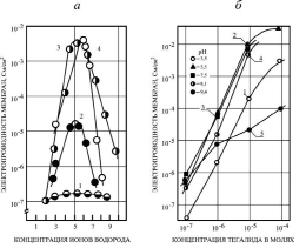
Рис. 2. а) Зависимость Gm БЛМ от рН среды. 1 – Г-1057 (10-5 М), 2 – Г-970 (10-4 М), 3 – Г-992 (10-5 М), 4 – Г-882 (10-4 М). Среда исследования: 20 мМ цитрат-фосфат-борат натрия, t = 20–24 °C. Препараты добавлялись по обе стороны мембраны. б) Зависимость Gm БЛМ от концентрации тегалида при различных значениях рН. Среда того же состава, что и на рис. 2, а
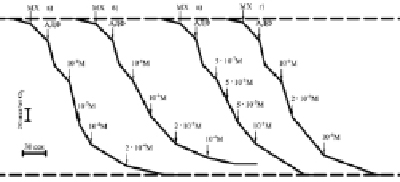
Рис. 3. Скорости потребления кислорода сопряженными митохондриями печени крыс при увеличении концентрации Г-970 (а), Г-1021 (б), Г-992 (в), Г-1032 (г), проводилось термостатирование ячейки (t = 22 °С)
При добавлении АДФ и ее фосфорилировании в АТФ скорость потребления кислорода (дыхания Мх) увеличивается в состоянии 3 (V3), а затем она снижается в состоянии 4 (V4) при исчерпании АДФ, их отношение (дыхательный контроль ДК) определяет степень сопряженности синтеза АТФ и дыхания, концентрация АДФ контролирует скорость дыхания. При последующем добавлении к Мх возрастающих невысоких концентраций 10-8–10-6 М ЗСА, представленных на рис. 3 (Г-970, Г-1021, Г-992, Г-1032) и в таблице, степень увеличения V4 уменьшалась, так как эффективность фосфорилирования АДФ снижается, исходя из уменьшающихся величин трансмембранного потенциала и ДК. Более высокие концентрации ЗСА 10-5–10-4 М снижали скорость дыхания Мх при полном снятии потенциала и торможении синтеза АТФ. Менее активные препараты ЗСА стимулировали дыхание Мх при более высоких концентрациях. Ингибирование скорости дыхания Мх ниже исходной в состоянии 4 было необратимым. Только малоактивный протонофор Г-889 без галогенных заместителей в первом бензольном кольце даже при наличии ОН-группы и относительно высоких концентрациях 10-5–10-3 М слабо стимулировал, но не ингибировал дыхание Мх. На основании данных рис. 3 были построены колоколообразные кривые зависимости скорости дыхания Мх от концентрации препарата в среде (не показано), представленные для тегалида (рис. 4, а), которые свидетельствовали о разобщающем действии ЗСА. В условиях in vivo [8] максимальное разобщение ОФ в Мх происходило через 0,25–1,5 ч после введения крысам ЗСА, а еще через 3–5 (максимально через 7–8) часов оно уже не наблюдалось, вероятно, при выведении препаратов из организма животных и в результате их антиоксидантного действия.
Сравнение протонофорной и разобщающей активности ЗСА
Нами было установлено, что концентрация препаратов ЗСА, приведенных на рис. 1, а, индуцирующая в БЛМ протонную проводимость 5•10-9 ом-1 см-2 в водной среде, равна концентрации, увеличивающей скорость дыхания Мх в 2 раза, таким образом для этих соединений была обнаружена корреляция между протонофорной и разобщающей эффективностью. Для большинства ранее исследованных нами и другими авторами одноосновных кислот (динитрофенол, трихлорфенол, пентахлорфенол, салициловая кислота, дикумарол), являющихся классическими разобщителями, указанные концентрации также равны [13]. При исследовании на БЛМ и Мх нами было выявлено неравенство вышеуказанных концентраций препаратов из другой группы ЗСА с двумя дополнительными бензольными кольцами и тегалида, для которых была выявлена не прямо пропорциональная (рис. 1, а), а квадратичная зависимость Gm БЛМ от концентрации препарата (рис. 1, б). Это ставило под сомнение правильность вывода из хемиосмотической гипотезы о механизме синтеза энергии и протонофорном механизме разобщающего действия препаратов ЗСА на Мх. Дальнейшие исследования показали, что номинальная концентрация тегалида СнМх в суспензии, при которой скорость дыхания Мх в 2 раза выше исходной (рис. 4, а), в 12 раз выше концентрации СвБЛМ этого препарата, индуцирующего в БЛМ протонную проводимость 5•10-9 ом-1 см-2 в водной среде (рис. 4, б). Для других ЗСА этой группы указанное различие составляло 20–60 раз. Нами было предположено, а затем экспериментально доказано, что неравенство этих концентраций и, следовательно, отсутствие корреляции между протонофорной и разобщающей эффективностью этих соединений из класса ЗСА обусловлено высокой растворимостью их в мембранах Мх и, соответственно, высоким коэффициентом распределения липид/среда и высокой их проводимостью через БЛМ. На примере тегалида получены данные сдвига вправо вдоль оси абсцисс кривой зависимости скорости дыхания Мх от его концентрации при увеличении концентрации белка Мх от 2 до 8 мг/мл из-за поглощения препарата митохондриями (рис. 4, а). Так, для полного ингибирования дыхания митохондрий, взятых в концентрации 2 мг/мл белка, необходимо 1,7•10-6 М тегалида в растворе, 6 мг/мл – 7,0•10-6 М, а 8 мг/мл – 8,0•10-6 М. Это справедливо также для стимулирующей скорость дыхания концентрации препарата. На рис. 4, б, кривая 1 зависимости протонной проводимости БЛМ от концентрации тегалида в среде в присутствии 2 мг/мл Мх также сдвинута вправо относительно кривой 2, полученной без добавления Мх в среду, что свидетельствует о связывании препарата митохондриями, которое осуществляется в основном с липидами Мх. Это было подтверждено на липосомах из липидов Мх печени крыс, коэффициент распределения был выше 104. Добавление Мх в среду без препарата (СвМх) практически не изменяло Gm БЛМ (контроль). Из рис. 4 видно, что номинальная концентрация тегалида СнМх, увеличивающая скорость дыхания Мх в 2 раза (рис. 4, а), равна концентрации, увеличивающей Gm БЛМ до 5•10-9 ом-1 см-2 в присутствии Мх (рис. 4, б). Следовательно, разобщающая активность тегалида осуществляется по протонофорному механизму.
При сравнении концентрации ЗСА, повышающей скорость дыхания Мх вдвое и увеличивающей Gm БЛМ до 5•10-9 См/см2 в присутствии Мх, для всех исследованных соединений ЗСА, кроме неактивного Г-889, была выявлена прямо пропорциональная зависимость (рис. 5), как и для препаратов из класса ДОК [6, 7, 13], она свидетельствовала в пользу хемиосмотической гипотезы Митчела механизма синтеза энергии и протонофорного молекулярного механизма разобщающего действия на Мх препаратов из класса ЗСА [3]. Наряду с классическими протонофорными разобщителями ОФ известны ионофоры, способные снижать протонный потенциал, образуя каналы для Н+, Na+, К+ (антибиотики нигерицин, грамицидин), десопрягающие агенты, способные стимулировать транспорт электронов по дыхательной цепи без снижения мембранного потенциала (анестетики) [14].
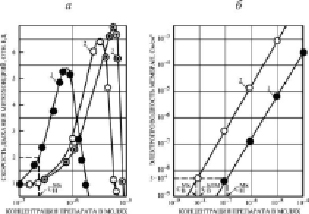
Рис. 4. а) Зависимость относительной скорости дыхания Мх от концентрации тегалида в суспензии при 2 мг/мл (кривая 1), 6 мг/мл (2) и 8 мг/мл (3) белка. Показано, как находили номинальную концентрацию тегалида в среде СнМх, увеличивающую скорость дыхания Мх в 2 раза. Состав среды указан в методах. За 1 принята скорость дыхания без тегалида. б) Индуцируемая протонная проводимость в БЛМ из ОЛБМ (20 мг/мл в н-декане) как функция концентрации тегалида в присутствии 2 мг/мл белка Мх (кривая 1) и в отсутствии Мх (кривая 2). СвМх – контроль без препарата с добавлением Мх (кривая 2). Показано, как находили концентрацию тегалида в среде, индуцирующую в БЛМ протонную проводимость 5•10-9 ом-1.см-2 в присутствии Мх (СнМх) и в их отсутствии (СвБЛМ). Среда: 0,3 М сахароза, 1 мМ ЭДТА, 10 мМ трис-НСl, рН 7,5
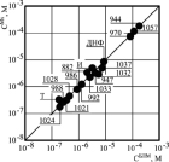
Рис. 5. Корреляция протонофорной активности ЗСА на БЛМ и разобщающей – на Мх. По оси ординат – концентрация препаратов, стимулирующая скорость дыхания Мх в состоянии 4 в 2 раза, по оси абсцисс – концентрация ЗСА, индуцирующая электропроводность Gm БЛМ 5•10-9–10-9 См/ см-2. На рисунке обозначены: И – ионол, Т – тегалид, ДНФ – динитрофенол
Измерение структурных перестроек мембран в присутствии ЗСА
Было показано, что высокоактивные ЗСА в концентрациях 10-6–10-4 М и менее активные препараты при более высоких концентрациях, снижали микровязкость теней эритроцитов на 0,5–2,0 сПз, что свидетельствует об их способности изменять структуру и трансмембранную проницаемость мембран в отличие от малоэффективных на БЛМ ЗСА, не изменяющих этот параметр. Значительное снижение микровязкости более чем на 2 сПз наблюдалось для препаратов, наиболее значительно увеличивающих Gm БЛМ, или при увеличении их концентрации выше, чем 10-4 М, в этом случае некоторые из них становились токсичными. С уменьшением микровязкости сопряжено понижение температуры фазового перехода липидов на 5–8 °С или его исчезновение [3, 7]. В других опытах был отмечен различный характер тушения водой флуоресценции зондов ДМХ и 2,6-ТНС, располагающихся в различных частях мембраны теней эритроцитов. Был сделан вывод о том, что тегалид и другие ЗСА вызывают структурные перестройки липидной фазы, позволяющие им преодолеть барьер на границе мембрана/среда и проникнуть вглубь мембраны, в результате может увеличиваться их протонофорное и разобщающее действие [8].
Антиоксидантная активность (АОА) ЗСА
Была исследована АОА при воздействии ЗСА с различной разобщающей активностью на перекисное окисление липидов. Препарат Г-889, содержащий ОН-группу, но не имеющий галогенных заместителей, являющийся малоактивным протонофором на БЛМ и разобщителем на Мх, проявлял высокую АОА при концентрации 2•10-5 М, как и классический антиоксидант ионол при сходной концентрации 10-5 М [5]. Некоторые исследованные ЗСА с низкой разобщающей активностью (Г-1057, Г-970) и препараты ЗСА с высокой разобщающей эффективностью при их очень низких концентрациях < 10-8 М также проявляли существенную АОА. Нами была обнаружена обратная взаимосвязь протонофорной разобщающей активностей и АОА представленных ЗСА, также другой группы ЗСА [5] и препаратов ДОК [12], она обусловлена различным влиянием на них диссоциации протона ОН-группы, зависящей от галогенных и других заместителей. При увеличении его диссоциации протонофорная разобщающая эффективность ЗСА повышается, а АОА уменьшается из-за снижения их способности окислять ОН-группы в кетогруппы и отдавать отрицательно заряженные электроны перекисным свободным радикалам. Классический разобщитель 2,4-ДНФ в высоких концентрациях 10-5–10-4 М не проявлял АОА [5]. Вероятно некоторые ЗСА, являющиеся слабоэффективными протонофорами, могут также действовать как природные АО через внутриклеточные редокс-системы, индуцируя экспрессию ядерного фактора Nrf2, активирующего гены АО защиты организма [15].
Практическое применение ЗСА и других разобщителей ОФ
Соединения с высокой АОА и низкой разобщающей активностью, которые называют «мягкими» разобщителями, могут быть эффективными терапевтическими препаратами при широком круге заболеваний, при восстановлении последствий воздействия облучения и других внешних факторов. Такие препараты снижают количество образующихся при патологиях токсичных активных форм кислорода (АФК) [16]. Частичное разобщение ОФ исследованными препаратами ЗСА также может снижать образование в Мх АФК, которые играют одну из ключевых ролей в индукции митохондриальных пор [17]. Главным активатором поры является кальций, поглощаемый митохондриями, при этом чувствительность к катиону многократно увеличивается при окислительном стрессе, образование поры приводит к дополнительной генерации АФК и сопровождает различные патологические состояния, вызывая в конечном итоге клеточную гибель [18]. Поскольку Мх являются одним из основных источников АФК при воздействии различных неблагоприятных внешних факторов и при патологиях [18, 19], применение митохондриально-адресованных антиоксидантов и «мягких» природных разобщителей ОФ увеличивает эффективность терапии и профилактики различных патологий [16, 17]. В качестве таких соединений нами могут быть предложены природные протонофоры (кверцетины, рутин, эпигаллокатехин, эхинохром, убихинон), классические антиоксиданты (ионол, токоферол, мексидол) и синтетические двухосновные кислоты с ОН-группами в 4 положении бензольных колец [3, 12]. Показано участие аспартат/глутаматного переносчика и АТФ/АДФ антипортера при разобщении ОФ свободными жирными кислотами в Мх ткани бурого жира зимнеспящих сусликов, способствующему теплообразованию при холодовом стрессе [20], при этом снижается скорость фосфорилирующего и разобщенного дыхания, их общего метаболизма [21]. Регулирует состояние спячки у животных соотношение уровня серотонина и норадреналина. Эндогенными разобщителями являются гормоны щитовидной железы, экзогенными – водорастворимые растительные соединения из класса флавонолов [3, 7, 12].
Высокая протонофорная активность на БЛМ из липидов печеночных фасциол и разобщающее действие на Мх паразитов, как было показано нами ранее, являются основными отличиями молекулярного механизма действия фирменных антипаразитарных препаратов (нитроксинил, салициланилиды тегалид, никлозамид, рафоксанид), двухосновных серосодержащих кислот (битионол и др.) [5, 6], ЗСА (другая группа структурных аналогов тегалида) [3, 5]. Была подтверждена возможность использования БЛМ и Мх для скрининга и направленного синтеза новых, более эффективных и менее токсичных противопаразитарных препаратов по их активности на БЛМ и Мх [3, 6]. Препараты диамфенетид и производные ацемидофена проявляют фасциолоцидный эффект по другому механизму. Некоторые ЗСА (Г-1025, Г-1042, Г-1079) проявляли более высокую протонофорную и разобщающую активность, чем фирменные препараты (нитроксинил, фасциолид) [3, 5]. Нами было выяснено, что показателем токсичности может являться величина площади между графиками зависимости электропроводности БЛМ из липидов паразита и хозяина от концентрации препаратов в растворе (10-10–10-6 М): чем эта площадь меньше, тем более токсичен препарат [5, 6]. Наиболее активные протонофоры и разобщители ОФ из класса исследованных ЗСА (тегалид, Г-1025, Г-1042) [3] и ДОК (битионол, галосфен, сульфен) [6] в нетоксичных концентрациях были нами предложены как перспективные эффективные антипаразитарные (противофасциолезные) препараты, ЗСА – также бактерицидного, фунгицидного, радиопрофилактического действия [3, 5, 8].
Заключение
В работе впервые изучено действие большой группы фенольных соединений (16 препаратов) из класса ЗСА. Высокие коэффициенты распределения мембрана/среда более 104–105 указывали на то, что исследованные ЗСА являются мембранотропными соединениями и влияют на их структурные и функциональные свойства. Показано, что эффективность этих веществ на молекулярном уровне, проявляющаяся в протонофорной активности на БЛМ и разобщающем действии на ОФ в мембранах Мх, различна и зависит от их химической структуры. Указанные активности зависели от наличия гидроксильной группы ОН, количества, вида и места положения заместителей (I, Br, Cl, NH, NO2, CH3, CH(CH3)2, COОCH3) в бензольных кольцах. Галогенные заместители, находящиеся вблизи от ОН-группы, увеличивали активность ЗСА на БЛМ и Мх путем увеличения диссоциации протона гидроксильной группы за счет притягивания электронного облака атома водорода ОН-группы через систему простых связей углерода и кислорода вследствие отрицательного индукционного эффекта, располагаясь в следующем порядке: I- > Br- > Cl-. Этот принцип известен в химии для различных соединений, в том числе из класса ДОК и ЗСА. В результате экранирование ОН-группы электронами уменьшается, протон этой группы становится более подвижным и свободным. Метильные группы не в состоянии оказывать такое воздействие, как галогенные заместители, которые могут увеличивать также лабильность протона аминогруппы (Г-1024). Два дополнительных бензольных кольца способствовали, вероятно, увеличению растворимости препаратов в мембране, более высокой протонофорной и разобщающей активности препаратов. Была установлена корреляция протонофорного действия на БЛМ и разобщающей эффективности на Мх печени крыс для большинства исследованных соединений ЗСА, с учетом высокого коэффициента распределения мембрана/среда 104–105 и поглощения мембранами Мх препаратов с дополнительными бензольными кольцами, указывающая на протонофорный механизм разобщения ОФ. Эффективность разобщения процессов дыхания и образования энергии в Мх определяли по концентрации препарата из класса ЗСА, увеличивающей скорость дыхания в 2 раза, величине снижения трансмембранного потенциала и дыхательного контроля.
С помощью флуоресцентного зонда ДФГТ было выяснено, что чем в большей степени увеличивалась трансмембранная проницаемость мембран БЛМ для протонов и чем более активным было влияние соединений ЗСА на дыхание Мх, тем больше снижалась микровязкость мембран. Опыты с зондами ДМХ и 2,6-ТНС также подтвердили, что эти соединения способствуют структурным перестройкам липидов, благодаря которым они проникают вглубь мембраны и способствуют проявлению разобщающих свойств на Мх.
Молекулярный разобщающий механизм действия ЗСА влияет на клеточные процессы. Он проявляется в увеличении скорости потребления кислорода митохондриями из внешней среды в полярографической ячейке, что, по всей вероятности, приводит к снижению концентрации кислорода в клетке и возникновению внутриклеточной гипоксии. Разобщение ОФ соединениями ЗСА приводит к снижению синтеза АТФ в Мх, в результате наблюдалось временное угнетение метаболизма и скорости пролиферации клеток, показанное в опытах на синхронной многоядерной культуре миксомицета Fisarum polycephalum, способствующее снижению количества активных форм кислорода и свободных радикалов органических молекул, образующихся и повреждающих клеточные структуры при различных патологиях.
Исследованные соединения ЗСА по молекулярному механизму относятся к группе липофильных классических протонофорных разобщителей ОФ с лабильным протоном в ОН или NН-группах. Такие разобщители проявляют различные фармакологические свойства, зависящие от их протонофорной разобщающей активности на Мх. Эффективность их действия на молекулярном и организменном уровне зависит от их химической структуры (количества бензольных колец, количества и свойств заместителей), концентрации в среде коэффициентов диссоциации и распределения мембрана/среда, подвижности в мембране заряженных диссоциированных форм, донорно-акцепторных свойств, эти данные позволяют вести целенаправленный синтез более эффективных и менее токсичных препаратов.
Автор приносит благодарность за оформление и обсуждение результатов к.б.н. Н.Л. Кожокару.
Библиографическая ссылка
Кожокару А.Ф. ЭНЕРГОТРОПНЫЙ И ПРОТОНОФОРНЫЙ МОЛЕКУЛЯРНЫЙ МЕХАНИЗМ ДЕЙСТВИЯ САЛИЦИЛАНИЛИДОВ НА ИСКУССТВЕННЫХ И НАТИВНЫХ МЕМБРАННЫХ СИСТЕМАХ // Международный журнал прикладных и фундаментальных исследований. 2019. № 10-1. С. 11-22;URL: https://applied-research.ru/ru/article/view?id=12860 (дата обращения: 11.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12860