В настоящее время все большее признание получает изучение влияния продуктов микробиологического синтеза на иммунологический гомеостаз, в частности на неспецифические реакции защиты организма, обладающие высокой информативностью показателей и позволяющие выявлять ранние признаки их положительного или отрицательного влияния. Это относится в первую очередь к антибиотикам, так как при действии их на организм зачастую отсутствует токсический эффект даже от применения больших доз. Среди них выделяется группа макролидов – малотоксичные, высокоэффективные антибиотики, обладающие антимикробным, иммуномодулирующим и противовоспалительным действием, более полно изученные в медицине. Установлено, что действие макролидов на иммунную систему зависит от антибиотика, дозы и продолжительности их применения. Они могут усиливать иммунный ответ, а при длительном применении, наоборот, вызывать иммуносупрессию. По одной из теорий механизм их влияния состоит в способности макролидов к аккумуляции в лейкоцитах (нейтрофилы, моноциты, макрофаги) и их хемотаксису (миграции лейкоцитов из сосудистого русла) к очагу инфекции [1, 2]. Макролиды стимулируют фагоцитоз, ускоряют и облегчают дифференциацию макрофагов и увеличивают их киллерную активность. Они стимулируют окислительный (респираторный) взрыв в фагоцитах, наступающий после рецепции и захвата микроорганизмов и образования губительных для бактерий метаболитов кислорода и азота. В зависимости от концентрации и длительности терапии макролиды повышают или понижают синтез и поступление противовоспалительных факторов-цитокинов: туморнекротизирующих факторов (TNF) и интерлейкинов (IL) – 1, 6, 8, 10 из лейкоцитов, фагоцитов и клеток дыхательного эпителия. Предположительно, что макролиды влияют на регуляцию экспрессии генов (процесс передачи генетической информации от ДНК), участвующих в синтезе цитокинов в эукариотических клетках [3]. Наибольшая иммуномодуляторная активность обнаружена у широко используемых в медицине – азитромицина и кларитромицина [4]. Исключительно интересным фактом является не только стимуляция иммунной защиты, но и прекращение активации иммунитета по мере стихания инфекционного процесса [5]. По химическому строению антибиотики подгруппы тилозина относятся к макролидам и широко применяются в ветеринарной практике. Структура тилозина представляет собой 16-членный макролид, в состав которого входит тиланолидное кольцо и три сахара: микаминоза, микароза и мициноза. Данные о влиянии тилозиновых антибиотиков на иммунитет ограничены и получены в основном на лабораторных животных: свиньях и собаках. Препараты этой группы широко применяются в птицеводстве. Поэтому изучение влияния на уровень естественной резистентности птиц представляло несомненный интерес.
Естественная резистентность цыплят по данным Л.С. Колабской у молодняка кур мясных и яичных пород с 5- до 20-дневного возраста определяется на низком уровне, так как иммунная система находится в стадии формирования. У цыплят выявлено два критических физиологических периода, связанных с возрастными иммунодефицитами. Первый период – 4–5-й день постнатального развития, когда происходит рассасывание желточного мешка – главного органа кроветворения и лимфопоэза в эмбриональный период развития. Второй период начинается с 14–15 дня жизни, когда происходит распад овариальных иммуноглобулинов матери [6]. По данным литературных источников период полураспада материнских антител происходит от 5 дня жизни до месяца в зависимости от иммунного статуса родителей [7]. В эти критические моменты жизни организм очень чувствителен к возбудителям болезни, особенно к заражению микоплазмой, так как микроб может распространяться трансовариально [8]. Предложенные для борьбы с микоплазмозом тилозиновые антибиотики особенно актуальны.
Основной задачей эксперимента было изучение влияния производных тилозина: фармазина-Т (Болгария), фармазина (Болгария) и фрадизина-50 (Россия) на физиолого-биохимический состав крови и иммунный статус цыплят в критический период иммунодефицита в возрасте с 5 по 20 день жизни при краткосрочном применении. А также целесообразности одновременного применения тилозиновых антибиотиков и иммуномодуляторов.
Материалы и методы исследования
Фармазин-Т (Ф-Т) – техническая форма тилозина фосфата, изготавливаемая путем высушивания культуральной жидкости после ферментации актиномицета, в одном грамме которого содержится 100 мг антибиотика. Кроме АДВ в нем содержится 18,84 % минеральных веществ (CACO3, NaCl и др.), 30 % белков и значительное количество свободных аминокислот: метеонин, аланин, глутаминовая и аспарагиновая аминокислоты, фенилаланин, лейцин и др. Фрадизин-50 (Ф-50) в 1 грамме содержит 50 мг тилозина фосфата и наполнитель, в состав которого входят свободные аминокислоты, витамины, ферменты, макро- и микроэлементы, липиды, в том числе фосфолипидные фракции. Фармазин (Ф) – растворимый 50 % порошок тилозина тартрата. Исследование проводили на цыплятах кросса «Бройлер-6» в возрасте от 1 до 20 дней. Бройлеров разделяли на четыре группы по принципу аналогов. Птице первой группы назначали фармазин-Т (Ф-Т) в дозе 10 г/кг корма, второй – фрадизин-50 (Ф-50) – в дозе 20 г/кг корма, третьей фармазин (Ф) – в дозе 1 г/л питьевой воды в течение 5 дней. Суточная доза по активно действующему веществу (АДВ) была одинаковой и составляла 80–85 мг/кг. Четвертая группа служила чистым контролем. Через 5, 10 и 20 дней с начала назначения препаратов брали кровь из подкрыльцовой вены и изучали следующие показатели: СОЭ, количество эритроцитов и лейкоцитов, содержание гемоглобина (HGB) и общего белка (Tb), бактерицидную активность сыворотки крови, активность лизоцима и активность бета-лизина.
Реакцию СОЭ проводили микрометодом Панченкова, реакцию оценивали через час. Подсчет количества эритроцитов и лейкоцитов проводили в камере Горяева. Из биохимических показателей определяли содержание гемоглобина колориметрическим методом, общий белок в сыворотке крови рефрактометрическим методом по В.В. Рудакову и соавт. Оценку влияния на иммунологический статус проводили по показателям естественной резистентности: бактерицидной активности сыворотки крови, активности лизоцима и бета-лизина. Бактерицидная активность сыворотки крови (БАС) – свойство свежей сыворотки вызывать гибель в ней бактерий, обусловленный совокупным действием многих факторов, в том числе бета-лизина и лизоцима. Уровень БАС является показателем активности фагоцитоза, а именно нейтрофилов и моноцитов, определяя антимикробные свойства крови и оценивая состояние иммунной системы. БАС крови устанавливали фотоэлектроколориметрическим методом (ФЭКМ) по О.В. Смирновой и Т.А. Кузьминой в модификации ВНИВИП. Важная роль в естественной резистентности принадлежит лизоциму. Он активизирует как фагоцитоз, так и образование антител, выполняет роль регулятора клеточной дифференциации, а также повышает эффективность системы комплемента и пропердина. Активность лизоцима в сыворотке крови определяли фотоэлектроколориметрическим методом (ФЭКМ) по А.Г. Дорофейчику в модификации ВНИВИП. Бета-лизин – тромбоцитарный катионный белок сыворотки крови, синтезируемый тромбоцитами. Активность В-лизина в сыворотке крови птиц выясняли ФЭКМ по О.В. Бухарину и соавт. в модификации ВНИВИП. Изменение параметров естественной гуморальной защиты, изучаемое в динамике, может быть использовано как показатель иммунологической реактивности организма [9]. Падение уровня БАС, лизоцима и бета-лизина указывает на глубокие нарушения в иммунитете и является неблагоприятным прогностическим признаком. Кроме этого следили за динамикой роста цыплят и рассчитывали коэффициент роста. Коэффициент роста цыплят определяли по формуле
К = Wt / Wo,
где Wt и Wo – масса соответственно на начало и конец опыта.
Результаты исследований и их обсуждение
В ходе работы выяснили, что ни один из испытуемых антибиотиков не влиял на количество эритроцитов, лейкоцитов и СОЭ. Эти показатели находились в пределах физиологической нормы и находились на уровне аналогичных референтных показателей. На всех этапах исследований концентрация гемоглобина была наиболее высокой в группах птиц, получавших Ф-Т и Ф-50. Так, на двадцатый день эксперимента под действием Ф-Т уровень HGB составлял 119,3 ± 0,29 г/л, что превышало контрольный показатель на 18,9 %, под действием Ф-50 – 115,8 ± 0,14 г/л, что было выше уровня референта на 15,5 %. У цыплят, которым выпаивали фармазин, этот показатель также достоверно превышал контрольные значения на 9,6 % и был равен 109,9 ± 0,24 г/л. Концентрация гемоглобина во всех группах при этом не выходила за рамки физиологической нормы (рис. 1).
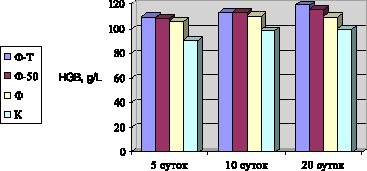
Рис. 1. Уровень гемоглобина в различные сроки после применения фармазина-Т, фрадизина-50 и фармазина (М ± м)
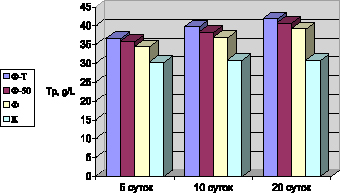
Рис. 2. Уровень общего белка в различные сроки после применения фармазина-Т, фрадизина-50 и фармазина (М ± м)
Динамика содержания общего белка представлена на рис. 2. Прослеживается постепенное достоверное повышение его уровня к концу эксперимента. У бройлеров, получавших фармазин-Т, уровень общего белка (Tр) был наиболее высоким через 20 суток – 41,9 ± 0,06 г/л и превышал контрольный показатель на 35,7 %. К концу исследования под действием фрадизина-50 концентрация общего белка была выше контроля на 32,5 % и составляла 40,8 ± 0,14 г/л, а под действием фармазина – 39,2 ± 0,25 г/л, что было выше референта на 27,3 %.
При выращивании цыплят мясных пород объективным показателем является динамика роста. Потребность тканей в поступлении кислорода и питательных веществ в ростовой период возрастает. Под действием антибиотиков повышение белкового обмена и уровня гемоглобина коррелировало с более активным наращиванием живой массы. В ходе исследований выяснили, что через 5 дней коэффициент роста бройлеров всех опытных групп был выше – 1,67–1,71 против контроля 1,56, но различия были недостоверны. Через 10 суток регистрировали наибольший прирост массы у цыплят, получавших фармазин-Т (коэффициент роста 3,35) и фрадизин-50 (коэффициент роста 3,26). Птицы, получавшие фармазин, немного отставали (коэффициент роста 3,19). Цыплята в контрольных группах хуже росли и развивались. Они были менее активны, не так интенсивно оперялись. Через 20 суток различия проявились наиболее ярко. Коэффициенты роста превышали референтный показатель на 56,7 – 53,7 % и составляли для Ф-Т – 6,36, для Ф-50 – 6,34, для Ф – 6,24 против контрольного 4,06. Помимо тилозина Ф-Т и Ф-50 содержат в составе наполнителя другие биологически активные вещества, способствующие улучшению обмена веществ и насыщению необходимыми нутриентами, что необходимо учитывать при анализе ростостимулирующей активности антибиотиков для животных [10]. Поэтому Ф-Т и Ф-50 показали более высокий уровень обмена и наращивание живой массы по сравнению с фармазином и контролем. Анализируя показатели естественной резистентности, отметили повышение активности лизоцима на протяжении всего периода исследования у птиц, получавших фармазин-Т. Активность лизоцима в группах бройлеров, получавших фрадизин-50, также превышала контрольный через 10–20 дней. У цыплят, которым выпаивали фармазин, процент лизиса достоверно повышался по отношению к референту только на 20 день исследований. Активность бета-лизина через 5–10 дней изменялась незначительно. Только через 20 дней эксперимента зафиксировали достоверное увеличение этого показателя у птиц получавших Ф-Т на 15,1 % , а Ф-50 на 12,6 %. БАС увеличивалась только в группе птиц, получавших Ф-Т в среднем на 12,7–15,4 % и Ф-50 – на 11,1–12,5 % по сравнению с контролем. Изменения в динамике этого показателя под действием Ф носили недостоверный характер (таблица).
Заключение
Проведенный анализ показал, что под действием фармазина-Т, фрадизина-50 и фармазина усиливался белковый обмен, повышалось насыщение крови гемоглобином. Бройлеры лучше росли и развивались. Наибольший ростостимулирующий эффект отметили у фармазина-Т и фрадизина-50.
Показатели естественной резистентности в различные сроки применения фармазина-Т, фрадизина-50 и фармазина (М ± м)
|
Показатели |
Время, сутки |
Фармазин-Т |
Фрадизин-50 |
Фармазин |
Контроль |
|
Активность лизоцима, % лизиса |
5 |
13,31 ± 1,06 * |
13,10 ± 1,67 |
12,98 ± 1,27 |
11,06 ± 1,08 |
|
10 |
13,11 ± 0,92 * |
12,95 ± 0,63 * |
12,75 ± 0,08 |
10,54 ± 0,91 |
|
|
20 |
13.56 ± 1,36 * |
12,92 ± 1,15 * |
12,53± 1,04 * |
10,33 ± 0,16 |
|
|
Активность бета-лизина, % лизиса |
5 |
33,53 ± 2,16 |
34,64 ± 2,29 |
33,98 ± 3,12 |
33,61 ± 1,27 |
|
10 |
30,96 ± 0,92 |
31,15 ± 3,08 |
30,64 ± 2,27 |
30,29 ± 0,68 |
|
|
20 |
32,86 ± 1,57 * |
32,17 ± 1,56 * |
31,19 ± 1,91 |
28,56 ± 1,14 |
|
|
Бактерицидная активность , % |
5 |
21,30 ± 2,72 |
20,05± 0,28 |
19,98 ± 3,16 |
19,81 ± 1,34 |
|
10 |
27,24 ± 0,19 * |
26,21 ± 1,25 * |
23,89 ± 1,19 |
23,60± 1,12 |
|
|
20 |
33,98 ± 1,64 * |
33,92 ± 1,79 * |
32,56 ± 2,21 |
30,14 ± 0,69 |
Примечание: * – Р < 0,05 – рассчитана по сравнению с контролем.
При краткосрочном применении (5 суток) в терапевтических дозах фармазин-Т (10 г/кг корма) и фрадизин-50 (20 г/кг корма) обладали иммуностимулирующим действием, повышали естественную резистентность цыплят. В ходе эксперимента наблюдали достоверное увеличение БАС, активности лизоцима и к 20 дню исследований – активности бета-лизина. Фармазин в дозе 1 г/л питьевой воды иммуностимулирующего влияния не оказывал, но и не угнетал естественную резистентность цыплят. По результатам исследования можно сделать вывод. При краткосрочной терапии (5 суток) в терапевтических дозах применение тилозиновых антибиотиков фармазина-Т и фрадизина-50 совместно с иммуномодуляторами нецелесообразно. Дальнейшее изучение влияния тилозиновых производных на иммунологический гомеостаз птиц представляет несомненный научный интерес.
Библиографическая ссылка
Касьяненко Е.Ф. ФИЗИОЛОГО-БИОХИМИЧЕСКИЙ СОСТАВ КРОВИ И УРОВЕНЬ ЕСТЕСТВЕННОЙ РЕЗИСТЕНТНОСТИ ЦЫПЛЯТ НА ФОНЕ ПРИМЕНЕНИЯ ТИЛОЗИНОВЫХ АНТИБИОТИКОВ // Международный журнал прикладных и фундаментальных исследований. 2019. № 10-2. С. 318-322;URL: https://applied-research.ru/ru/article/view?id=12914 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12914

