Потребность в костно-пластических материалах постоянно возрастает [1–3] не только в связи с увеличением числа травм и заболеваний костной ткани, но и в результате активизации хирургической тактики в травматологии, ортопедии, онкологии и челюстно-лицевой хирургии. Многие из известных и разнообразных костно-пластических материалов не удовлетворяют требованиям современной высокотехнологичной хирургии, поэтому разработки инновационных костнопластических материалов и операций продолжаются во всем мире [4–6]. На современном этапе наиболее перспективными являются разработки новых комбинированных биодеградируемых имплантатов, в первую очередь природных биополимеров, обладающих выраженной остеоиндуктивностью, остеокондуктивностью, моделируемостью, способностью поддерживать жизнеспособность и функциональную активность мезенхимальных стволовых клеток (МСК) [7, 8]. МСК в настоящее время рассматриваются как наиболее перспективные клетки для регенеративной медицины [9–11]. Данные о взаимодействии МСК с ксеногенной коллагеновой матрицей и воздействии сформированного продукта на процессы восстановления в области модельного дефекта костной ткани могут послужить основой для разработки современных технологий восстановления костных дефектов.
Цель исследования: изучить особенности взаимодействия МСК – КМ кролика с ксеногенной коллагеновой матрицей и особенности восстановления экспериментального костного дефекта при использовании сформированной клеточно-инженерной конструкции.
Материалы и методы исследования
Протокол исследования был одобрен локальным этическим комитетом и утвержден Ученым советом ФГБО ВО ПИМУ Минздрава России. Все процедуры работы с животными проводились в условиях вивария с соблюдением требований «Европейской конвенции по работе с животными» и в соответствии с приказом Минздравсоцразвития России № 708н от 23.08.2010 «Об утверждении правил лабораторной практики». Выведение животных из эксперимента осуществлялось методом воздушной эмболии под наркозом.
Получение МСК – КМ кролика и подготовка клеточно-инженерной конструкции. МСК кролика выделяли из костного мозга бедренных костей двух животных и получали культуру с помощью селективной адгезии к пластику. В качестве ростовой среды использовали α – МЕМ (HyClone, США) с добавлением 15 % телячьей эмбриональной сыворотки (ТЭС, HyClone, США), 100 Ед/мл пенициллина, 100 мкг/мл стрептомицина и 2 Мм глутамина (все реактивы ООО «ПанЭко», культуральный пластик «Costar», США. По мере достижения клетками субконфлюэнтного монослоя (до 80 %) осуществляли пересев. Состояние культуры контролировали в динамике с помощью инвертированного микроскопа Leica DMI 3000 B (Германия) с программным обеспечением LAS.V.4.3. Фенотип клеток определяли с использованием моноклональных антител CD 44 FITC, CD 105 PE, CD 45 PE с соответствующими изотипическими контролями на цитофлуориметре FACS CANTO II (Betman Dickinson, USA). Дифференцировочный потенциал клеток оценивали на культуре третьего пассажа. Клетки были способны дифференцироваться в адипооциты, остебласты, хондробласты.
В экспериментах in vitro и in vivo использовали клетки 3-го пассажа в концентрации (2*106 кл/мл). Образовавшуюся клеточную суспензию собирали в шприцы по 1 мл и вводили непосредственно в толщу образцов губки «Коллатамп ИГ» (Collatamp EG, «СинтколлГмбХ», Германия). Образцы губки в соответствии с размерами формируемого костного дефекта (8,0х 4,0 мм и глубиной 4,0 мм) готовили перед введением клеток. Клетки культивировали на матрице в течение 5 суток (120 ч). Часть образцов использовали для оценки выраженности адгезии и жизнеспособности клеток методом флуоресцентной микроскопии в контрольные сроки (48, 96 и 120 ч после введения в матрицу).
Исследование адгезии и жизнеспособности клеток на матрице. Для визуализации ядер клеток, адгезировавшихся на матрице, использовали прижизненное окрашивание ядер с применением флуорохрома Hoechst 3334 (BD Pharmingen™), обладающего высокой специфичностью к двухцепочечной молекуле ДНК (длина волны возбуждения 377 нм, длина волны эмиссии 447 нм).
Для маркировки живых клеток и характеристики их морфологии на материале использовали флуорохром кальцеин (Calcein AM, BD Pharmingen™), легко проникающий в цитоплазму жизнеспособных клеток (фотометр-имиджер Cytation 5, BioTek, USA).
Образцы, предназначенные для эксперимента in vivo, через 48 ч после введения клеток отмывали стерильным физиологическим раствором и передавали для введения животным.
Исследование на модели in vivo. Эксперимент выполнен на 25 кроликах породы «Серый великан». Оперативный доступ осуществляли по внутренней поверхности проксимальной метадиафизарной области левой большеберцовой кости продольным разрезом, с послойным рассечением кожи, подкожной клетчатки, фасции длиной 3,0 см. Острыми крючками разводили края раны. Распатором скелетировали большую берцовую кость на площади 2х1 см. Фрезой диаметром 4,0 мм вдоль оси кости формировали стандартизированный дефект надкостницы, кортикального слоя и губчатого вещества размерами 8,0х4,0 мм и глубиной 4,0 мм. Размеры дефекта контролировали при помощи штангенциркуля ШЦ-1 с глубиномером и ценой деления 0,1 мм. Животным опытной группы полость дефекта заполняли матрицей «Коллатамп ИГ» (Collatamp EG, «СинтколлГмбХ», Германия), с предварительно введенными аллогенными МСК-КМ. В качестве контрольной группы использовали животных, у которых сформированный костный дефект заживал спонтанно.
Наблюдение за размерами дефекта, особенностями формы и структуры костной ткани в области очага, его точным расположением и конфигурацией осуществляли с помощью рентгенографии в двух проекциях на аппарате «Dira-RC», компьютерной томографии на аппарате «Toshiba 32 Aquillon» с оценкой трёхмерной реконструкции сегмента.
После выведения животных из эксперимента на сроках 4, 8 и 12 недель проводилось гистологическое исследование серийных срезов зоны дефекта и окружающих его тканей. После фиксации материала в растворе нейтрального 10 % формалина осуществлялась стандартная гистологическая проводка на аппарате «Excelsior ES» (Thermo Scientific, USA). Далее изготовлялись парафиновые блоки. Серийные срезы толщиной 4–6 мкм получали на микротоме «Microm HM 325» (Thermo Scientific, USA). Срезы окрашивались гематоксилином и эозином.
Результаты исследования и их обсуждение
Выделенные из костного мозга кроликов клетки хорошо распластывались на пластике и приобретали характерную фибробластоподобную форму. На протяжении всего периода наблюдения клетки культуры были морфологически однородными с выраженными отростками, четко очерченными ядрами. Клетки культур третьего пассажа были способны дифференцироваться в остеогенном и адипоогенном направлении. Фенотип клеток CD 44+, CD 105+, CD 45-. Таким образом, характеристики полученных клеток были аналогичны критериям, определенным международным обществом по клеточной терапии для мезенхимальных стволовых клеток человека [12].
Известно, что МСК могут быть выделены из различных тканей, но клетки, выделенные из костного мозга, обладают более выраженным остеогенным потенциалом [13, 14]. Поэтому для создания биоинженерного продукта мы использовали аллогенные МСК костного мозга. Показано, что эти клетки способны стимулировать функции уже имеющихся высокоспециализированных клеток [10, 11], обладают высоким пролиферативным потенциалом и могут дифференцироваться в другие типы клеток [12].
В качестве матрицы был выбран продукт из ксеногенного коллагена – «Коллатамп ИГ» (Collatamp EG, «СинтколлГмбХ», Германия). Ксеногенный коллаген использовали в качестве матрицы, так как в клинической практике предполагается применение именно ксеногенных коллагеновых продуктов (из тканей свиньи, коровы, лошади). Коллагеновые импланты применяются в практической медицине для заполнения небольших дефектов костной ткани [7, 8]. «Коллатамп ИГ» (Collatamp EG, «СинтколлГмбХ», Германия) представляет собой стерильный биодеградируемый продукт на основе высокоочищенного ксеногенного коллагена в виде губки, содержащей антибиотик гентамицин. Достоинствами подобного материала являются пластичность при заполнении дефектов и гемостатические свойства. Составляющий основу данного препарата коллаген обладает слабой антигенностью и токсичностью, быстро резорбируется в организме, стимулируя репаративные процессы. В предварительном исследовании было показано не только отсутствие цитотоксичности, но и отсутствие влияния на функциональную (пролиферативную и секреторную) активность субстрат-зависимых клеток в ксеногенной модели [15].
При культивировании МСК – КМ кролика на коллагеновой матрице уже через 48 ч с помощью флуоресцентной микроскопии отчетливо визуализировали овальные ядра клеток, окрашенные синим. Более длительное культивирование (96, 120 ч) приводило к увеличению плотности клеток (окрашенных ядер) в поле зрения. Использование флуорохрома Calcein AM, BD Pharmingen™, проникающего в цитоплазму только жизнеспособных клеток, продемонстрировало на поверхности матрицы большое количество живых клеток типичной фибробластоподобной формы через 24, 48, 120 ч культивирования (рис. 1).
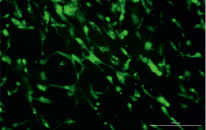
Рис. 1. МСК – КМ кролика на коллагеновой матрице, флуорохром кальцеин (зеленое окрашивание), 120 ч культивирования; увеличение х100
Полученные данные по исследованию состояния клеток на матрице «Коллатамп ИГ» в разные сроки после введения позволяют вполне корректно предполагать, что на образцах, использованных для эксперимента на животных после 48 ч культивирования, также сохраняются жизнеспособные и морфологически однородные МСК – КМ. Следует отметить, что не зафиксировано отрицательных эффектов при взаимодействии МСК – КМ кролика и ксеногенного коллагена, что демонстрирует перспективность совместного использования МСК различного происхождения с ксеногенным коллагеном в клинической практике.
При исследовании in vivo анализ состояния костного дефекта у кролика, проведенный с помощью рентгенологических методов исследования, показал, что видимые признаки восстановления дефекта наблюдаются на сроке 12 недель, на сроках до 8 недель видимых различий рентгенологических теней дефектов не обнаружено. При анализе выполненных МСКТ продемонстрировано, что на экспериментальном сроке 12 недель сквозной дефект кортикального слоя не обнаруживается. При изучении КТ картины на самых поздних сроках наблюдения обнаруживается лишь след нанесённого повреждения большой берцовой кости в виде желоба размерами в среднем 4х2 мм. На более ранних этапах наблюдаются прогрессивно уменьшающиеся размеры сквозного дефекта, которые на сроке эксперимента 4 недели составили 5х3 мм.
Полученные данные согласуются с результатами гистоморфологических исследований.
В опытной группе на сроке эксперимента 4 недели в препаратах отмечено формирование губчатой костной ткани в зоне дефекта. Края дефекта были представлены компактной костной тканью, заметно утолщены с наличием их перестройки, расширенными гаверсовыми каналами в этой области (рис. 2, А). Новообразованные костные балки были окружены значительным количеством остеобластов. Вокруг формирующихся костных балок имелась довольно нежная ретикуло-фиброзная ткань с неравномерным количеством клеточных элементов. Со стороны миелоидного костного мозга, а также в ряде препаратов отмечено активное образование костных структур. В участках пластинчатой костной ткани, прилежащих к зоне дефекта, отмечались явления её перестройки в направлении губчатой костной ткани, сопровождавшиеся выделением остеонов с четкими границами.
В контрольной группе на сроке эксперимента 4 недели в зоне дефекта отмечались немногочисленные хаотично расположенные костные балки, окруженные миелоидным костным мозгом (рис. 2, Г). Между костными балками имелись мелкие участки ретикуло-фиброзной ткани. Со стороны краев дефекта заметного утолщения костных балок, их перестройки не отмечалось. Со стороны надкостницы также не отмечалось заметной активизации пролиферативных процессов, направленных на замещение дефекта. Таким образом, наиболее выраженная активизация процессов репарации наблюдалась со стороны костномозгового пространства.
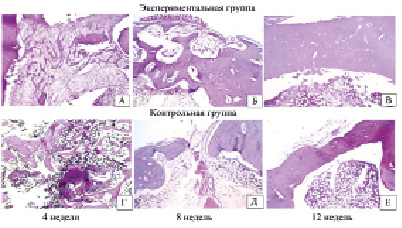
Рис. 2. Восстановление дефекта бедренной кости животных экспериментальной и контрольной групп на разных сроках эксперимента. Окраска гематокислин-эозин, ув. х50
Сравнительная характеристика состояния костной ткани в зоне дефекта бедренной кости животных экспериментальной и контрольной групп на разных сроках эксперимента
|
Показатель Me (25 %; 75 %) |
Площадь костных балок зоны дефекта, в 10 п.з., ув.х200, мкм2 |
Толщина кортикальной костной пластинки в зоне дефекта, мкм |
|
|
Срок эксперимента |
4 недели |
8 недель |
12 недель |
|
Экспериментальная группа n = 4 |
216501,1 (192210,7; 240633,6)* |
312295,4 (262213,0; 381100,0) |
1027,2 (865,3; 1250,0)* |
|
Контрольная группа n = 4 |
162354,2 (136345,9; 189816,2)* |
231550,0 (204451,5; 251583,1) |
630,8 (534,5; 899,1) |
Примечание. * – р ≤ 0,05 по сравнению с контрольной группой.
Через 8 недель в опытной группе и контрольной группах в зоне дефекта отмечали формирование тонкой компактной костной пластинки, но в контрольной группе новообразованные костные структуры не соединяли края дефекта. Одновременно фиксировали сохранение умеренно выраженных изменений со стороны пластинчатой костной ткани краев дефекта в виде их утолщений и расширений гаверсовых каналов. Со стороны миелоидного костного мозга и надкостницы образования костных балок не отмечалось как в экспериментальной (рис. 2, Б), так и в контрольной группе (рис. 2, Д).
Морфометрический анализ (таблица) показал, что площадь новообразованных костных балок в группе животных, в которой применялась клеточно-инженерная конструкция, по сравнению с контрольной на 25,0 % больше (р = 0,035) на 4 неделе эксперимента и на 25,9 % через 2 месяца (р = 0,410).
На экспериментальном сроке 12 недель в зоне дефекта бедренной кости у всех животных контрольной группы отмечалось неполное восстановление дефекта с формированием довольно тонкой кортикальной костной пластинки, толщина которой была меньше в 4 раза по сравнению с неизмененной компактной костной тканью рядом расположенных участков (рис. 2, Е).
В экспериментальной группе животных зона дефекта была выполнена сформированной компактной костной пластинкой, соединяющей несколько утолщенные края дефекта. В зону дефекта вдавался участок миелоидного и жирового костного мозга. Толщина кортикальной костной пластинки в среднем была на 38,6 % больше (р = 0,029), чем в контрольной группе.
Таким образом, уже через 4 недели наблюдения отмечалось заметное различие в степени выраженности остеогенеза в зоне дефекта, который был значительнее выражен в экспериментальной группе. К 12 неделям наблюдения, как в опытной, так и в контрольной группе животных фиксировалось восстановление кортикальной костной пластинки. Но в опытной группе восстановленная кортикальная костная пластинка по толщине была сравнима с интактными участками, тогда как в контрольной группе ее толщина была значительно меньше толщины неповрежденной костной ткани. То есть можно говорить о том, что клеточно-инженерная конструкция на основе аллогенных МСК-КМ и ксеногенного коллагена стимулируют восстановление модельного костного дефекта у кролика.
Заключение
Проведенное исследование показало, что клетки, выделенные из костного мозга кролика, соответствовали критериям мезенхимальных стволовых клеток. При культивировании на ксеногенной коллагеновой матрице в течение всего срока наблюдения (120 ч) МСК – КМ кролика сохраняли жизнеспособность, типичные морфологические характеристики и пролиферативную активность.
Сформированная клеточно-инженерная конструкция (через 48 ч после введения клеток) содержала жизнеспособные клетки и может быть использована для восстановления костного дефекта.
Использование клеточно-инженерной конструкции на основе ксеногенного коллагена и аллогенных МСК – КМ было эффективно при восстановлении костного дефекта в эксперименте, о чем свидетельствовало ускорение и оптимизация репаративных процессов в области дефекта костной ткани у животных опытной группы по сравнению с контрольной группой.
Авторы выражают благодарность С.Н. Бугрову за помощь в проведении гистоморфологических исследований.
Библиографическая ссылка
Живцов О.П., Алейник Д.Я., Орлинская Н.Ю., Митрофанов В.Н. ОСОБЕННОСТИ РЕГЕНЕРАЦИИ КОСТНОЙ ТКАНИ В УСЛОВИЯХ ПРИМЕНЕНИЯ КЛЕТОЧНО-ИНЖЕНЕРНОЙ КОНСТРУКЦИИ ДЛЯ ВОССТАНОВЛЕНИЯ КОСТНОГО ДЕФЕКТА У КРОЛИКА // Международный журнал прикладных и фундаментальных исследований. 2019. № 11. С. 54-59;URL: https://applied-research.ru/ru/article/view?id=12931 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.12931

