Кодеин – 3-метилморфин, алкалоид опия (рисунок), обладает умеренной анальгетической активностью, в связи с чем препараты на его основе используются при лечении болевого синдрома в сочетании с ненаркотическими анальгетиками, а также для успокоения кашля [1, 2].
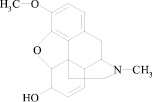
Структурная формула кодеина
Однако при длительном использовании кодеин может вызывать физическую зависимость, поэтому отпуск соответствующих кодеинсодержащих препаратов в аптечной сети и контроль их качества регламентируются [3, 4].
В основном кодеин определяют при проверке подлинности лекарственных препаратов, дифференцировании приема лекарственного средства кодеина от немедицинского употребления опиатов, а также в процессе соответствующих судебно-химических исследований при подозрении отравления препаратами опийной группы. С этой целью, как правило, используются хроматографические методы с различными типами детекторов [5]. К их недостаткам следует отнести применение сложного, дорогостоящего оборудования и в ряде случаев необходимость получения дериватов кодеина при его определении в биологических объектах [6].
Методы молекулярной спектрометрии, в частности люминесценции и спектрометрии диффузного отражения, характеризующиеся относительно высокой чувствительностью, экспрессностью и простотой аппаратурного оформления, существенно расширяют возможности определения кодеина в различных объектах [7]. Однако до настоящего времени они практически не использовались в связи с отсутствием соответствующих исследований.
Цель исследования: сравнительный научный обзор работ с результатами исследований спектроскопических свойств кодеина в жидкой и твердой фазах, способов пробоподготовки, а также методиками его определения в лекарственных препаратах и биологических объектах методами люминесценции и спектрометрии диффузного отражения.
Результаты исследования и их обсуждение
Люминесценция кодеина в водных растворах. Молекула кодеина содержит гетероатом азота с неподеленной парой электронов (рисунок). В спектре поглощения присутствует полоса n → π* электронного перехода с λмакс = 285 нм и ε порядка n•102 [8]. Соединения с подобными электронными структурами слабо или вовсе не флуоресцируют [7]. Активация флуоресценции в ряде случаев достигается протонизацией атома азота. В результате становятся возможными π → π* электронные переходы, обуславливающие люминесценцию (флуоресценцию) растворов. В соответствии с молекулярной структурой кодеин является весьма сильным третичным основанием, содержащим =NCH3 группу с рКа = 8,2 [5]. Таким образом, в нейтральных и кислых водных растворах в результате протонизации атома азота формой нахождения кодеина является положительно заряженный ион. В работе [9] для активации свечения кодеина использован 0,05 М раствор H2SO4 при λвозб и λлюм 300 и 345 нм соответственно. Относительный квантовый выход люминесценции кодеина (φкв) составил 0,01. В данных условиях по собственной люминесценции возможно определение микрограммовых содержаний кодеина с пределом обнаружения 3 мг/дм3.
Для повышения чувствительности люминесцентных измерений кодеина использована способность его положительно заряженного иона образовывать ионные ассоциаты с отрицательно заряженными противоионами с высокими квантовыми выходами свечения. В [10] в качестве противоиона использован эозин (φкв = 0,23) – галогенопроизводное флуоресцеина. В диапазоне рН 6–9 эозин находится в виде двукратно ионизированного аниона и образует флуоресцирующий ионный ассоциат с положительно заряженным ионом кодеина, который экстрагируется рядом органических растворителей. Максимальная интенсивность свечения достигается при экстракции ионного ассоциата кодеина с эозином толуолом (λвозб = 520 нм; λлюм = 550 нм). По флуоресценции экстракта возможно определение нанограммовых содержаний кодеина с пределом обнаружения 0,4 мкг/дм3. Аналогичные экстракционно-фотометрические измерения с использованием ионных ассоциатов кодеина с рядом красителей также обеспечивают определения его содержания на уровне n мг/дм3 [8].
Твердофазная спектрометрия кодеина. Тонкослойная хроматография (ТСХ) – один из скрининговых методов идентификации и последующего определения кодеина [5]. После ТСХ-разделения сопутствующих компонентов хроматографическую зону кодеина проявляют различными окрашивающими реагентами, в частности реактивом Драгендорфа (тетрайодовисмутат калия K[BiI4]) [8]. При этом образуется поверхностный ионный ассоциат кодеина с реактивом Драгендорфа с характерной для него оранжевой окраской. В работе [11] получен спектр диффузного отражения ионного ассоциата кодеина с реактивом Драгендорфа в координатах функции Гуревича – Кубелки – Мунка F(R) = [(1 – R)2/2R] – длина волны (нм). Найдены условия определения кодеина на поверхности ТСХ-пластинки путем измерения коэффициента диффузного отражения (R) образующегося ионного ассоциата при λ = 520 нм с пределом обнаружения 9 мг/дм3.
Пробоподготовка объектов исследования. В соответствии со спецификой методов люминесценции и спектрометрии диффузного отражения оптимальными являются способы пробоподготовки, адаптированные к стадии измерения аналитического сигнала.
Кодеинсодержащие лекарственные препараты представляют собой, как правило, многокомпонентные смеси веществ с различными физико-химическими свойствами. Так, кроме кодеина основными компонентами препаратов выступают парацетамол, пропифеназон, метамизол натрия, кофеин, напроксен, фенобарбитал и др. В способе пробоподготовки [12] применительно к веществам опийной группы на первой стадии экстракцией разделяют соединения кислотного и основного характера. Полученные «щелочные экстракты», содержащие кодеин, парацетамол, пропифеназон, кофеин и продукты разложения анальгина, на второй стадии подвергают ТСХ-процедуре. При этом значения Rf составляют для кодеина (0,23), парацетамола (0,71), анальгина (0,65), кофеина (0,66), пропифеназона (0,60).
Согласно действующему нормативному акту [13] в летальном случае при подозрении на отравление человека ядовитым веществом для судебно-химического исследования необходимо направлять печень и стенку желудка. Известно [8], что большинство действующих компонентов лекарств, в том числе кодеин образуют в органах человека комплексы с белками, прежде всего с альбумином. Таким образом, выделение кодеина из органов человека предполагает разрушение этих комплексов. Для этой цели чаще всего используется метод А.А. Васильевой [14], основанный на выделении кодеина из его комплексов с белками подкисленной водой. Основным мешающим компонентом при определении кодеина в данном случае является морфин. Его влияние устраняют специально подобранной хроматографической системой растворителей (ацетон: хлороформ: 25 %-ный раствор аммиака при объемном соотношении компонентов 24: 12: 1). При этом значения Rf кодеина и морфина при последующем ТСХ-разделении составляют 0,23 и 0,09 соответственно.
В большинстве методик скрининга наркотических и лекарственных веществ в биологических жидкостях человека в качестве объекта исследования используется моча. Кроме того, что имеются достаточные объемы доступных для исследования проб, в моче многие вещества, выводящиеся почками, могут обнаруживаться более длительное время, чем, например, в крови. Присутствующий в организме человека кодеин образует в моче конъюгаты, поэтому первичный этап пробоподготовки – гидролиз этих соединений. Для последующего выделения кодеина из гидролизатов используют процедуру экстракции [15]. В данном случае морфин также является основным мешающим компонентом. Для разделения морфина и кодеина используется свойство последнего экстрагироваться из слабощелочных водных растворов диэтиловым эфиром [8]. При этом морфин образует морфинат и остается в водной фазе.
Определения кодеина в лекарственных препаратах. В работе [10] описана методика определения кодеина в некоторых кодеинсодержащих препаратах (Пенталгин Н, Пенталгин Плюс, Седальгин Нео) с предварительным ТСХ-разделением сопутствующих компонентов по его собственной люминесценции в растворах при λ = 345 нм. В пробоподготовке исходных образцов использованы рекомендации [12]. Основные метрологические характеристики методики: линейный диапазон определяемых содержаний кодеина – 40–1200 мг/дм3, предел обнаружения – 7 мг/дм3, Sr не превышает 0,06.
Значительный выигрыш в экспрессности измерений достигнут при определении кодеина в лекарственных препаратах методом спектроскопии диффузного отражения [11]. После ТСХ-разделения сопутствующих компонентов получают поверхностный ионный ассоциат кодеина с реактивом Драгендорфа и измеряют его коэффициент диффузного отражения при λ = 520 нм. Градуировочный график зависимости функции ΔF от концентрации кодеина линеен в диапазоне 50–1200 мг/дм3. Рассчитанный предел обнаружения составил 15 мг/дм3, а Sr не более 0,05.
Определения кодеина в органах человека. В работе [16] описана методика определения кодеина в биоматериале человека (печень, стенка желудка) по его собственной люминесценции в растворах. Исходные образцы предоставлены экспертами Отдела судебно-медицинской экспертизы трупов КГБУЗ «Красноярское краевое бюро судебно-медицинской экспертизы» при реальном отравлении кодеинсодержащими препаратами. В качестве независимого метода исследования использован метод высокоэффективной жидкостной хроматографии (ВЭЖХ) с ультрафиолетовым детектором. Методика позволяет определять 10–750 мкг/г кодеина с пределом обнаружения – 3 мкг/г, Sr не превышает 0,07.
Определение кодеина в моче человека. Концентрации кодеина в моче человека, подтверждающие его наличие в случаях немедицинского употребления, составляют порядка n·102 мкг/дм3. Для его определения использовано свойство толуольного экстракта ионного ассоциата кодеина с эозином интенсивно флуоресцировать при λ = 550 нм [10]. Для апробации методики взяты образцы мочи потребителей опиатов. Для оценки правильности полученных результатов привлечен метод газовой хроматографии (ГХ) с масс-селективным детектором. Подтверждено определение 30–320 мкг/дм3 кодеина с пределом обнаружения 6 мкг/дм3 и Sr не более 0,06.
Заключение
Приведен научный обзор работ с результатами исследований спектроскопических свойств кодеина в жидкой и твердой фазах, способов пробоподготовки, а также методик его определения в лекарственных препаратах и биологических объектах методами люминесценции и спектрометрии диффузного отражения.
В Государственном реестре лекарственных средств кодеинсодержащие препараты отечественных и зарубежных производителей занимают весьма внушительное место [17]. Методики определения кодеина в лекарственных препаратах (в основном ВЭЖХ) хорошо отработаны и включены в известные фармакопеи [18]. Концентрационные диапазоны ВЭЖХ-определений кодеина в данных объектах составляют порядка n·101 – n·102 мг/дм3 [19]. Однако зачастую в ВЭЖХ-методиках необходимо применение в качестве подвижных фаз токсичных растворителей: метанола и ацетонитрила. В экстракционно-фотометрических методиках определения n·мг/дм3 кодеина в виде его ионных ассоциатов с рядом красителей для экстракции последних используют хлороформ [8]. В разработанных авторами [9, 11] методиках определения кодеина в лекарственных препаратах по его собственной люминесценции в растворах и диффузному отражению ионного ассоциата с реактивом Драгендорфа в твердой фазе не используются токсичные органические растворители, а селективность определений обеспечивается на стадии пробоподготовки.
При определении кодеина во внутренних органах человека также в основном используются методы ВЭЖХ и ГХ [20]. Содержания кодеина в образцах печени и стенки желудка при подтверждении диагноза отравления составляют порядка n•101 – n•102 мкг/г. Соответствующие ВЭЖХ- и ГХ-методики обеспечивают определения до n•10-1 – n•10-2 мкг/г кодеина. Люминесцентная методика определения 10–750 мкг/г кодеина [16] с учетом экономичности и относительной простоты инструментария в данном случае может рассматриваться в качестве дополнительной при определенных условиях.
При определении кодеина в биологических жидкостях человека (кровь, моча) в рамках серийных анализов наиболее эффективным методом является хромато-масс-спектрометрия (ГХ-МС). Достигаемые содержания кодеина составляют n•10 мкг/дм3. Вместе с тем в анализе образцов с низкими содержаниями кодеина на стадии пробоподготовки часто требуются проведение реакций ацилирования или силилирования для получения соответствующих дериватов с применением весьма токсичных реагентов. В этой связи методика [10] также может представлять практический интерес, например, при проведении разовых анализов.
В целом описанные в работах [9–11, 16] методики определения кодеина в биофармобъектах методами люминесценции и спектрометрии диффузного отражения могут быть использованы при решении научных и учебных задач в НИИ, вузах, а после необходимой валидации – в контрольно-аналитических лабораториях соответствующего профиля.
Библиографическая ссылка
Немихин В.В., Качин С.В., Кутяков В.А., Сагалаков С.А. ИССЛЕДОВАНИЯ СПЕКТРОСКОПИЧЕСКИХ СВОЙСТВ КОДЕИНА ДЛЯ ЕГО ОПРЕДЕЛЕНИЯ В ЛЕКАРСТВЕННЫХ ПРЕПАРАТАХ И БИОЛОГИЧЕСКИХ ОБЪЕКТАХ МЕТОДАМИ ЛЮМИНЕСЦЕНЦИИ И СПЕКТРОМЕТРИИ ДИФФУЗНОГО ОТРАЖЕНИЯ // Международный журнал прикладных и фундаментальных исследований. 2019. № 11. С. 126-130;URL: https://applied-research.ru/ru/article/view?id=12943 (дата обращения: 07.03.2026).

