Ревматоидный артрит (РА) по клинико-патогенетическим свойствам относится к хроническим заболеваниям, склонным к прогрессированию. Этиология РА остается до конца не раскрытой, но многочисленные исследования показывают, что генетическая предрасположенность, наличие инфекционных заболеваний и совокупность таких факторов, как переохлаждение, интоксикации, стрессы, последствия химического мутагенеза, нарушение эндокринного статуса организма и т.п., являются пусковым механизмом развития аутоимунных реакций организма [1, 2].
Патогенетическая сложность РА заключается в наличии наследственной склонности к аутоиммунному ответу организма, вовлечению в патологический процесс синовиальной оболочки суставов, околосуставных тканей, дегенеративных поражений костей, нарушениям микроциркуляции и метаболизма. В тяжелых случаях развиваются сопутствующие патологии: ранние атеросклеротические изменения стенки артерий, поражения миокарда, инсульты, тромбозы сосудов, кератит, поражения почек, гранулема легких, что свидетельствует о мультиморбидности РА [3, 4]. Наличие выраженного болевого синдрома, прогрессирующее ограничение двигательной активности, часто приводящее к инвалидизации населения, необходимость эндопротезирования мелких и крупных суставов, длительное дорогостоящее лечение оказывают в совокупности отрицательное воздействие на качество жизни и трудоспособность больного [5]. Заболевание гетерогенно по половому и возрастному признакам: чаще встречается у женщин и пожилых пациентов, затрагивая от 0,5 до 1 % населения в различных странах [6, 7]. Смертность от РА оказывается на 70 % выше среднепопуляционной [5, 8]. В этой связи ранняя диагностика выступает в качестве ключевого фактора, способствующего достижению наиболее желательных результатов при терапевтическом воздействии, направленном на снижение процессов, ведущих к разрушению суставов. Эффективность лечения определяется максимально сжатыми сроками постановки диагноза и начала терапевтического воздействия [7]. Сложности ранней диагностики зависят от получения в достаточном объеме клинической информации, изучения и анализа истории болезни пациента, результатов лабораторных и рентгенологических исследований. Несмотря на достижения современной фармакологии, препаратов, способствующих полному излечиванию заболевания, к настоящему времени не существует [8]. С целью разработки высокоэффективной терапии, активно изучаются механизмы патогенеза РА, реализуемого на различных моделях у лабораторных животных. Наибольшего распространения получили [9]:
– артриты, обусловленные неспецифическим воздействием на иммунную систему путем введения масляных растворов (адъюванта Фрейнда; пристана и др. масляных растворов);
– артриты, вызванные целенаправленным воздействием на хрящевую ткань (коллаген -, протеогликан-индуцированные РА);
– артриты, индуцированные инфекционными агентами или их токсинами (фрагменты клеточной мембраны стрептококков; антигены различной природы);
– трансгенные животные со спонтанным возникновением РА.
Исследования патогенеза РА на животных способствовали раскрытию механизмов патогенеза, что привело к разработке и апробированию препаратов, облегчающих симптоматику и создающих основу наступления длительных периодов ремиссии [10].
Учитывая молекулярную гетерогенность и сложность клинических проявлений ревматоидного артрита, не до конца раскрытые этиологические причины его возникновения, изучение отдельных механизмов патогенеза данного заболевания продолжает оставаться актуальным для современной медицины.
Цель исследования: изучение в динамике функциональных особенностей лимфоцитов крыс в модели аутоиммунного артрита, индуцированного введением адъюванта Фрейнда.
Материалы и методы исследования
Работа проведена на старых (более 400 г) самцах крыс линии Вистар, разделенных на две равные группы по 8 животных в каждой. Крысам контрольной группы под общим наркозом (Золетил) вводили в правую заднюю конечность п/к физиологический раствор в объеме 0,1 мл на 200 г веса. Опытным животным по той же схеме вводили адъювант Фрейнда (АФ).
По истечении 1, 3 и 7 недель у животных под общим наркозом из сердца отбирали кровь, которую с помощью прибора для нанесения мазков MicroscopyVision (Австрия) наносили на стекла. Препараты высушивали и фиксировали в 60 % растворе ацетона в течение 30 с, ополаскивали дистиллированной водой. Затем стекла инкубировали при температуре 37 °С в течение 1 часа в среде, содержащей 125 ммоль/л KCl, 10 ммоль/л HEPES, 1 мг/л нитросинеготетразолия окисленного, 5 ммоль/л молочной кислоты, 5 ммоль/л малоновой кислоты, 0,5 ммоль/л НАДН. Стекла промывали дистиллированной водой, высушивали и окрашивали в 0,05 % растворе нейтрального красного, имеющего сродство к ядрам клеток [11]. Препараты микроскопировали при увеличении 10х100 под масляной иммерсией. На каждую крысу исследовалось по 100 клеток, которые для рандомизации отбирались из трех зон стекла: начальной, средней и финишной. Препараты фотографировали и обрабатывали в программе Bio Images (г. Пущино), позволяющей рассчитывать площадные характеристики клеток и их компартментов, а также вычислять количество образуемого маркера дыхательной активности митохондрий – диформазана.
Статистическая обработка результатов осуществлялась по критерию Стьюдента в программе Microsoft Excel.
Общее количество лейкоцитов подсчитывали под микроскопом, используя камеру Горяева, при малом увеличении 10х10. Препараты готовили стандартным способом, используя для окраски ядер лейкоцитов 100 мл 5 % раствор уксусной кислоты и 1 мл 1 % раствора метиленового синего. Скорость оседания эритроцитов измеряли по методу Панченкова. Использовали стандартный капилляр Панченкова со шкалой от 0 до 100 мм. Раствор цитрата натрия (5 %) набирали до отметки «Р» и помещали его в пробирку. Затем производили еще два забора крови капилляром до буквы «К», переливая ее в ту же пробирку. Содержимое тщательно перемешивали и вновь набирали в капилляр до отметки «К». Капилляр фиксировали в штативе в строго вертикальном положении. Для каждой анализируемой пробы устанавливали отдельный таймер. Через 60 мин, по высоте прозрачного столба, подсчитывали скорость отделения эритроцитов от плазмы [12].
Результаты исследования и их обсуждение
Введение крысам адъюванта Фрейнда, представляющего собой суспензию туберкулезных микобактерий, обусловило ответную иммунную реакцию, что проявилось изменением численности клеток белой крови (рис. 1).
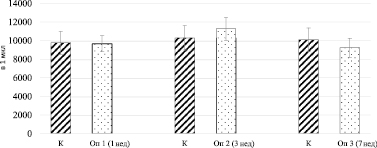
Рис. 1. Динамика общего количества лейкоцитов периферической крови у крыс в условиях индуцированного аутоиммунного артрита
Из графика следует, что воспалительный процесс, обусловленный введением АФ, протекал волнообразно с максимумом на третьей неделе – количество лейкоцитов при этом возрастало от уровня контрольных значенийс 9,8 до 11,3 тыс/мкл. К седьмой неделе отмечался плавный спад и количество лейкоцитов возвращалось к норме. Однако общие наблюдения показали, что животные к этому времени становились малоподвижными, а пальпацией выявлялись начальные признаки деформации суставов.
Известно, что косвенным доказательством воспалительных реакций организма является тест на определение скорости оседания эритроцитов. В этой связи нами выявлена динамика изменений, затрагивающих в первую очередь белковый состав плазмы, определяющий способность к агрегации клеток красной крови (рис. 2).
Из рис. 2 видно, что анализируемый клинический показатель характеризуется широкой вариабельностью у животных опытной и контрольной групп. Разброс показателей, определяющий величину стандартной ошибки среднего, не выявляет достоверных различий между сравниваемыми выборками. Тем не менее во всех трех экспериментах очевидна тенденция к росту показателя СОЭ в опытных группах. В числе агломеринов, регулирующих объединение эритроцитов в крупные агрегатные комплексы, находятся белки острой фазы, выступающие маркерами воспалительного процесса. Из графика видно, что уже к окончанию первой недели с момента введения животным суспензии микобактерий, отмечается выраженная иммунная реакция, косвенно проявляемая повышенной склонностью красных кровяных телец к седиментации. Ее интенсивность возрастает к третьей неделе наблюдений и в дальнейшем сохраняется на отметке, превышающей контрольные показатели на 87–100 %.
Сопоставление графиков на рис. 1 и 2 показывает, что в механизмах индуцированного аутоиммунного артрита принимают участие как клеточное, так и гуморальное звенья иммунной системы. При этом если участие клеточного звена – визуализируемое общей численностью лейкоцитов, проходя через максимум, возвращается к норме, то интенсивность ответных гуморальных реакций остается выраженной и на стадиях перехода заболевания в хроническую форму.
Одновременно с клиническими наблюдениями осуществлялся контроль активности ферментов митохондрий лимфоцитов, участвующих в энергетическом обмене клеток. Выбор иммунокомпетентных клеток в качестве объекта исследования определялся их непосредственной вовлеченностью в патологический процесс и высокой скоростью пролиферации, дающей информацию о состоянии организма in situ. На рис. 2 показано, что интегральный профиль дегидрогеназной активности представителей клеточного иммунитета качественно воспроизводит характер течения патологии, отраженный на рис. 1.
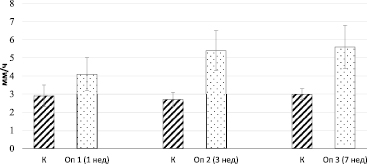
Рис. 2. Скорость оседания эритроцитов у крыс в условиях индуцированного аутоиммунного артрита
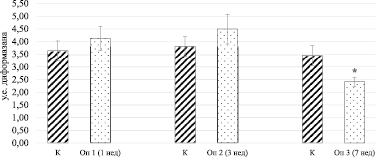
Рис. 3. Динамика метаболической активности митохондрий лимфоцитов периферической крови у крыс в условиях индуцированного аутоиммунного артрита (* – Р < 0,05)
Введение АФ к окончанию первой недели сопровождалось повышением дыхательной активности клеток на 13 %, максимум которой наблюдался на 3-й неделе эксперимента – 18 %. Достоверные различия с контролем у животных опытных групп отмечались к 7-й неделе с момента индукции аутоиммунного артрита. В это время фиксировался спад (относительно контрольных животных) общего энергообеспечения, проявляемый снижением образования диформазана, выступающего в качестве чувствительного индикатора метаболической активности митохондрий на 31 % [13].
Таким образом, динамика изменения численности клеток белой крови в процессе формирования адъювантного артрита представляла волнообразный процесс с максимумом на 3-й неделе и сохранением напряженности в гуморальном звене иммунной системы на всем этапе проведенных исследований. Механизмы развития аутоиммунного артрита ассоциированы с гиперактивацией тканевого дыхания в остром периоде заболевания и снижением энергообеспечения клеток в стадии хронизации патологии.
Библиографическая ссылка
Скупневский С.В., Пухаева Е.Г., Бадтиев А.К., Руруа Ф.К., Батагова Ф.Э., Фарниева Ж.Г. ФУНКЦИОНАЛЬНЫЕ ОСОБЕННОСТИ ЛИМФОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ В ДИНАМИКЕ АУТОИММУННОГО АРТРИТА У КРЫС // Международный журнал прикладных и фундаментальных исследований. 2019. № 12-1. С. 82-86;URL: https://applied-research.ru/ru/article/view?id=12958 (дата обращения: 21.12.2025).

