Рациональное и комплексное использование биологических ресурсов Мирового океана предусматривает максимальное вовлечение в производство непищевых отходов и неиспользуемых в народном хозяйстве гидробионтов в качестве новых источников пищевой, кормовой, технической продукции.
При этом на нынешнем этапе эколого-биологического состояния окружающей среды нужен был какой-то серьезный перелом в традиционном отношении к биологическим ресурсам морских и пресноводных акваторий Мирового океана, которые находили в основном области пищевого и кормового применения. И как раз обострение «сырьевого» голода в фармацевтической промышленности, острый дефицит БАВ, сужение базы сухопутных источников и наметившийся пересмотр традиций в эксплуатации богатств Мирового океана вообще послужили основой разработки новых принципов утилизации морских гидробионтов как продуцентов химических соединений, представляющих интерес для лекарствоведения, разработки специальной отрасли лекарствоведения – морской фармации [1, 2].
Выбор в качестве источников биологически активных соединений гидробионтов акватории Черного моря позволяет решить ряд экологических проблем региона. Во-первых, проблему резкого истощения традиционных источников получения новых лекарственных препаратов, основу которых составляют БАВ сухопутных организмов (растений и животных), и постоянно возрастающей цены на них. Во-вторых, позволяет избежать больших потерь при обработке промысловых водных организмов (до 60 % от массы улова), что представляет собой очень большой сырьевой резерв, а также реализовать принцип рационального и комплексного использования водных биологических ресурсов, максимального вовлечения значительных скоплений в территориальных водах непромысловых гидробионтов, в частности морских беспозвоночных, в сочетании с разработкой актуальных ресурсосберегающих и малоотходных технологий использования гидробионтов, снижающих дополнительную нагрузку на экосферу. В-третьих, дает начало формированию комплексной системы ресурсоведения гидробионтов Черного моря как новой отрасли современного лекарствоведения, требующей значительных усилий в сфере географического распространения и в сфере определения запасов.
Кроме того, биологически активные вещества водных животных и растений обладают уникальными свойствами, связанными с условиями существования гидробионтов в водной среде, характеризующейся высоким содержанием соли, низким освещением или полным его отсутствием, высоким давлением и необычно высокими или низкими температурами, что обеспечивает отличие морских организмов и их метаболитов от организмов с земной биологией. Гидробионты водной среды вырабатывают структурно уникальные и разнообразные вторичные метаболиты, нехарактерные для наземных организмов, многие из которых отличаются экстремально высокой биологической и фармакологической активностью. Метаболиты водных организмов представлены такими функциональными соединениями, как каротиноиды, фосфолипиды, сапонины, полиненасыщенные жирные кислоты класса омега-3, омега-6, которые проявляют высокую антиоксидантную (АОА), иммуномодулирующую, радиопротекторную, противоопухолевую активности в дозах, необходимых для лечения и профилактики многих заболеваний, очень малых ввиду их чрезвычайно высокой активности [1, 2].
Еще одним положительным фактором применения биологически активных веществ морского происхождения является экономическая выгода, обусловленная относительной доступностью, огромным разнообразием структур, колоссальными запасами и успешно воспроизводимостью сырьевой базы.
В данной работе представлены результаты исследований по отработке малоотходных и ресурсосберегающих технологий извлечения биологически активных веществ из непромысловых гидробионтов прибрежных зон акватории Черного моря, а также предварительной оценки биохимической активности полученных субстратов.
Материалы и методы исследования
В качестве объектов исследования выступали морские беспозвоночные (рапаны, мидии) и концентрат культуральной среды хлореллы.
Субстраты биологически активных веществ из тканей беспозвоночных извлекали методом двухфазной экстракции в сочетании с ультразвуком. Метод двухфазной экстракции позволяет при применении в качестве экстрагента двухфазной системы растворителей (спиртоводная смесь/масло) одновременно проэкстрагировать из сырья гидрофильные и гидрофобные вещества при приготовлении экстрактов и комплексов на основе морских гидробионтов, при этом преимущественно гидрофильные вещества остаются в спиртоводной фазе, а липофильные переходят в масляную. Сочетание двухфазной экстракции с ультразвуком обеспечивает более глубокое проникновение растворителя в материал с клеточной структурой, уменьшает продолжительность обработки, обеспечивает более высокий выход продукта и воспроизводимость, снижает расход растворителя, увеличивает скорость процесса, позволяет экстрагировать термолабильные вещества [3].
Для полученных субстратов определяли антиокислительную активность методом, позволяющим проводить скрининг лекарственного сырья, фитопрепаратов и биологически активных веществ с высокой антиокислительной активностью (АОА) и включающим взаимодействие анализируемой пробы с перманганатом калия до обесцвечивания последнего в водной сернокислой среде при комнатной температуре [4], и антимикробную активность методом, основанным на проращивании в питательной среде.
Предварительную оценку протекторной активности полученных препаративных форм проводили при детальном изучении кинетики суммарного процесса ферментативных реакций спиртового брожения в замкнутой системе и последующем сравнении отдельных параметров картины хода реакции в отсутствие полученных препаративных веществ и при их различных концентрациях в растворе. В качестве модельного организма для проведения данной серии экспериментов были выбраны микроскопические грибы, относящиеся к биологическому виду Saccharomyces Cerevisiae (дрожжи верхового брожения) как один из наиболее изученных модельных организмов. В качестве экзогенного токсиканта использовали соль тяжелого металла [5].
Оценку пролиферативной активности (роста и митогенной активности) лимфоцитов в культуре in vitro под воздействием субстратов биологически активных веществ беспозвоночных проводили стандартным полумикрометодом культивирования лимфоцитов периферической крови низших обезьян с некоторыми модификациями с последующим проведением цитогенетического анализа исследуемых кариотипов (приготовление препаратов метафазных хромосом, окрашивание хромосом, количественный анализ метафазных пластинок) [6].
Влияние антиульцерогенной активности концентрата культуральной среды хлореллы изучали на модели экспериментального повреждения слизистой оболочки желудка у 10 мышей обоего пола. Экспериментальное повреждение слизистой оболочки желудка моделировали путем однократного внутрижелудочного введения этанола (1 мл 96 °/200 г массы животного). Оценку ульцерогенного эффекта производили через 1 ч после введения спирта. Степень повреждений слизистой желудка и ее тяжесть характеризовали на основании расчетов суммарной длины язвенных поражений (в мм) у каждой мыши [7].
Результаты исследования и их обсуждение
Сочетание двухфазной экстракции с ультразвуковым воздействием позволяет достичь значений антиокислительной активности (АОА), равных АОА субстратов, полученных при классическом экстрагировании при перемешивании через 96 ч, в течение 60–180 мин в зависимости от свойств исходного сырья.
Анализ результатов исследований антиокислительной активности субстратов биологически активных веществ позволил сделать следующие выводы. Антиокислительная активность (АОА) возрастает с увеличением времени воздействия ультразвука. АОА субстратов в масляной фазе выше АОА субстратов, полученных в аналогичных условиях, в водно-спиртовой фазе в 2–3 раза. АОА субстратов биологически активных веществ, извлеченных из тканей рапанов, выше АОА субстратов, полученных на основе тканей мидий, при времени воздействия ультразвука от 6 до 12 ч. Время воздействия УЗ для получения экстрактов с оптимальными значениями АОА в масляной и водно-спиртовой фазах составляет 3 ч. Результаты исследований представлены на рис. 1, 2.
Исследование антимикробной активности проводили методом проращивания в питательной среде субстратов с оптимальными значениями АОА в масляной и водно-спиртовой фазах (время ультразвуковой обработки 3 ч) в соотношении 20 мкл экстракта на 1 мл среды. Полученные образцы термостатировали и в течение длительного времени вели визуальное наблюдение. В течение 30 дней со дня посева прорастание питательной среды не наблюдалось, что может являться косвенным подтверждением выраженной противомикробной активности исследуемых образцов.
Оценка протекторных свойств субстратов беспозвоночных показала следующие результаты. Влияние субстратов биологически активных веществ на максимально возможную скорость ферментативного брожения дрожжей в присутствии солей тяжелых металлов в основном бывает положительным, т.е. повышает ее изменение. В основном все субстраты существенно замедляют стадию угасания ферментативного брожения дрожжей в присутствии солей тяжелых металлов в замкнутой системе. Протекторные свойства спиртовых вытяжек проявляются более выраженно при более высоком содержании в замкнутой системе и практически идентично при всех концентрациях соли тяжелого металла (свинца). Протекторная активность масляных вытяжек выражена выше, чем у спиртовых, в среднем в два раза. При этом протекторные свойства этих образцов значительно выше в области высоких и низких концентраций соли тяжелого металла (свинца). При большем содержании масляной вытяжки протекторная активность снижается. Результаты исследований представлены на рис. 3, 4.
Действие вытяжек биологически активных веществ, извлеченных из тканей мидий, на живые клетки, многофакторно: во-первых, компоненты экстрактов могут транспортироваться внутрь клетки для последующего использования в качестве источника недостающих макроэлементов (N, P, S и т.д.) – таким образом проявляя активность в качестве субстрата; во-вторых, компоненты экстрактов, адсорбируясь на поверхностях биологических мембран, влияют на регуляцию обменных процессов, способствуя защите клеток от неблагоприятных концентраций продуктов жизнедеятельности или же блокируя пропускную способность мембран в случае высоких концентраций – проявляя протекторную активность (в более сложных системах, включающих ионы тяжелых металлов, протекторная функция, возможно, будет выражаться в адсорбции данных ионов).
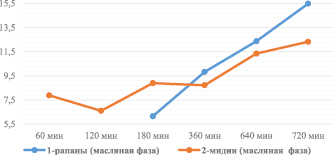
Рис. 1. Антиокислительная активность субстратов биологически активных веществ из мидий и рапанов в масляной фазе (по содержанию суммы биологически активных веществ с антиоксидантными свойствами, мг/г)
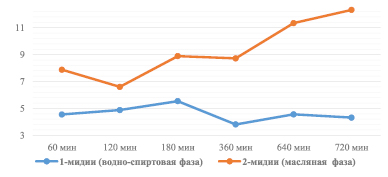
Рис. 2. Антиокислительная активность субстратов биологически активных веществ из мидий (по содержанию суммы биологически активных веществ с антиоксидантными свойствами, мг/г)
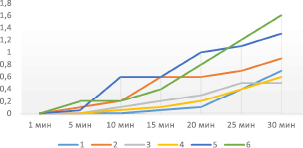
Рис. 3. Экспериментальная зависимость скорости суммарного процесса ферментативного брожения дрожжей от времени (объем СО2(см3) от времени протекания реакции) в замкнутой системе в присутствии спиртовой вытяжки биологически активных веществ мидий (1,0 мл) и соли тяжелого металла различной концентрации (1 – 0,1 М; 2 – 0,002 М; 3 – 0,004 М; 4 – 0,0008 М; 5 – 0,00016 М; 6 – 0,000032 М)
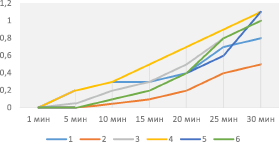
Рис. 4. Экспериментальная зависимость скорости суммарного процесса ферментативного брожения дрожжей от времени (объем СО2 (см3) от времени протекания реакции) в замкнутой системе в присутствии масляной вытяжки биологически активных веществ мидий (1,0 мл) и соли тяжелого металла различной концентрации (1 – 0,1 М; 2 – 0,002 М; 3 – 0,004 М; 4 – 0,0008М; 5 – 0,00016 М; 6 – 0,000032 М)
Рост и митогенную активность лимфоцитов периферической крови низших обезьян оценивали при воздействии вытяжек биологически активных веществ, извлеченных из тканей мидий в масляную и водно-спиртовую фазу при времени ультразвуковой обработки в течение 3 ч. Уровень митогенной активности для контрольного образца составил на 1000 клеток 18 митозов; для образца с внесенным комплексом биологически активных веществ в водно-спиртовой фазе – 22 митоза; для образца с внесенным комплексом биологически активных веществ в масляной фазе – 48 митозов. При внесении в среду эндогенного токсиканта – соли тяжелого металла – уровень митогенной активности уменьшался, тогда как в присутствии спиртовой вытяжки сохранялся на уровне контрольного образца, а в присутствии масляной вытяжки сохранялся выраженный рост.
Результаты изученного нами ранее влияния антиульцерогенной активности концентрата культуральной среды хлореллы на модели экспериментального повреждения слизистой оболочки желудка показали наличие положительной динамики заживления слизистой. Используемый концентрат уже через 3 дня применения на 27 % (р < 0,001) уменьшал среднее число изъязвлений. Это позволяет считать данное средство активным и способным к достаточно быстрой репаративной регенерации, возможно за счёт противоотёчного, антиоксидантного и капилляроукрепляющего эффекта [7, 8].
Заключение
Полученные данные позволяют использовать метод двухфазной экстракции в сочетании с ультразвуковым озвучанием как достаточно эффективный при обработке сырья такого типа и рекомендовать в призме актуальных ресурсосберегающих и малоотходных технологий. Выделенные субстраты, содержащие биологически активные вещества гидробионтов, обладают достаточно выраженной биохимической, протекторной, регенерирующей, ростовой и фармакологической активностью в отношении клеток живых систем, что дает возможность предполагать высокий синергетический эффект в комбинации с производными микроводоросли хлореллы.
Учитывая вышеизложенное акцентирование возможностей по созданию универсальных биосубстратов, считаем целесо- образным продолжение экспериментальных исследований по разработке технологий получения биологически активных веществ гидробионтов в сочетании с методиками, основанными на микроводоросли хлорелла, для создания высокоэффективных препаратов разной соматической направленности.
Библиографическая ссылка
Чжу О.П., Аравиашвили Д.Э., Туманова А.Л. РАЗРАБОТКА СИСТЕМЫ РЕСУРСОВЕДЕНИЯ ГИДРОБИОНТОВ ЧЕРНОГО МОРЯ КАК НОВОЙ ЭКОНОМИЧЕСКИ ВЫГОДНОЙ ОТРАСЛИ ФАРМАЦИИ С ЦЕЛЬЮ СОХРАНЕНИЯ ЭКОЛОГИИ И ЗДОРОВЬЯ ЧЕЛОВЕКА // Международный журнал прикладных и фундаментальных исследований. 2019. № 12-1. С. 87-92;URL: https://applied-research.ru/ru/article/view?id=12959 (дата обращения: 16.02.2026).

