Известно, что тучные клетки играют большую роль в управлении поддержанием состояния соединительной ткани. Тучные клетки, как часть иммунной системы, играют ключевую роль в защите хозяина от нескольких патогенных микроорганизмов и в инициации аллергического иммунного ответа [1].
Во время дегрануляции тучные клетки секретируют определенный набор медиаторов, включая предварительно сформированные медиаторы, которые уже были синтезированы клеткой и содержатся в цитоплазматических гранулах. В эту группу входят сериновые протеазы, в частности химаза и триптаза [2]. Биологическая значимость химазы зависит от механизмов дегрануляции и характеризуется избирательным воздействием на клеточные и неклеточные компоненты специфического тканевого микроокружения. Известно, что химаза тесно связана с механизмами воспаления и аллергии, ангиогенеза и онкогенеза, ремоделирования внеклеточного матрикса соединительной ткани и изменениями в гистоархитектонике органов [3].
При гистологическом исследовании применяют различные способы выявления тучных клеток на препаратах. Эти способы базируются на способности стандартных гистологических красителей метахроматично окрашивать гранулы, находящиеся в тучных клетках. Так, Enerback L. et al. (1986) с данной целью применяли 1 % подкисленный водный раствор толуидинового синего [4].
Показано, что по критерию контраста тучных клеток на фоне соединительной ткани лучшие результаты демонстрирует окрашивание по Мей-Грюнвальду, на втором месте по эффективности среди классических гистологических окрасок оказался метод окрашивания толуидиновым синим, поскольку он занимает меньше времени [5].
Однако перечисленные способы приводят к окраске не исключительно тучных клеток, но и других клеток, которые находятся на гистологическом срезе. Данное обстоятельство влияет на идентификацию тучных клеток.
Более специфичными способами являются приемы, основанные на специфическом выявлении биологически активных субстанций, содержащихся в гранулах тучных клеток. Например, гистамина, мелатонина и серотонина [6]. Однако данный метод требует одновременного применения окрашивания трех серийных срезов, что приводит к повышению трудоемкости работы и требует существенных финансовых затрат.
Еще более трудоемким является способ сочетания окрашивания на биологически активное вещество серотонин с одновременным исследованием полутонких срезов ткани [7]. Необходимость использования дорогостоящего оборудования, не имеющего широкого применения в работе лечебно-профилактических учреждений – трансмиссионного электронного микроскопа, а также трудоемкость и длительность приготовления препаратов для электронной микроскопии существенно снижает доступность данного метода диагностики.
Предпринимались попытки использования иммуногистохимических методов окрашивания для выявления тучных клеток, основанные на визуализации результата взаимодействия антиген – антитело. В частности, применялось окрашивание гепарин-протеинового комплекса тучных клеток [8]. Однако данный способ апробирован только при исследовании тканей животных и не используется для выявления тучных клеток у человека.
Цель исследования: разработка способа идентификации тучных клеток на гистологических срезах, обеспечивающего специ- фическое окрашивание тучных клеток.
Материалы и методы исследования
Образцы различных тканей фиксировали в растворе 10 % нейтрального забуференного формалина, дегидратировали, изготавливали парафиновые блоки. Гистологические срезы помещали на стекла, обработанные поли-L-лизином (Thermo scientific). Проводили иммуногистохимическое окрашивание препаратов по методике, описанной нами ранее и показавшей хорошую стабильность при окраске на эндотелин [9, 10], маркеры дифференцировки фибробластов [11, 12].
Для иммуногистохимического окрашивания использовали первичные антитела, в качестве которых использовали антитела к рецептору фактора роста эндотелия сосудов 1 типа (анти-VEGFR1) (Sigma), в рабочем разведении 1:50. Затем наносили вторичные антитела, меченные пероксидазой. Срезы докрашивали 0.02 % раствором гематоксилина. Оценивали наличие специфической окраски на гистологических препаратах [13]. Параллельно парные срезы окрашивали гематоксилином и эозином. Сравнивали количество положительно окрашенных клеток на препаратах. Различия между методами окраски оценивали с помощью t-критерия Стьюдента.
Результаты исследования и их обсуждение
В настоящем исследовании мы окрашивали препараты разработанным нами способом. Всего исследования подвергались 75 препаратов различных тканей, преимущественно соединительной и мышечной ткани, в том числе в разных партиях повторно исследовались идентичные препараты. В результате проведенного исследования установлено, что предложенным нами способом тучные клетки хорошо выявляются на гистологических срезах соединительной ткани (рис. 1). Не менее эффективно данные клетки обнаружены нами в мышечной ткани (рис. 2) за счет яркого специфического окрашивания. При визуализации гистологических препаратов тучные клетки представляют собой клетки с неровной поверхностью, четко видны мелкие шарикообразные гранулы, ярко окрашенные. На части препаратов обнаружена дегрануляция тучных клеток, при этом гранулы четко видны в прилегающих к месту расположения клетки пространстве, таким образом дополнительно можно оценить активности дегрануляции тучных клеток в изучаемых образцах (рис. 3).
Очень характерно, что на препаратах специфически окрашивались только тучные клетки. Окраски каких-либо других клеток нами не получено. При применении данного способа была выявлена хорошая стабильность получаемых результатов. Окрашивание срезов с одного и того же блока в разных партиях приводило к сопоставимым результатам.
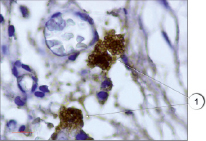
Рис. 1. Ярко окрашенные тучные клетки в соединительной ткани. Иммуногистохимия (краситель DAB, первичные антитела к VEGFR1, докрашивание гематоксилином), ув. х1000. 1 – тучные клетки
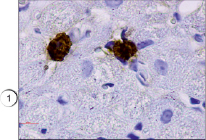
Рис. 2. Ярко окрашенные тучные клетки в мышечной ткани. Иммуногистохимия (краситель DAB, первичные антитела к VEGFR1, докрашивание гематоксилином), ув. х1000. 1 – тучные клетки
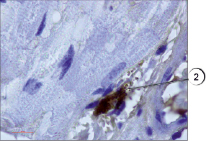
Рис. 3. Дегрануляция тучной клетки в мышечной ткани. Иммуногистохимия (краситель DAB, первичные антитела к VEGFR1, докрашивание гематоксилином), ув. х1000. 2 – дегрануляция тучной клетки
Яркие преимущества показала предложенная методика в сравнении со стандарными методами, применяющимися в практике работы гистологических лабораторий, в частности в сравнении с использованием гематоксилина и эозина. Данное преимущество наглядно продемонстрировано на рис. 4 и 5: на рис. 4 представлена окраска гематоксилином и эозином; на рис. 5 – окрашивание препарата соединительной ткани предлагаемым способом.
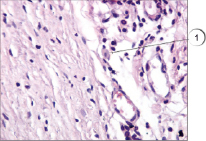
Рис. 4. Тучные клетки в соединительной ткани. Окраска гематоксилином и эозином, ув. х400. 1 – тучная клетка
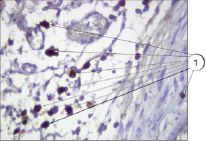
Рис. 5. Тучные клетки в соединительной ткани. Иммуногистохимия (краситель DAB, первичные антитела к VEGFR1, докрашивание гематоксилином), ув. х400. 1 – тучные клетки
При оценке эффективности выявления тучных клеток на препаратах, окрашенных предложенным методом и окрашенных гематоксилином и эозином, установлено достоверное повышение количества выявляемых клеток при использовании оригинального способа – 9,87 ± 0,91 и 2,52 ± 0,22 соответственно (р < 0001).
Как известно, тучные клетки человека продуцируют большое количество ангиогенных и лимфангиогенных молекул [14]. Тучные клетки человека экспрессируют рецептор к вазоэндотелиальному фактору роста (VEGFR-1) и 2 (VEGFR-2). Эти данные указывают на то, что тучные клетки человека могут участвовать в сложной сети, включающей воспалительный и опухолевый ангиогенез и лимфангиогенез [15]. С этим может быть связано обнаруженное нами большое количество рецепторов к вазоэндотелиальному фактору роста, выявленное нами на поверхности тучных клеток. При этом рецепторы выявлены не только на поверхности клетки, но и в содержимом секретируемых гранул.
Заключение
Таким образом, предлагаемая технология позволяет четко выявлять тучные клетки на гистологическом препарате. Может быть использована в области патоморфологии, судебной медицины, а также при проведении научных исследований. Технология хорошо адаптирована с методиками, применяемыми при патологоанатомическом исследовании.
Библиографическая ссылка
Шурыгина И.А., Шурыгин М.Г. ИДЕНТИФИКАЦИЯ ТУЧНЫХ КЛЕТОК В ГИСТОЛОГИЧЕСКОМ ПРЕПАРАТЕ // Международный журнал прикладных и фундаментальных исследований. 2019. № 12-1. С. 97-100;URL: https://applied-research.ru/ru/article/view?id=12961 (дата обращения: 08.01.2026).
DOI: https://doi.org/10.17513/mjpfi.12961

