Факторы роста фибробластов (FGF – fibroblast growth factors) представляют собой семейство низкомолекулярных гепарин-связывающих структурно родственных полипептидов, состоящее из 23 белковых факторов. FGF характеризуются широким спектром биологических активностей в отношении различных типов клеток, основной из которых считается митогенная активность в отношении фибробластов, а также эндотелиальных клеток, хондроцитов, меланоцитов, гладкомышечных клеток сосудов и др. [1, 2].
Одним из первых идентифицированных и наиболее изученных факторов является основной фактор роста фибробластов (bFGF или FGF2). В организме bFGF выполняет многочисленные функции: участвует в репарации тканей, стимулирует ангиогенез в нормальном и патологическом состояниях (при канцерогенезе), влияет на тонус сосудов, участвует в воспалительных реакциях, важен для нормального развития плода, играет роль в развитии коры головного мозга и дифференциации тканей. Кроме того, bFGF является одним из медиаторов клеточной пролиферации и подавления клеточной гибели при канцерогенезе [2]. На клеточном уровне FGF стимулирует пролиферацию фибробластов и эндотелиальных клеток, способствует миграции эндотелиоцитов, регулируя протеолиз и экспрессию молекул адгезии, подавляет апоптоз нейронов, стимулирует выработку IL-6 [1, 2]. Кроме того, bFGF может играть роль в активации фибробластов в процессе репарации ткани в норме, в также при патологическом развитии фиброза. При этом активированные фибробласты отличаются морфологически и функционально от неактивированных клеток и характеризуются более крупными размерами, большей подвижностью и гиперсинтезом белков внеклеточного матрикса, в частности коллагенов I и III, а также экспрессией таких белков, как α-гладкомышечный актин (α-SMA), белок активации фибробластов (FAP), матричные металлопротеиназы (MMPs) и их ингибиторы (TIMPs) и т.д. [3].
В связи с этим целью данной работы является изучение воздействия bFGF на культуру перитонеальных фибробластов крысы и содержание в клетках антиапоптотического белка Bcl-2.
Материалы и методы исследования
Выделение первичной культуры фибробластов из сальника крысы
Проведен острый эксперимент по выделению первичной культуры фибробластов из сальника взрослой крысы линии Wistar весом 200 г. Животных содержали в условиях вивария при свободном доступе к пище и воде на рационе питания, соответствующем нормативам ГОСТа. Эксперимент на животных выполнялся в соответствии с правилами гуманного обращения с животными, которые регламентированы «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу Министерства здравоохранения СССР от 12.08.1977 г. № 755). Все оперативные вмешательства проводились в асептических условиях. В качестве наркоза внутримышечно вводили 2 % рометар в расчете 0,2 мл на кг веса.
Первичную культуру получали, фрагментируя иссеченный сальник и дезагрегируя фрагменты ткани при 37 °С в DMEM (Dulbecco’s Modified Eagle’s Medium), содержащей 200 ед/мл коллагеназы, 2 % антибиотик/антимикотик (10,000 ед/мл пенициллина, 10,000 мкг/мл стрептомицина и 25 мкг/мл амфотерицина B, Gibco). Активность коллагеназы в суспензии подавляли равным количеством DMEM, содержащей 15 % FBS (Fetal Bovine Serum, Sigma-Aldrich) и 1 % антибиотик/антимикотик, после чего клетки дважды промывали в DMEM, дополненной 10 % FBS, 1 % антибиотиком/антимикотиком, центрифугируя суспензию при 500 G в течение 5 мин. Культивировали выделенные фибробласты в DMEM, содержащей 10 % FBS, 1 % антибиотик/антимикотик при температуре 37 °С, влажности 80 % и 5 % СО2 в Biostation CT, Nikon.
Для получения чистой культуры фибробласты субкультивировали через каждые 7 суток и после третьего пассажа обрабатывали bFGF в концентрации 133 пг/мл. Контролем служили клетки, не подвергавшиеся воздействию фактора роста (в культуру вносили соответствующее количество DMEM).
Иммунофлюоресцентное окрашивание
Для иммунофлуоресцентного исследования клетки фиксировали 70 % этанолом и окрашивали антителами к Bcl-2 (Cat. 1017-S, Lot E01182, Epitomics) в рабочем разведении 1:200. В качестве вторичных антител использовали Alexa fluor 488 goat anti-rabbit IgG (Invitrogen, Cat. A-11034) в разведении 1:300. Ядра окрашивали Hoechst (Invitrogen, Cat. NН-3570, Lot822389), 1:300.
Для визуализации специфической окраски и фотофиксации образцов использовали BioStation CT 4.1, Nikon, анализа интенсивности флуоресценции проводили при помощи программного продукта NIS-Elements AR, v. 5.00. Статистический анализ осуществляли в среде программирования R. В исследовании использовали оборудование центра коллективного пользования «Диагностические изображения в хирургии».
Результаты исследования и их обсуждение
Морфологические изменения в культуре перитонеальных фибробластов
На первом этапе нами была получена первичная культура фибробластов из сальника крысы. По прошествии семи суток клетки субкультивировали для перехода к чистой культуре, и после трех пассажей фибробласты были введены в эксперимент. В результате активации клеток фактором роста фибробластов в концентрации 133 пг/мл выраженные изменения наблюдались уже через 30 мин после начала воздействия. В культуре фибробластов происходило интенсивное разрушение коллагена, коллагеновые волокна истончались, образуя между клетками сеть коллагеновых нитей; прикрепленные фибробласты округлялись, отсоединялись от субстрата и свободно перемещались в культуральной среде. Кроме того, на участках, которые характеризовались наибольшей плотностью клеток, наблюдалось образование крупных конгломератов, состоящих из нескольких десятков клеток, соединенных коллагеновыми волокнами (рис. 1). Со временем клеточные конгломераты уплотнялись, формируя более компактные образования, которые при механическом воздействии (перемещении культурального сосуда или добавлении среды) распадались на отдельные клетки или меньшие по размеру кластеры. В контрольных образцах подобной картины не наблюдалось (рис. 2).
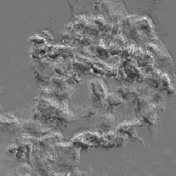
Рис. 1. Конгломераты, образованные фибробластами после воздействия bFGF. Увеличение х40
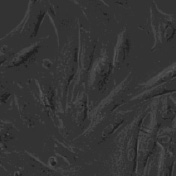
Рис. 2. Фибробласты, не подвергавшиеся воздействию bFGF. Увеличение х40
Иммунофлуоресцентные исследования
Для изучения активности окислительного фосфорилирования на третьи сутки воздействия активными веществами культивируемые клетки фиксировали и окрашивали антителами к белку Bcl-2. Ядра окрашивали Hoechst.
Bcl-2 (белок В-клеточной лимфомы) является антиапоптотическим белком, принадлежащим семейству Bcl-2, в которое входят как анти-, так и проапоптотические белки [4]. Как правило, антиапоптотические белки семейства Bcl-2 представляют собой трансмембранные белки, присутствующие в наружной мембране митохондрий, эндоплазматическом ретикулуме и ядерной мембране [5]. Они ингибируют апоптоз, связывая и изолируя проапоптотические белки с образованием гетеродимеров и таким образом предотвращая их транслокацию во внешнюю митохондриальную мембрану, ее последующую пермеабилизацию и высвобождение аптотических белков (цитохрома С, апоптоз-индуцирующего фактора (AIF), эндонуклеазы G) из межмембранного пространства в цитозоль, где они инициируют каскад каспаз, а также каспаз-независимые механизмы клеточной гибели [4]. Например, было продемонстрировано, что белок Bcl-2 предотвращает апоптоз, индуцированный такими стимулами, как недостаток сыворотки, тепловой шок и воздействие химиотерапевтических препаратов [6]. Кроме того, было показано, что Bcl-2 способен ингибировать некоторые формы некротической гибели клеток, например некроз, вызванный гипоксией и угнетением дыхания. Помимо апоптоза белки Bcl-2 семейства играют роль в регуляции биоэнергетического метаболизма, в функционировании митохондрий, в том числе в потреблении кислорода и синтезе АТФ, а также в митозе и аутофагии [6]. Также было продемонстрировано, что резистентность фибробластов сердца к апоптозу, индуцируемому стауроспорином, этопозидом, удалением сыворотки или моделируемой ишемией, зависит от высокого уровня экспрессии белка Bcl-2, тогда как в фибробластах кожи и легких этот белок не был обнаружен [7].
Влияние основного фактора роста фибробластов на уровень экспрессии Bcl-2 исследовалось в основном на опухолевых клетках. Например, было показано, что bFGF повышает уровень экспрессии Bcl-2 в клетках при B-клеточном хроническом лейкозе, при мелкоклеточном раке легких и при фокальной церебральной ишемии [8]. Культивирование эндотелиальных клеток легких пациентов с идиопатической легочной артериальной гипертензией также показало связь сверхэкспрессии основного фактора роста фибробластов с повышенным уровнем экспрессии Bcl-2 и сниженной чувствительностью клеток к фактору, индуцирующему апоптоз (удаление сыворотки) [9]. Кроме того, было описано индуцируемое bFGF повышение уровня экспрессии Bcl-2 в клетках ATDC5 (мышиной хондрогенной клеточной линии), предотвращающее апоптоз, стимулированный TNF-α [10]. В клетках рака молочной железы, напротив, было продемонстрировано снижение уровня как мРНК, так и белка Bcl-2 в результате воздействия bFGF [11]. В то же время основной фактор роста фибробластов не оказал значительного влияния на базовый уровень Bcl-2 в меланоцитах, культивируемых на коллагеновом геле, тогда как воздействие трансформирующего фактора роста (TGF-b1) привело к значительному снижению уровня Bcl-2 в клетках, что было отменено при совместном воздействии bFGF и TGF-β1 [8].
Противоречивы также опубликованные данные об изменении уровня Bcl-2 при активации фибробластов в результате воздействия факторами роста. На фибробластах легких крысы было показано, что воздействие TGF-β1 полностью подавляло индуцированный IL-1β апоптоз путем положительной регуляции экспрессии Bcl-2, а также предотвращало снижение экспрессии α-SMA и индуцировало дифференцировку клеток в миофибробласты [12]; увеличение количества Bcl-2 после воздействия TGF-β1 также было продемонстрировано на фибробластах легких человека [13]. Однако при активации фибробластов человека и мыши тромбоцитарным фактором роста (Platelet-derived growth factor, PDGF) наблюдалось сннижение количества Bcl-2, которое тем не менее не влияло на выживаемость клеток, так как ингибирование Bcl-2 не индуцировало апоптоз, в отличие от ингибирования Bcl-xL [14].
В нашем исследовании флуоресцентная окраска антиапоптотического белка Bcl-2 в контрольной группе была более интенсивной, структурированной и визуализировалась в цитоплазматической области клеток. Также в контрольных образцах наблюдалось специфическое окрашивание четко структурированных ядер овальной формы (рис. 3). В то же время клетки, подвергнутые воздействию bFGF, характеризовались более бледной и неравномерной окраской Bcl-2, занимающей весь объем клетки и частично перекрывающей окраску ядер, которые также отличались менее интенсивной флуоресцентной окраской и нечеткими контурами (рис. 4).
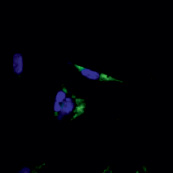
Рис. 3. Флуоресцентное окрашивание контрольной группы фибробластов: Bcl-2 (зеленый цвет), Hoechst (синий цвет). Увеличение х40
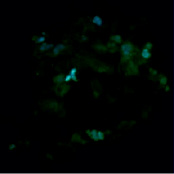
Рис. 4. Флуоресцентное окрашивание фибробластов после воздействия bFGF: Bcl-2 (зеленый цвет), Hoechst (синий цвет). Увеличение х40
Статистический анализ полученных данных также подтвердил достоверное снижение средней интенсивности флуоресценции Bcl-2 в фибробластах после воздействия фактором роста (рис. 5). В данном случае уменьшение количества антиапоптотического белка в результате воздействия bFGF может быть связано как с регуляцией апоптоза и повышением чувствительности клеток к апоптотическим факторам, так и с другими возможными функциями, выполняемыми в культивируемых клетках белком Bcl-2. В последнем случае резистентность к апоптотической гибели может зависеть от других антиапоптотических белков, как ранее было показано для активации фибробластов PDGF [14].
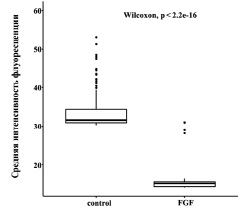
Рис. 5. Сравнение средней интенсивности флуоресцентного окрашивания Bcl-2 (критерий Уилкоксона – Манна – Уитни) в контрольной группе фибробластов и в культуре после воздействия bFGF. Представлены медианы, первые и третьи квартили. Достоверными считаются различия при р < 0,05
Заключение
Анализ полученных результатов показал, что основной фактор роста фибробластов в концентрации 133 пг/мл оказывает значительное влияние на морфологию, подвижность и, возможно, жизнеспособность культивируемых клеток, а также на структуру исследуемой культуры перитонеальных фибробластов, которая определяется способностью клеток синтезировать и реконструировать коллагеновый матрикс. Индуцированное bFGF снижение количества антиапоптотического белка Bcl-2 в культивируемых фибробластах может быть связано с повышением чувствительности клеток к апоптотическим факторам или и с другими возможными функциями, выполняемыми данным белком.
Библиографическая ссылка
Трухан И.С., Дремина Н.Н., Шурыгина И.С. ИЗУЧЕНИЕ КУЛЬТУРЫ ФИБРОБЛАСТОВ ПОД ВОЗДЕЙСТВИЕМ РОСТОВОГО ФАКТОРА // Международный журнал прикладных и фундаментальных исследований. 2019. № 12-2. С. 182-186;URL: https://applied-research.ru/ru/article/view?id=12976 (дата обращения: 19.01.2026).
DOI: https://doi.org/10.17513/mjpfi.12976

