При лечении частичного и полного отсутствия зубов ортопедические конструкции на дентальных имплантатах прочно вошли в современную стоматологию в качестве «золотого стандарта». Четкие протоколы имплантации, работы с костной тканью позволяют достигать предсказуемой интеграции имплантатов [1]. В связи с этим эстетический аспект имплантологического лечения, как и всей стоматологии, выходит на первый план.
Критерием эстетического успеха реставрации является способность максимально имитировать натуральный зуб [2], для чего необходим симбиоз оптимального позиционирования имплантата в костной ткани и состояния мягких тканей периимплантатной зоны. Правильные параметры толщины, уровня, цвета и текстуры мягких тканей предопределяют эстетический успех реставрации [2] являются гарантом долгой службы имплантата ввиду снижения риска развития периимплантита [3] и обеспечивают удовлетворенность лечением пациента и доктора.
С момента своего внедрения (более 50 лет назад) трансплантация мягких тканей все чаще используется в клинической практике для увеличения толщины десны в области зубов и имплантатов, коррекции слизисто-деcневых деформаций, улучшения эстетики и создания адекватной ширины кератинизированной десны (КД) [4; 5].
Целью нашего исследования является обзор современных подходов и аутотрансплантатов, используемых для увеличения объема мягких тканей полости рта.
Наличие адекватной ширины и толщины КД имеет важное значение для зубов, а для имплантатов может быть критическим. Кератинизированная слизистая оболочка десны и ее достаточный объем, как показала практика, защищает поверхность зубов и имплантатов от потери клинического прикрепления вследствие воспаления, защищает от механической травмы, способствует проведению более качественной индивидуальной гигиены полости рта для пациентов [6].
Несколько последних исследований показали, что увеличение объема мягких тканей с использованием свободного десневого трансплантата эффективно для уменьшения воспаления слизистой оболочки, дискомфорта пациента и обеспечения оптимального контроля над биопленкой вокруг имплантатов [7]. Более того, сообщалось, что толщина мягких тканей критически важна и может влиять на потерю краевой кости в области имплантатов [6].
Метаанализ Thoma et al. показал, что увеличение объема мягких тканей аутогенными трансплантатами является наиболее предсказуемым методом поддержания состояния здоровья периимплантатных тканей для увеличения ширины и толщины кератинизированной десны [8]. Было установлено, что наличие как минимум 2 мм кератинизированной десны обеспечивает защитными свойствами мягкие ткани, окружающие имплантаты, а имплантаты с меньшим количеством кератинизированной десны более склонны к развитию биологических осложнений [9; 10].
Методика использования свободного десневого трансплантата (СДТ), полученного из твердого неба, была впервые предложена Nabers с целью углубления преддверия полости рта [11]. Эта техника позже была модифицирована Sullivan и Atkins и применялась для закрытия рецессий десны в области зубов. В дальнейшем показания для использования СДТ расширились и стали применяться в области имплантатов как после их установки, так и для адаптации мягких тканей до реконструкции альвеолярного гребня и последующей установки имплантатов [12].
В то время как традиционные подходы при проведении мягкотканной пластики были нацелены прежде всего на увеличение кератинизиованной десны, основная цель современной пародонтологии заключается в достижении конечных эстетических результатов [4; 13]. Внедрение в практику и замена СДТ на субэпителиальные соединительнотканные трансплантаты (ССТ) представляют собой переход от традиционной хирургии слизистой оболочки десны к пластической хирургии пародонта [4]. Существует множество доказательств того, что ССТ является методом выбора и активно используется на сегодняшний день при лечении рецессии десны зубов и имплантатов [14; 15], для увеличения толщины мягких тканей [3], маскировки измененного цвета корней зубов или видимых компонентов имплантата [4], а также реконструкции межзубной десны [16].
В то время как СДТ, сохраняя свой первоначальный вид мягких тканей неба на участке реципиента, может приводить к плохой эстетической интеграции и образованию «заплаткоподобной» текстуры [4], ССТ способен увеличивать объем и качество мягких тканей, а также обеспечивать гармоничный, эстетический контур десны [4; 13].
При лечении рецессий десны в области имплантатов настоятельно рекомендовано использование ССТ независимо от изначальной ширины и толщины окружающей имплантат кератинизированной десны [17].
Для получения ССТ с неба было предложено несколько методик, такие как метод «окна», одиночного и параллельного разреза. Данные хирургические способы забора ССТ нацелены преимущественно на достижение заживления первичным натяжением, путем сохранения покрывного лоскута, который затем плотно адаптируется швами к донорскому участку после забора трансплантата. Эти методики первоначально считались золотым стандартом, поскольку, в отличие от классического способа забора СДТ, они сопровождались меньшей послеоперационной чувствительностью и считались менее травматичными [18].
Тем не менее в дальнейшем было продемонстрировано, что ССТ может быть получен путем забора СДТ и его последующей деэпителизацией, а послеоперационная чувствительность приравнивалась как после забора ССТ методом «окна», при условии, если донорская область полученного трансплантата защищена в послеоперационном периоде [19]. Также, за последнее время было опубликовано несколько утверждений в пользу снижения болевой чувствительности при заборе СДТ и улучшение заживление раны на небе, соблюдая определенные параметры, по сравнению с классическими методами получения ССТ [20].
Производить забор субэпителиального соединительнотканного трансплантата (ССТ) можно лишь в определенных участках слизистой оболочки полости рта, которые соответствуют следующим критериям: возможность обеспечения оптимального размера трансплантата, приемлемая после- операционная болезненность и отсутствие серьезных рисков для здоровья [4]. Безусловно, зонами выбора для стоматологов являются: зона твердого нёба – от клыка до второго моляра, и область бугра верхней челюсти.
Трансплантаты из различных донорских зон, как правило, имеют различную геометрическую форму: ССТ с бугра более объемные и короткие, в то время как ССТ из латеральной области твердого нёба более протяженные и тонкие [4].
Также донорские зоны имеют различия в степени дискомфорта в послеоперационном периоде для пациента, что было показано в работе группы американских ученых [21]. При стандартизированном размере забираемого ССТ (толщиной 1,5 мм, одинаковой длины и ширины) пациенты отмечали различную степень выраженности болевых ощущений в послеоперационном периоде. Боль оценивалась по субъективной шкале от 1 до 10. В среднем показатели болевых ощущений в группе пациентов с донорской зоной в области твердого нёба были существенно выше, чем у пациентов с донорской зоной в области бугра (5,9 ± 2,74 против 2,6 ± 2,16).
Клинический опыт многих исследователей [4; 5] свидетельствует о том, что в долгосрочном периоде (1 год и более) после аугментации мягких тканей альвеолярного гребня ССТ из области бугра верхней челюсти и твердого нёба могут наблюдаться существенные отличия в клиническом результате. Ткани, аугментированные трансплантатами с твердого нёба, зачастую показывают значительное уменьшение объема в первые недели, но затем остаются стабильными в долгосрочном периоде и обеспечивают надлежащий эстетический результат. В свою очередь, при использовании ССТ из области бугра зачастую отмечается хорошая стабильность полученного объема тканей в первые месяцы, а затем наблюдается тенденция к гиперпластической реакции, увеличению объема и появлению эстетически нежелательного эффекта «белой заплатки» [22].
Ключ к пониманию механизмов, ответственных за столь отличающиеся клинические результаты и разное поведение соединительнотканных трансплантатов, лежит в их различном гистоморфологическом строении.
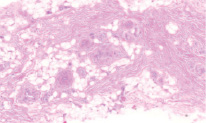
Рис. 1. Микропрепарат в окраске гематоксилин-эозином представлен участком соединительной ткани подслизистого слоя твердого нёба. Значительную площадь поверхности препарата занимают кровеносные сосуды и жировая ткань
Данные отечественной и зарубежной литературы свидетельствуют о том, что трансплантаты из области бугра имеют более плотное строение за счет большего числа коллагеновых волокон в lamina propria, чем ткань из области переднего отдела твердого нёба (72.79 % волокон для ССТ из области бугра против 51.08 % для ССТ из области твердого нёба по данным Tavelli 2019 [23], что обуславливает стабильное сохранение первоначального объема ССТ из области бугра. При рассмотрении глубжележащих слоев тканей донорских областей также наблюдаются значительные отличия: в подслизистом слое переднего отдела твердого нёба наблюдается гораздо большее количество жировой и железистой ткани, нежели в области бугра верхней челюсти (25,75 % против 4,89 % по данным Sanz-Martin, 2019 [24], что может влиять на большую усадку нёбного трансплантата, меньшее увеличение объема мягких тканей и значительно более слабую индукцию кератинизации эпителия аугментируемой области [25].
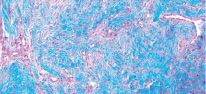
Рис. 2. Микропрепарат в окраске по Маллори представлен участком соединительной ткани lamina propria из области твердого нёба. Хорошо заметна богатая васкуляризация и рыхлая структура коллагеновых волокон
В свою очередь, соединительная ткань из области бугра менее васкуляризована, что затрудняет питание трансплантата на этапе, когда сосуды питающего ложа еще не проросли в трансплантат, и вся его трофика происходит за счет диффузии. В связи с этим ССТ из области бугра должен быть полностью перекрыт тканями реципиентного ложа, в отличие от ССТ из области переднего отдела твердого нёба, где допустимо частичное оголение трансплантата для заживления вторичным натяжением [4].
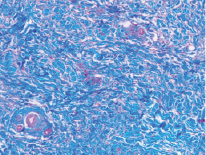
Рис. 3. Микропрепарат в окраске по Маллори представлен участком субэпителиальной соединительной ткани из области бугра верхней челюсти. Наблюдается более плотная структура соединительной ткани наряду с меньшим количеством кровеносных сосудов
По данным Dellavia C., Ricci G. 2014 [26] при использовании ССТ из области бугра для аугментации мягких тканей альвеолярного гребня в отдаленных сроках весьма часто отмечается неудовлетворительный эстетический результат в виде гиперплазии мягких тканей и изменения цвета – эффект «белой заплатки». В связи с этим для достижения удовлетворительного состояния мягких тканей приходилось прибегать к гингивопластике измененного участка, однако в течение 9 месяцев, по данным исследований, происходило возвращение 70 % объема тканей, удаленного после пластики. Гиперпластические изменения связаны с особой структурой коллагеновых волокон соединительной ткани в области бугра верхней челюсти: при созревании коллагена были обнаружены процессы, схожие с теми, что протекают в организме при фиброзных изменениях других органов и систем. Выдвигаются гипотезы о принадлежности фибробластов мягких тканей бугра и твердого нёба к различным субпопуляциям, обладающих разными показателями активности экспрессии генов, ответственных за продукцию ферментов, участвующих в метаболизме коллагена: его созревании, создании поперечных цепей и деградации. Таким образом, в мягких тканях бугра верхней челюсти деградация коллагена металло-матриксными протеиназами затруднена ввиду большего количества поперечных связей коллагеновых волокон, что клинически находит своё проявление в гиперпластической реакции.
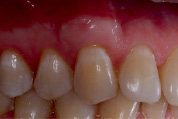
Рис. 4. Гиперпластическая реакция слизистой оболочки в области зуба 2.3 через 1 год после коронального смещения лоскута с ССТ из области бугра верхней челюсти
Заключение
Современная стоматология развивается в направлении увеличения предсказуемости результата лечения, получения высоких функциональных и эстетических показателей и снижения послеоперационного дискомфорта для пациентов, в связи с чем научно обоснованное использование соединительнотканных трансплантатов остаётся темой активного изучения.
На сегодняшний день нашей исследовательской группой проводится клинико-гистологическое исследование с целью обоснования применения соединительнотканных трансплантатов из различных зон нёба для устранения дефицита мягких тканей в области зубов и имплантатов. Продемонстрированные в статье микропрепараты используются для изучения гистоморфологической структуры ткани донорских областей твердого нёба и бугра верхней челюсти. Основной задачей исследования является выявление зависимости клинических и эстетических результатов аугментации мягких тканей от гистологического строения использованных соединительнотканных трансплантатов, изучение их регенеративного потенциала и разработка научно обоснованного протокола забора, формирования размера и применения соединительнотканных трансплантатов из различных донорских областей в различных клинических ситуациях для достижения оптимального результата лечения.
Библиографическая ссылка
Кулаков А.А., Бадалян В.А., Паринов Д.А., Мартиросова А.Ю. СОВРЕМЕННЫЕ ПОДХОДЫ УВЕЛИЧЕНИЯ ОБЪЕМА МЯГКИХ ТКАНЕЙ В ОБЛАСТИ ЗУБОВ И ИМПЛАНТАТОВ С ИСПОЛЬЗОВАНИЕМ СОЕДИНИТЕЛЬНОТКАННЫХ АУТОТРАНСПЛАНТАТОВ // Международный журнал прикладных и фундаментальных исследований. 2020. № 2. С. 69-73;URL: https://applied-research.ru/ru/article/view?id=13012 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13012

