Пищевые сальмонеллезы – широко распространенные заболевания человека, их регистрируют во всех странах, на всех континентах [1]. Болезнь имеет эпизоотологическое, эпидемиологическое, экологическое и социально-экономическое значение и представляет серьезную потенциальную угрозу для людей [2]. Актуальность проблемы сальмонеллы связана с высоким уровнем заболеваемости и сохраняющейся тенденцией к ее росту, трудностями в эпидемиологическом исследовании причин сальмонеллы, формированием устойчивости к противомикробным препаратам и отсутствием эффективной специфической профилактики. Быстрая диагностика сальмонеллы и методы типирования сальмонеллы являются наиболее важными моментами в подавлении распространения патогенных микроорганизмов [3].
По заключению Комитета экспертов ВОЗ, сальмонеллез не имеет себе равных по сложности диагностики, профилактики и лечения [4].
Пищевой сальмонеллез является широко распространенным заболеванием человека, регистрируется во всех странах, на всех континентах; сальмонеллы поражают человека и сохраняются в окружающей среде в течение длительного времени [5].
Большинство сальмонелл являются патогенными как для людей, так и для животных и птиц, но в эпидемиологическом отношении только несколько серотипов являются наиболее значимыми для людей, их доля составляет 85–91 % сальмонелл во всем мире [6].
Возбудитель Salmonella enterica живет в основном в кишечнике, но, выделяясь с калом, он загрязняет почву и объекты окружающей среды, через которые он может передаваться восприимчивым животным и людям. Однако чаще заражение сальмонеллой происходит при непосредственном контакте с источником инфекции или при употреблении пищи, зараженной Salmonella enterica. Согласно существующей классификации [7] Salmonella enterica подразделяется на 6 подвидов: enterica, salamae, arizonae, diarizonae, houtenae и indica, которые различаются по биохимической активности и обозначены номерами I, II, IIIa, IIIb, IV и VI соответственно. В подавляющем большинстве случаев сальмонеллезной инфекции от людей изолируют серовары подвида enterica [8].
Цель исследования: определение генетического полиморфизма изолятов бактерий Salmonella, выделенных из продуктов питания, доступных потребителям на местных торговых точках.
Материалы и методы исследования
Бактериальные изоляты
25 изолятов сальмонеллы, использованных в этом исследовании, были получены из пищевых продуктов (табл. 1). Отбор проб для исследования проводили по ГОСТ 31904-2012 «Продукты пищевые. Методы отбора проб для микробиологических испытаний» [9].
Таблица 1
Изоляты бактерии Salmonella, выделенные из пищевых продуктов в 2018 г.
|
№ |
Рег. номер |
Использованные продукты |
№ |
Рег. номер |
Использованные продукты |
|
1 |
8 |
Куриная печень |
14 |
67 |
Сердце индейки |
|
2 |
9 |
Яйца |
15 |
69 |
Фарш говядина/курица |
|
3 |
24 |
Фарш баранина/говядина |
16 |
70 |
Яйцо промышленной птицефабрики |
|
4 |
26 |
Голень индейки замороженная |
17 |
86 |
Мороженое |
|
5 |
27 |
Тушка цыпленка бройлера замороженная |
18 |
90 |
Баранина |
|
6 |
31 |
Желудок цыпленка |
19 |
70/1 |
Яйцо промышленной птицефабрики |
|
7 |
34 |
Яйца якорские |
20 |
96 |
Рыба лещ |
|
8 |
37 |
Яйца домашние |
21 |
120 |
Сало свиное |
|
9 |
39 |
Фарш куриный |
22 |
121 |
Говядина |
|
10 |
40 |
Голень куриная |
23 |
124 |
Сосиски детские |
|
11 |
46 |
Капуста цветная/салат |
24 |
125 |
Сосиски говяжьи |
|
12 |
53 |
Творог домашний |
25 |
126 |
Брынза |
|
13 |
63 |
Фарш куриный |
В процессе работы применяли культуральные методы с использованием специальных селективных и дифференциально-диагностических сред. Культуральные, морфологические, и биохимические свойства выделенных микроорганизмов изучали общепринятыми методами и в соответствии с ГОСТ Р 52814-2007 (ИСО 6579:2002) «Продукты пищевые. Метод выявления бактерий рода Salmonella» [10] и ГОСТ Р 50455-92 «Мясо и мясные продукты. Обнаружение сальмонелл (арбитражный метод)» [11].
Выделение ДНК. Выделение ДНК из бактерий Salmonella проводили тризольным методом с использованием коммерческого реагента TRizol («Invitrogen», США) в соответствии с инструкцией производителя.
Олигонуклеотидные праймеры для выявления бактерии Salmonella
Определение вида и типа бактерии Salmonella осуществляли с помощью ПЦР анализа, используя специфические праймеры (табл. 2).
Таблица 2
Праймеры, используемые для выявления вида и типа бактерии Salmonella
|
№ |
Название праймера |
Олигонуклеотиды |
Размер ПЦР продукта, п.о. |
Вид и тип бактерии Salmonella |
|
1 |
SInv-1F |
GTGAAATTATCGCCACGTTCGG |
500 |
Salmonella enterica |
|
SInv-1R |
ATCGCCATTTACGCGGGTCA |
|||
|
2 |
SE Prot6e-1F |
TAACCGGAGAGGCGCTCATC |
300 |
Salmonella enterica Enteritidis |
|
SE Prot6e-1R |
AACCATGCTCAGCTGCTCCA |
|||
|
3 |
ST mdh-1F |
TGCCGCTGCTGTCGCAGATT |
200 |
Salmonella enterica Typhimurium |
|
ST mdh-1R |
CACCACGCCCTTCTCGCCCT |
|||
|
4 |
SVCRISPR-1F |
AGCCGCAGGATGTGCTGGAA |
400 |
Salmonella enterica Virchow |
|
SVCRISPR-1R |
GATAAACCGCCGCGCCTTAT |
|||
|
5 |
hgbAa (RAPD ПЦР) |
GCG GGA ATG CTG AAG ATA AG |
– |
Salmonella enterica |
Постановка ПЦР для идентификации сальмонелл. Получение ПЦР-фрагмента гена Inv бактерии Salmonella enterica проводили с использованием праймеров: S Inv-1F и S Inv-1R (размер ПЦР продукта 500 п.о.). Следующие праймеры использованы для типизации: для типа Еnteritidis бактерии Salmonella enterica – SE Prot6e-1F и SE Prot6e-1R (размер ПЦР продукта 300 п.о.); для типа Typhimurium бактерии Salmonella enterica – ST mdh-1F и ST mdh-1R (размер ПЦР продукта 200 п.о.); для типа Virchow бактерии Salmonella enterica – SV CRISPR-1F и SV CRISPR-1R (размер ПЦР продукта 400 п.о.).
Амплификацию проводили в 25 мкл реакционной смеси следующего состава: 10xбуфер ДНК полимеразы – 2,5 мкл, 10 mM dNTP – 1 мкл., MgCl2 – 1 мкл, 20-50 нг ДНК-матрицы, по 20 пмоль прямого и обратного праймеров и 0,5 ед. TaqДНК полимеразы (Invitrogen). Анализ продуктов ПЦР проводили при помощи электрофореза в 1,5 %-ном агарозном геле, содержащем бромистый этидий (1 мкг/мл), при напряженности поля 6 В/см2.
Постановка RAPD (Random Amplification of Polymorphic DNA) ПЦР
Для постановки RAPD ПЦР используют праймер: hgbAa –GCG GGA ATG CTG AAG ATA AG. Реакционный состав:10х буфер – 2,5 мкл; dNTPs – 1 мкл; MgCl2 – 1 мкл; праймер – 2 мкл; 0,5 ед.TaqДНК полимеразы – 0,5 мкл; ДНК – 5 мкл; вода – до 25 мкл. Температурный режим амплификации: 94 °С – 5 мин; 40 циклов 94 °С – 45 сек, 35 °С – 5 сек, 72 °С – 1,20 мин; 72 °С – 10 мин.
Результаты исследования и их обсуждение
Осуществлено исследование 25 образцов пищевых продуктов на содержание в них бактерий Salmonella. Проведен ПЦР анализ с использованием видоспецифичных праймеров SInv-1F и SInv-1R для определения вида enterica бактерии Salmonella. Для типирования бактерии Salmonella вида enterica с помощью ПЦР-анализа использованы олигонуклеотидные праймеры: 1) для типа Еnteritidis бактерии Salmonella enterica – SE Prot6e-1F и SE Prot6e-1R; 2) для типа Typhimurium бактерии Salmonella enterica – ST mdh-1F и ST mdh-1R; 3) для типа Virchow бактерии Salmonella enterica – SV CRISPR-1F и SV CRISPR-1R.
При типировании исследованных ДНК 25 изолятов, выделенных из цепи пищевых продуктов, было выявлено: 14 изолятов (56 %) бактерии Salmonella enterica Typhimurium, 8 изолятов бактерии Salmonella enterica Еnteritidis (32 %), 3 изолята бактерии Salmonella enterica Virchow (12 %).
С наибольшей частотой сальмонеллы обнаруживаются в мясе птицы – 36 %, рыбе – 4 %, яйцах – 20 %, молочной продукции – 12 %, растительных салатах – 4 %. В сыром мясе и колбасных изделиях сальмонеллы присутствовали в 24 % проб.
Генетический полиморфизм изолятов бактерии Salmonella enterica, полученных из цепи пищевых продуктов
Для выявления генетического разнообразия изолятов Salmonella enterica Еnteritidis, Salmonella enterica Typhimurium и Salmonella enterica Virchow проведен ПЦР анализ с использованием RАPD-праймера.
Результаты выявления генетического разнообразия исследуемых изолятов Salmonella enterica Еnteritidis, Salmonella enterica Typhimurium и Salmonella enterica Virchow, полученных из цепи пищевых продуктов, представлены в табл. 3 и на рисунке.
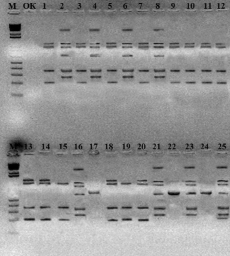
Электрофореграмма разделения ПЦР продуктов изолятов Salmonella enterica, полученных из цепи пищевых продуктов с использованием RАPD-праймера
Таблица 3
Характеристики изолятов бактерии Salmonella, выявленных из цепи производства пищевых продуктов методами ПЦР и RAPD ПЦР
|
№ |
Рег. номер штамма |
Использованные продукты |
Вид бактерии Salmonella |
Тип Salmonella enterica |
Размеры ампликонов в RAPD ПЦР, п.о. |
|
1 |
8 |
Куриная печень |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
2 |
9 |
Яйца |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
3 |
24 |
Фарш баранина |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
4 |
26 |
Голень индейки |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
5 |
27 |
Тушка цыпленка бройлера |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
6 |
31 |
Желудок цыпленка |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
7 |
34 |
Яйца якорские |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
8 |
37 |
Яйца домашние |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
9 |
39 |
Фарш куриный |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
10 |
40 |
Голень куриная |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
11 |
46 |
Капуста цветная |
Salmonella enterica |
Typhimurium |
250, 350, 1000 |
|
12 |
53 |
Творог домашний |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
13 |
63 |
Фарш куриный |
Salmonella enterica |
Typhimurium |
250, 350, 1000 |
|
Окончание табл. 3 |
|||||
|
№ |
Рег. номер штамма |
Использованные продукты |
Вид бактерии Salmonella |
Тип Salmonella enterica |
Размеры ампликонов в RAPD ПЦР, п.о. |
|
14 |
67 |
Сердце индейки |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
15 |
69 |
Фарш курица |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
16 |
70 |
Яйцо птицефабрики |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
17 |
86 |
Мороженое |
Salmonella enterica |
Virchow |
200, 650, 1200 |
|
18 |
90 |
Баранина |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
19 |
70/1 |
Яйцо птицефабрики |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
20 |
96 |
Рыба лещ |
Salmonella enterica |
Typhimurium |
250, 350, 1000, 1250 |
|
21 |
120 |
Сало свиное |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
22 |
121 |
Говядина |
Salmonella enterica |
Virchow |
200, 650, 1200 |
|
23 |
124 |
Сосиски детские |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
|
24 |
125 |
Сосиски говяжьи |
Salmonella enterica |
Virchow |
200, 650, 1200 |
|
25 |
126 |
Брынза |
Salmonella enterica |
Еnteritidis |
250, 350, 650, 1000, 1250, 3000 |
При помощи данного RAPD-праймера был получен одинаковый специфический набор ДНК-фрагментов бактерии Salmonella enterica Еnteritidis, не отличающих их друг от друга. Показано, что для этих изолятов было выявлено по 6 ампликонов длиной 250, 350, 650, 1000, 1250, 3000 п.о., что говорит об их генетическом родстве.
При генотипировании изолятов Salmonella enterica Typhimurium под номерами 1,3, 5, 7, 9, 10, 11, 12, 13, 14, 15, 18, 19 и 20 (1-я группа) было выявлено 4 ампликона (200, 350, 1000, 1250 п.н.), а для изолятов Salmonella enterica Typhimurium под номерами 15 и 19 (2-я группа) были получены по 3 ампликона (200, 350, 1000 п.н.). В результате амплификации геномной ДНК изолятов RAPD-праймером был получен специфический набор ДНК-фрагментов, отличающих их друг от друга. Изоляты 1-й группы генетически отличаются от изолятов 2-й группы бактерии Salmonella enterica Typhimurium.
В изолятах Salmonella enterica Virchow были выявлены по 3 ампликона длиной 200, 650, 1200 п.о. Эти данные являются показателями их генетического родства.
Существуют генетические различия между штаммами возбудителей различных заболеваний. При накоплении достаточного количества мутаций в штаммах методы генотипирования начинают различать изоляты. В некоторых случаях изоляты не отличаются распределением фрагментов ДНК, что указывает на генетическую близость этих изолятов. В таких случаях они являются генетически идентичными или отличаются друг от друга на уровне только одного или нескольких генов, полиморфизм которых ускользает от скрининга [12].
Обнаружение различных типов изолятов Salmonella enterica, циркулирующих на территории Республики Казахстан, указывает на необходимость проведения более углубленных генетических исследований.
Выводы
При типировании изолятов Salmonella enterica, полученных из цепи пищевых продуктов, выявлено 14 изолятов (56 %) бактерии Salmonella enterica Typhimurium, 8 изолятов бактерии Salmonella enterica Еnteritidis (32 %), 3 изолята бактерии Salmonella enterica Virchow (12 %).
Проведен молекулярный анализ с использованием RАPD ПЦР для выявления генетического разнообразия изолятов бактерий Salmonella enterica, полученных из цепи пищевых продуктов. В RАPD ПЦР 8 изолятов Salmonella enterica Еnteritidis показали генетическое родство с одинаковым количество ампликонов (50, 350, 650, 1000, 1250, 3000 п.о.). Близкое генетическое родство выявлено у 3 изолятов Salmonella enterica Virchow (200, 650, 1200 п.о.) В изолятах Salmonella enterica Typhimurium, выделенных из цепи пищевых продуктов, обнаружены две генетически отличающиеся группы с разным набором ДНК-фрагментов.
Библиографическая ссылка
Бармак С.М., Синявский Ю.А., Бердыгалиев А.Б., Шарманов Т.Ш., Менденхалл И.Х., Жолдыбаева Е.В. ГЕНЕТИЧЕСКИЙ ПОЛИМОРФИЗМ ИЗОЛЯТОВ БАКТЕРИЙ SALMONELLA, ВЫДЕЛЕННЫХ ИЗ ПРОДУКТОВ ПИТАНИЯ // Международный журнал прикладных и фундаментальных исследований. 2020. № 6. С. 7-11;URL: https://applied-research.ru/ru/article/view?id=13080 (дата обращения: 07.03.2026).

