Основным диагностическим критерием диабета с уровнем HbA1c [1] является концентрация глюкозы в крови, самоконтроль которого признан ценным инструментом для лечения этого заболевания [2–4], осуществляемый рядом приборов, причем значительный вклад внесли и вносят ферментативные электрохимические биосенсоры [5–7]. Они обладают хорошей селективностью и чувствительностью [5], основаны на использовании ферментов глюкозо-дегидрогеназы (GDH) или глюкозооксидазы (GOx) и широко используются в повседневной жизни для обнаружения глюкозы, коммерчески успешны в качестве глюкометров. Однако применение биологического материала, такого как ферменты, антитела и т.д., в ферментных датчиках ограничивается недостатками при их изготовлении [8], сроком службы, вследствие уменьшения [9] и потери биологической активности фермента [10] со временем. Обычно используемый фермент глюкозооксидаза (GOD) имеет низкую стабильность, требует сложных процессов иммобилизации на поверхность сенсора [11], химическую и термическую нестабильность [12, 13], что сужает область применения биосенсоров глюкозы на ее основе.
Альтернативой ферментативным биосенсорам служат сенсоры без ферментов, непосредственно обнаруживающие глюкозу посредством ее окисления, для которых важно разработать подходящие эффективные катализаторы для обнаружения глюкозы в биологических образцах в физиологические условия, без какой-либо предварительной / последующей обработки [14, 15]. Основными преимуществами биосенсоров без ферментов являются их низкая стоимость, высокая стабильность, быстрый отклик и низкий предел обнаружения [16, 17]. Устройства непосредственно обнаруживают глюкозу [14, 17–19] и основаны на реакции ее окисления, катализируемой различными электрокатализаторами (рисунок), где атомы на поверхности материала действуют как электрокатализаторы, и в этом отношении большая роль отводится наноматериалам, таким как наночастицы Au, Ag, Ni, Cu, Co и т.д. [14], оксиды металлов (NiO, CuO, Co2O3 и др.) [17], сульфиды металлов [14, 17, 21] и др. В обзоре [17] обобщены достижения в разработках сенсоров глюкозы на основе оксидов металлов (ZnO, CuO / Cu2O, NiO, Co3O4, MnO2 и т.д.) и их нанокомпозитов. А в недавно опубликованных обзорах представлены и обсуждены последние разработки неферментативных электрохимических и оптических датчиков глюкозы, носимых и коммерчески доступных устройств, способных обнаруживать глюкозу в физиологических условиях pH [22], а также стратегии разработки биосенсоров на основе металлических наночастиц [23].
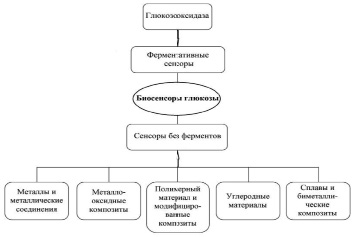
Типы ферментативных и неферментативных электрохимически активных материалов в сенсорах глюкозы. Заимствовано из [20] с изменениями
В этом кратком обзоре приведены некоторые работы за 2020 г. по разработкам неферментативных биосенсоров глюкозы на основе Cu, оксидов меди и их сплавов. Среди используемых материалов на основе оксидов металлов CuO считается одним из лучших материалов, что связывают с его природным изобилием, низкой стоимостью производства, высокой стабильностью и соответствующим окислительно-восстановительным потенциалом. Уравнения (1) и (2) описывают доминантные реакции, происходящие в сенсорах на основе CuO, чтобы обеспечить электроокисление глюкозы [24].
CuO + OH− → CuOOH + e−CuO + OH− → CuOOH + e− (1)
CuOOH + e− + glucose → CuO + OH− + glucoseacidCuOOH + e− + glucose → CuO + OH− + glucoseacid (2)
Примеры разработок и характеристики биосенсоров глюкозы без ферментов на основе наноматериалов Cu, сплавов/композитов
Материал датчика, на поверхности которого происходит окисление глюкозы, является важнейшим элементом неферментативных биосенсоров. Чаще всего используют такие материалы, как медь (Cu), никель (Ni), наночастицы меди (CuNPs), никеля (NiNPs), золота (AuNPs), платины (PtNPs) и серебра (AgNP), а также нанокомпозиты. Медь и ее оксиды широко используются в качестве неферментных датчиков глюкозы из-за дешевизны, хорошей чувствительности и токового отклика в щелочных средах, а также из-за практичных и простых способов приготовления наноматериалов на их основе [25, 26]. Кроме того, они обладают высокой электрокаталитической активностью, экономичностью, нетоксичностью и стабильностью [27, 28]. А объединение меди с графеном может значительно повысить чувствительность неферментных глюкозных сенсоров, что, вероятно, связано с синергетическим эффектом между двумя компонентами, приводящим к увеличению электрокаталитической активной области и увеличению переноса электронов для окисления глюкозы [29]. На их основе разработан оригинальный гибкий датчик [30] на основе наночастиц Cu, закрепленных на лазерно-индуцированном графеновом композите (Cu NPs-LIG) с чувствительностью к глюкозе 495 мкА мM-1 см-2 (таблица). Как считают авторы разработки, датчик является привлекательным для носимых и имплантируемых неферментативных устройств для диагностики глюкозы следующего поколения.
Аналитические характеристики датчиков глюкозы на основе наночастиц Cu, оксидов меди, сплавов/композитов (примеры разработок по публикациям в 2020 г.)
|
Тип датчика |
Чувствительность, µA×mM-1×cm-2 |
Предел обнаружения (LOD), µM |
Линейный диапазон обнаружения |
Литература |
|
Датчик на основе наночастиц Cu, на лазерно-индуцированном графене, (Cu NPs-LIG) |
495 |
0,39 |
1 μM – 6.0 mM |
[30] |
|
Датчик глюкозы на основе ядро-оболочка Cu-CuO на полианилине, на электроде из нержавеющей стали 316L (Cu-CuO / PANI / 316L) |
25710 |
0,1 mM |
0,1–5 mM |
[31] |
|
Датчик на основе нанокомпозита (Cu2O / Cu /) на углеродной ткани |
6952 |
60 нМ |
1–1555 µM |
[32] |
|
Датчик на основе композитного катализатора Cu-Ni/CuO-NiO, синтезированный методом плазменной обработки раствора |
2637, 282 и 923, 084 |
54 нМ |
0–0, 35 мМ и 0,35–9,85 мМ |
[33] |
|
Датчик на основе пористой наноструктурированной Cu |
1862 |
0,048 |
10 µM – 2 mM и 2–8mM |
[34] |
|
Датчик на основе биметаллической наноструктуры Co/Cu |
1741 и 626 |
0,4 |
5 µM – 1 mM и 2–9 mM |
[35] |
|
Сенсор на основе нанопленок Cu-Ni |
1380 |
7,3 |
0,04–5,76 mM |
[36] |
|
Электрод с трафаретной печатью (SPCE) на основе нанокубиков оксида меди (Cu2O-NC). (Cu2O-NC-SPCE) |
1040 |
3,1 |
0,007–4,5 mM |
[37] |
|
Сенсор на основе CuCo2O4 |
400,0 |
2,5 µM – 7,9 mM |
[38] |
|
|
Датчик на основе углеродных нанодот и нанокомпозитов на основе оксида меди |
110 и 63,3 |
0,5–2 mM и 2–5 mM |
[39] |
|
|
Датчик на основе сферической наноструктуры Cu, модифицированные SiO2, (Cu/CuO/SiO2) |
8 |
1,45 mM |
3–12 mM |
[40] |
|
Нанопластины палладия (PdNS) на нанокомпозитах Cu/Cu2O с использованием подложек из оксида олова (FTO), легированных фтором. (PdNS-Cu / Cu2O / FTO) |
Электрокаталитический ток = 3,70 мА |
0,1 |
0,5–2600 µM |
[41] |
|
Графитовый карандашный электрод, модифицированный наночастицами Cu, (CuNP / GPE) |
0,830 |
0,04 |
0,10–400 µM |
[42] |
|
Cu-Cu2O NPS @ 3DG пористая структура, состоящая из трехмерного графена (3DG), на основе наночастиц (Cu или Cu-Cu2O) |
230,86 |
16 мкМ |
0,8–10 мМ |
[43] |
|
Электрод из модифицированного графеном нанокомпозита Cu2O |
371 и 400 |
5,5 и 2 мкМ |
2мкМ–12 мМ |
[44] |
В таблице приведены характеристики датчиков глюкозы для биосенсоров без ферментов, разработанные в 2020 г. на основе наночастиц Cu, оксидов меди, сплавов/ композитов.
Использование наночастиц Cu ограничено присущей ему склонностью к окислению в атмосферных условиях, что стимулировало исследования по разработке наночастиц на основе Cu с более сложными структурами, таких как ядро-оболочка Cu NPS или системы на основе оксидов меди. Так, датчик глюкозы на основе структуры ядро-оболочка Cu-CuO на подложке полианилина (PANI) (Cu-CuO / PANI / 316L) [31], приготовленной на электроде из нержавеющей стали 316L, показал очень высокую чувствительность (25,71 мА·мМ− 1·см2). Однако надо учесть, что электрод был использован для обнаружения глюкозы в щелочной среде (0,1 М NaOH). Тем не менее результаты показали, что структура ядро-оболочка Cu-CuO на полианилиновой подложке потенциально может быть применена в качестве материала электрода для неферментативного датчика глюкозы. Высокая чувствительность датчика на основе нанокомпозита (Cu2O / Cu /) на углеродной ткани (6952 µA×mM-1×cm-2) и сверхнизкий предел обнаружения глюкозы, как считают авторы [32], обусловлены синергетическим эффектом высокопроводящей углеродной ткани с несколькими каналами и более активными центрами в сочетании с каталитической активностью Cu2O/Cu.
Результаты электрохимических испытаний композитного катализатора Cu-Ni/CuO-NiO [33], синтезированного методом плазменной обработки раствора, показали высокую производительность для электрохимического датчика глюкозы с временем реакции ~1 с и очень низким пределом обнаружения (54 нМ). Считают, что метод имеет хорошую перспективу применения в области бесферментного обнаружения глюкозы.
В работе [34] был предложен метод изготовления пористых наноструктурированных электродов Cu для неферментативного определения глюкозы. Чтобы оптимизировать чувствительность электрода, были исследованы эффекты угла осаждения из паровой фазы и скорости вращения азимутальной подложки. Под контролем параметров осаждения GLAD были достигнуты высокая чувствительность 1862 мкАм2мМ, с низким пределом обнаружения 0,048 мкМ и двумя широкими линейными диапазонами обнаружения 10 мкМ-2 мМ и 2-8 мМ при потенциале 0,5 В. Учитывая высокую селективность, хорошую воспроизводимость и точное измерение уровней глюкозы в сыворотках человека, датчик, как предполагают авторы, имеет потенциал для крупномасштабного производства в качестве неферментативного глюкометра.
Коллективом авторов работы [35] представлена разработка биметаллической наноструктуры Co/Cu, имеющей повышенную электрокаталитическую активность по сравнению с реакциями для монометаллических структур Co или Cu, который был успешно применен для определения глюкозы в реальных образцах сыворотки крови человека. Биметаллические наночастицы с архитектурой ядро-оболочка могут обеспечить хорошую стабильность и превосходные электронные свойства по сравнению с другими типами наноструктур. Металлическая оболочка защищает основной металл от отравления и коррозии в среде брожения, в то время как деформационные и лигандные эффекты основного металла придают металлу оболочки свойства, благоприятные для электрокатализа.
А датчик глюкозы, разработанный на основе модифицированной нанокомпозитной пленки CuxO-NiO [36], показывал высокую избирательность против некоторых мешающих видов и стабильность. Приготовленный сенсор был успешно применен для мониторинга уровня глюкозы в сыворотке крови человека и в образцах мочи. Результаты тестирования электродов Cu2O-NC-SPCE [37] показали удовлетворительную стабильность в отношении чувствительности к глюкозе и селективность по отношению к другим сахарам и этанолу, предполагая, что модификация SPCE с Cu2O-NC может быть простым способом изготовления недорогих и надежных сенсоров для мониторинга глюкозы в процессах биоферментации.
CuxCo3-xO4 (x = 0,5; 1; 1,5; 2) успешно синтезируется с помощью гидротермальных процессов и процессов прокаливания. Серия электрохимических тестов показывала, что все они проявляют электрокаталитическую активность по отношению к глюкозе и H2O2. Среди них CuCo2O4 (x = 1) имеет уникальную полую структуру с двойной оболочкой и демонстрирует более высокие каталитические характеристики. Электрохимический сенсор на основе CuCo2O4 [38] характеризовался линейным диапазоном от 2,5 мкМ до 7,9 мМ с чувствительностью 400,0 мкА мМ·см² для обнаружения глюкозы. Для H2O2 линейный диапазон составлял от 10,0 мкМ до 8,9 мМ с чувствительностью 94,1 мкА мМ-¹с-². Датчик также демонстрировал короткое время отклика (< 3 с), хорошую селективность, воспроизводимость и стабильность в течение 18 дней.
Хорошие аналитические характеристики показали датчики глюкозы на основе углеродных нанодот и нанокомпозитов на основе оксида меди [39], сферические наноструктуры Cu / CuO / SiO2 на основе металлической меди [40] на нанокомпозитах Cu / Cu2O [41] с использованием подложек из оксида олова (FTO), легированных фтором. Содержание глюкозы в образце сыворотки с использованием электрода PdNS-Cu/ Cu2O/FTO хорошо согласовывалось с результатами традиционного коммерческого метода. Благодаря синергетическому эффекту нанопластов PdNS и Cu/Cu2O была получена высокая электрокаталитическая эффективность.
Из датчиков глюкозы, приведенных в таблице, наименьшая чувствительность у графитового электрода (GPE), модифицированного наночастицами Cu (CuNPs) [42], который был успешно протестирован на реальных образцах. Электрод (CuNPs / GPE) проявлял высокую электрокаталитическую активность и электрохимический отклик на окисление глюкозы, поскольку скорость переноса электронов глюкозой была значительно увеличена модификацией GPE наночастицами Cu (CuNPs).
Разработке трехмерной графеновой пены (3DG) с взаимосвязанной пористостью посвящена работа [43] (таблица), пористая структура, состоящая из трехмерного графена (3DG), декорированная наночастицами (Cu или Cu-Cu2O), была синтезирована для разработки бесферментного электрохимического сенсора глюкозы. Для электрода Cu-Cu2O NPS @ 3DG была получена чувствительность 230,86 мкАм-1 см-2 в линейном диапазоне 0,8–10 мМ (R2 = 0,9951) и предел обнаружения 16 мкМ. Результаты подтвердили, что электрод можно применять в качестве возможного и недорогого неферментативного электрохимического датчика глюкозы.
Модифицированный графеном нанокомпозит Cu2O был синтезирован [44] (таблица) при легком микроволновом облучении водного раствора и исследован в качестве бесферментного биосенсора глюкозы. Морфологию и кристаллическую структуру нанокомпозита Cu2O, модифицированного графеном, исследовали с помощью электронной микроскопии и рентгеноструктурного анализа. Изготовленный модифицированный графеном биосенсор проявлял широкий линейный отклик на обнаружение глюкозы в диапазонах концентраций от 2 мкМ до 12 мМ с пределом обнаружения 2 мкМ. Чувствительность к глюкозе Cu2O и модифицированные графеном электроды Cu2O были рассчитаны как 371 мкАм-1см-2 и 400 мкАм-1см-2. Кроме того, модифицированный графеном нанокомпозит Cu2O обеспечивал соответствующий селективный ответ для определения глюкозы в присутствии высоких концентраций аскорбиновой кислоты и дофамина. Делается вывод, что модифицированный графеном нанокомпозит Cu2O может быть применен в качестве перспективного электродного материала для определения концентрации глюкозы в клинике.
Сенсорные характеристики неферментативных датчиков глюкозы в значительной степени зависят от морфологии, микроструктуры и состава наноматериалов. Мультиметаллический сплав или мультиметаллические соединения значительно повышают интегрированные электрохимические характеристики. Все больше внимания уделяется проектированию и изготовлению бинарных металлических или биметаллических оксидных композитов, например таких как Ni-Cu [44], благодаря их разнообразию в получении биметаллических композиций и гибкости в формировании сложных трехмерных (3D) структур, приводящих к увеличению электрохимической активности для определения глюкозы. Неферментативные электрокаталитические электроды, использующие биметаллические системы, появились в виде сплавов [45] или металлических адатомов [46, 47]. В последние несколько лет наблюдается огромный рост интереса к применению биметаллических наночастиц, сочетающих Cu, Ni или Co с благородными металлами в катализе [48].
Не менее чувствительным оказался электрод с трафаретной печатью (SPCE) на основе нанокубиков оксида меди (Cu2O-NC). (Cu2O-NC-SPCE) [49]. Результаты испытаний показали, что модификация SPCE с Cu2O-NC может быть простым способом изготовления недорогих и надежных датчиков для мониторинга глюкозы в процессах биоферментации. Кроме того, углеродный электрод с трафаретной печатью (SPCE) удобно использовать для обнаружения глюкозы благодаря гибкой конструкции и возможности для модификации.
Композит CuCo2O4, на основе которого был создан электрохимический сенсор [50] для определения глюкозы с чувствительностью 400,0 мкА мМ-1 см-2, измерял еще H2O2, показывая в линейном диапазоне от 10,0 мкМ до 8,9 мМ чувствительность 94,1 мкА мМ-1см-2. Он имеет уникальную двухслойную полую структуру, демонстрируя высокие каталитические характеристики.
Один из способов создания усовершенствованных наноматериалов на основе Cu для катализа состоит в закреплении наночастиц Cu, CuO или Cu2O на подложках, таких как оксиды железа, SiO2, материалы на основе углерода или полимеры. Для улучшения чувствительности исследователи сосредоточились на использовании углеродных наноструктур, таких как углеродные нанотрубки, графен или оксид графена, в качестве вспомогательных материалов с целью модификации рабочих электродов. Углеродные нанодоты (C-точки) представляют собой недавно появившийся класс углеродных материалов, которые состоят из углеродных наночастиц диаметром менее 10 нм и нескольких гидрофильных поверхностных групп, демонстрирующих превосходную диспергируемость в воде, высокую площадь поверхности и химическую стабильность [51, 52]. По сравнению с другими материалами, точки CuO-C обеспечивают основные преимущества улучшения чувствительности благодаря синергетическому эффекту нанокомпозита, увеличению площади поверхности электрода и предотвращению агломерации наночастиц CuO из C-точек.
В исследованиях [53] синтезированы два типа электродов с нанопроволоками CuxO или CuxO/Ag2O (x = 1, 2), выращенными на нанопористой подложке, путем нанесения на них металлических стекол Cu50-xZr50Agx (x = 0 и 7,5 ат. %) с последующим анодированием и прокаливанием. По сравнению с кластероподобной нанопроволокой из монометаллического оксида меди на нанопористой меди (CuxO @ NPC, x = 1, 2), выращенная нанопроволока из медного и серебряного биметаллического оксида на нанопористой меди Cu-Ag (CuxO / Ag2O @ NP-CuAg), обладала лучшими характеристиками электроокисления для глюкозы. Разработанный электрод CuxO / Ag2O @ NP-CuAg обладал чувствительностью 1,31 мА мМ-1 см-2 и широким линейным диапазоном до 15 мМ, с исключительной помехоустойчивостью и стабильностью.
Использование Cu в форме наноструктур явилось хорошим решением для увеличения каталитической активности, причем комбинация с другими металлами обеспечивала новые и лучшие катализаторы для химических превращений. Но, несмотря на достигнутые успехи в области синтеза наночастиц на основе Cu, необходимо решать еще проблему ограниченной стабильности наночастиц Cu и их тенденцию испытывать выщелачивание. Кроме того, медь склонна к коррозии в процессе непрерывной реакции, что приводит к низкой стабильности сенсоров на ее основе.
Заключение
Подводя итог, следует отметить, что большинство наноструктурированных датчиков не способны катализировать окисление глюкозы в физиологических условиях рН и не могут быть использованы непосредственно в биологических жидкостях. Они эффективно работают в щелочной среде [54]. Кроме того, большинство из предложенных датчиков были проверены в буферах, которые только имитируют биологическую среду. Разработка таких датчиков для клинических применений с биологическими средами гораздо сложнее. Тем не менее успехи в синтезе новых материалов позволят в будущем значительно продвинуться в разработках биосенсоров глюкозы без ферментов. Наиболее важным выводом в области исследований неферментативных электрохимических датчиков глюкозы является то, что сильно электроактивная площадь поверхности играет важную роль в электроокислении глюкозы.
Библиографическая ссылка
Махмутов Б.Б., Ким Ю.А. БИОСЕНСОРЫ ГЛЮКОЗЫ, ОСНОВАННЫЕ НА РЕАКЦИИ ЕЕ ОКИСЛЕНИЯ НАНОЧАСТИЦАМИ CU, ОКСИДОВ МЕДИ, ИХ СПЛАВОВ/КОМПОЗИТОВ: КРАТКИЙ ОБЗОР // Международный журнал прикладных и фундаментальных исследований. 2021. № 4. С. 17-24;URL: https://applied-research.ru/ru/article/view?id=13198 (дата обращения: 11.02.2026).

