В настоящее время широкое распространение лекарственно-устойчивого туберкулеза приняло опасные тенденции. Это вызвало необходимость поиска фармакологических средств, основанных на действии на жизненно важные участки метаболизма микобактерий [1, 2]. Антибиотики и химиотерапевтические средства вызывают слишком быструю адаптацию микобактерий и в настоящее время акценты исследований перемещаются в область биологически активных дериватов природных антибактериальных средств растительного и животного происхождения. Широко известна целебная сила верблюжьего молока для больных туберкулезом. В последние десятилетия доказано антитуберкулезное действие лактоферрина верблюжьего молока [3]. Но в мировой литературе нет сведений о способах выделения биоактивных пептидов из молока верблюдов. Лактоферрин верблюдиц (СLF) является мощным антимикробным железосвязывающим гликопротеином, обнаруживаемым в молозиве [4] и других экзокринных выделениях млекопитающих [5, 6]. Структурно СLF представляет собой мономер 80 кДа, который содержит две равные моноферрические доли – N-лепесток и C-лепесток [7]. Обе доли связаны друг с другом короткой 3D-спиралью. Каждый лепесток содержит два равных домена, названных N1 и N2 в N-лепестке и C1 и C2 в C-лепестке [8].
Известно, что CLF проявляют широкий спектр антимикробной активности против разнообразных бактерий, вирусов и грибов in vitro [6]. Наблюдалось, что СLF оказывает свое антимикробное действие посредством секвестрации железа в качестве нативной молекулы. Тем не менее поскольку LF подвергается воздействию различных протеаз в кишечнике и впоследствии расщепляется на различные функциональные фрагменты, было бы целесообразно изучить антимикробный эффект, а также свойства высвобождения железа этими гидролизованными молекулами.
Антимикробные пептиды лактоферрина предотвращают микробное заражение и уничтожают бактериальный агент и управляют врождённой иммунной модуляцией [9, 10]. Прямое антимикробное уничтожение достигается разрушением бактериальных клеточных мембран, или транслокации в бактерии, чтобы влиять на внутренние цели. Катионные амфифильные пептиды связываются с отрицательно заряженными фосфолипидами бактериальных клеточных мембран [6]. Предполагается, что формирование поры приводит к разрушению мембраны. Недавно получены доказательства, что молекулы пептидов лактоферрина действуют на поверхности клеток и вызывают прямое уничтожение бактерий. Известно, что лактоферрины различных видов (корова, коза, верблюдица) отличаются по своей активности в отношении различных бактериальных агентов. Однако наиболее активно изучаются пептиды лактоферрина коровьего молока. Исследованию лактоферрина молока верблюдицы уделяется мало внимания. Однако в Астраханской области это широко распространённый и доступный продукт, который может послужить доступным, дешёвым сырьём для производства нового класса антибактериальных препаратов.
Цель исследования – разработка современного эффективного способа выделения лактоферрина верблюда (CLF) на основе исследования его физико-химических свойств.
Материалы и методы исследования
Объектом нашего исследования на данном этапе было молоко верблюдиц с оптимальной концентрацией лактоферрина (7–28 дни лактации). В работе использовано 93 образца молока верблюдиц, которые получали с верблюдоводческих ферм Красноярского и Харабалинского районов Астраханской области в октябре – ноябре 2018 г. Материал исследования (молоко верблюдиц) обрабатывался поэтапно. На первом этапе образцы молока центрифугировали при 8000 об\мин в течение 40–45 мин и затем удаляли образовавшуюся жировую (масляную) фракцию. Безжировую сыворотку маркировали, определяли концентрацию лактоферрина и хранили при -18 °С.
На втором этапе аликвоты молочных сывороток с наибольшей концентрацией лактоферрина объединяли и использовали для дальнейшего выделения целевого продукта. Для выяснения физико-химических свойств CLF, необходимых для его выделения и очистки, использованы, методы электрофореза, гель-фильтрации, иммуноэлектрофореза и иммунодиффузионного анализа в агаре (ИДА) [11].
Полученные результаты исследований обработаны с помощью пакета статистического анализа Statistica 6, SPSS V 10.0.5, программ «STATLAND», «EXСEL-97», «Basic Statistic» c учетом стандартных методик вариационной статистики, включая вычисление критерия t Стьюдента для оценки достоверности различий. Данные представлены в виде М ± m, достоверные различия обсуждались при t < 0,01.
Результаты исследования и их обсуждение
Определение термолабильности CLF. Исследование термолабильности проводили путем прогрева аликвот (0,4 мл) сыворотки молока верблюдиц в термостатируемой водяной бане от 40 °С до 80 °С в течение 20 мин при каждой температуре. Определение CLF проводили методом радиальной иммунодиффузии. Определение общего белка спектрофотометрически. Всего исследовано 23 образца сыворотки молока верблюдиц. Результаты исследования представлены в табл. 1. Как видно из табл. 1, CLF сохраняет свои антигенные свойства практически полностью при температуре 75 °С, при этом его относительная концентрация (степень очистки) возрастает в 6,2 раза из-за денатурации балластных белков.
Таблица 1
Определение термолабильности CLF
|
Контрольная температура в град °С |
Число образцов |
Проценты общего белка от исходного |
Проценты CLF от исходного |
Отношение CLF /ОБ в процентах |
|
40 |
4 |
98 |
100 |
0,06 |
|
45 |
6 |
76 |
100 |
1,7 |
|
50 |
5 |
62 |
100 |
2,4 |
|
55 |
4 |
54 |
100 |
3,1 |
|
60 |
7 |
43 |
100 |
3,9 |
|
65 |
6 |
37 |
89 |
4,4 |
|
70 |
7 |
24 |
87 |
5,7 |
|
75 |
6 |
17 |
84 |
6,2 |
|
80 |
7 |
12 |
71 |
7,4 |
Определение преципитационных характеристик CLF. Эффективным методом выделения белков считается градиентное высаливание. Мы использовали высаливание сульфатом аммония. Cыворотка молока верблюдиц, была забуферена трис-солянокислым буфером в ячейке для ультрафильтрации Stirred Ultrafiltration Cells Models 8010.Осаждение CLF проводили насыщенным раствором сульфата аммония. Конечная концентрация сульфата аммония выражалась в его молярной концентрации. Показано, что преципитация сульфатом аммония не имеет самостоятельного значения для очистки CLF, так как максимальная степень очистки преципитацией при концентрации 2,0 М сульфата аммония менее 2,0. Тем не менее в общей схеме очистки преципитация сульфатом аммония может быть использована в сочетании с другими методами.
Взаимодействие CLF с лектинами. Широко известно [12] эффективное использование углеводсвязывающих белков – лектинов, для очистки самых различных протеинов. Лектины используют в качестве лигандов в аффинной хроматографии, что значительно упрощает и ускоряет процесс очистки многих минорных белков биологических жидкостей и тканей человеческого организма. Мы провели эксперимент по связыванию препарата CLF, полученного ранее хроматографическими методами, с различными лектинами. Проверка связывания проводилась методом ракетного иммуноэлектрофореза после предварительной инкубации препарата CLF с иммобилизованными лектинами чечевицы, конконвалином А, лектином арахиса, лектином бодяги речной (Ephydatia fluviatilis) и лектином икры окуня.

Рис. 1. Ракетный иммуноэлектрофорез препарата CLF после обработки различными лектинами. 1–4 – Разведения CLF. Концентрации 5, 10, 15, 20 мкг/мл, 5, 6, 7, 8, 9, 10 – образцы CLF после взаимодействия с иммобилизованными лектинами: 5 – лектин арахиса; 6 и 10 – лектин бодяги речной (Ephydatia fluviatilis); 7 – лектин чечевицы; 8 – лектин икры окуня; 9 – конканавалин А
Учитывая углеводную специфичность использованных лектинов [12], в CLF мало доступны группы глюкозы и галактозы. Отмечается умеренное сродство к фукозе. Наиболее эффективно связывается CLF с лектином бодяги речной (Ephydatia fluviatilis) и достаточно значимо с конканавалином А. Это свидетельствует о преобладании в углеводном компоненте CLF галактозамина и метилманнозы.
Для выделения CLF мы предлагаем провести аффинную хроматографию полученной после тепловой обработки сыворотки молока верблюдиц на иммобилизованном лектине бодяги речной. Выбор лектина бодяги речной обусловлен практически полным связыванием CLF с этим лектином (по нашим данным 92–93 %), кроме того, этот лектин мало изучен, так как описан относительно недавно [13]. Иммобилизацию лектина мы провели на агарозном геле, активированном трихлортриазином.
100 мл геля агарозы 4В промыли на воронке деионизированной водой, затем суспендировали в 100 мл ацетона и перемешали 30–45 мин при комнатной температуре. Растворили 0,5–1 г TsT в 15–20 мл ацетона, затем добавили такое же количество воды. Эту и все последующие операции проводили под тягой из-за токсичности TsT. Приливая раствор триазина с перемешиванием к суспензии геля, добавляли 10 мл 2 М NaHC03, перемешивали ещё 5 мин, быстро отфильтровали и промывали гель 0,1 М фосфатным буфером (рН 6,7) в 50 %-ном ацетоне. Затем уравновешивали гель в 0,5 М боратном буфере (рН 8,7) и добавили лектин клещевины из расчета 3–5 мг на 1 мл геля. Суспензию перемешивали 10–12 ч при +4 °С. Далее промывали тем же буфером от избытка лиганда и обрабатывали 5 % раствором этаноламина для блокирования незамещенных активных центров. Гель хранили до использования в 0,5 М боратном буфере, рН 8,0, содержащем 0,005 % азида натрия при +4 °С.
Гель-фильтрация CLF. Гель-фильтрация широко распространена как метод выделения, очистки и характеристики белковых молекул. Мы провели гель-хроматографию белков сыворотки молока верблюдицы. Железосодержащий белок CLF выходит в проксимальной части третьего хроматографического пика и иммунохимически идентифицируется с 65 по 78 пробирки (рис. 2). Пробирки, содержащие CLF, сливали и в этой фракции определяли общее содержание белка и общее содержание CLF для расчета степени очистки и выхода белка. На основании расчета свободного объема колонки к выходу CLF рассчитана его молекулярная масса, равная 81,0 ± 5,2 KD.
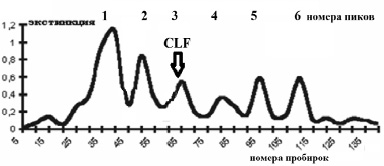
Рис. 2. Гель-фильтрация белков сыворотки молока верблюдицы на колонке сефадекса G-200. (Колонка 1,2х95 см, фракции по 2,0 мл). Стрелками указана зона выхода CLF по данным иммунохимического анализа
Таким образом, в процессе гель-фильтрации удаётся однократно повысить степень очистки CLF более чем в 6 раз, но недостатком этого метода мы считаем большие потери выделяемого белка, которые составляют более 50 %.
Известен способ выделения верблюжьего лактоферрина, основанный на связывании анионных соединений, таких как гепарин и ДНК, эти материалы были использованы для очистки лактоферрина [14]. Выделение CLF проводилось эдюированием градиентом 1,0 М хлорида натрия в 10 мМ фосфатном буфере из колонки гепарин-сефарозы.
Мы провели сравнительное исследование выделения и очистки лактоферрина верблюдиц известным способом и способом, разработанным нами на основе обнаружения способности лектина бодяги речной эффективно связывать лактоферрин верблюдиц.
Очистка CLF способом, основанным на гепарин-сефарозной хроматографии. Для очистки лактоферрина верблюдиц использовали 450 мл безжировой фракции молока верблюдиц.
На первой стадии проводили диализ безжировой фракции молока верблюдиц против 0,5 мМ веронал-солянокислого буфера с рН = 7,4. Диализ проводили при температуре +4 °С, при постоянном перемешивании; продолжительность диализа 28–36 ч, при четырехкратной смене буфера.
На следующей стадии проводили гепарин-сефарозную хроматографию на стандартной колонке heparin sepharose CL-6B 10 ML, GE Healthcare (приобретена в компании Пущинские лаборатории). Хроматографию проводили в веронал солянокислом буфере рН = 7,4. Сначала через колонку пропускали 90 мл безжировой отдиализованной фракции молока верблюдиц, а затем проводили хроматографию с линейным градиентом хлористого натрия от 0 до 1,0 М. скорость потока составляла 50 мл в час. Пик элюции верблюжьего лактоферрина приходился на концентрацию хлорида натрия 0,5 М. Содержание CLF во фракциях определяли иммунохимически. Пробирки, содержащие CLF, сливали и определяли общую концентрацию CLF (рис. 3).
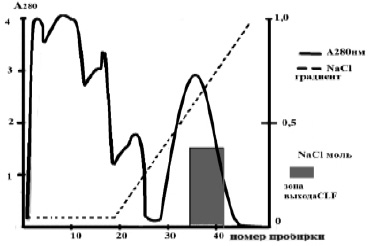
Рис. 3. Гепарин-сефарозная хроматография безжировой фракции молока верблюдиц
Недостатками этого метода являются: трудоемкость, длительность проведения, невысокий выход продукта и недостаточная его чистота. Этот метод не позволяет накопить достаточные количества чистого препарата лактоферрина верблюдиц, так как колонка heparin sepharose CL-6B 10 ML, GE Healthcare не позволяет по своей ёмкости пропускать более 90 мл безжировой фракции молока верблюдиц. При элюции объемов, превышающих 90 мл по нашим данным, часть лактоферрина верблюдиц не связывается с гепарином и выходит из колонки в нулевом объёме.
Мы провели исследование по упрощению и ускорению способа очистки CLF. Нами предложен новый способ очистки лактоферрина верблюдиц, основанный на обнаруженной нами способности лектина бодяги речной связывать лактоферрин верблюдиц.
Очистка CLF способом, основанным на аффинной хроматографии с лектином бодяги речной.
Для очистки лактоферрина верблюдиц использовали 450 мл безжировой фракции молока верблюдиц (получение описано в разделе «Материалы и методы исследования»).
На первой стадии проводили термическую обработку всего используемого объёма безжировой фракции молока верблюдиц при 75 °С в течениe 30 минут в термостатируемой ячейке автотермостата АМ-208. Далее полученная фракция подвергалась центрифугированию при 8000 об\мин в течение 40 мин на центрифуге ЦЛС-32. Надосадочная жидкость собиралась и использовалась в дальнейшей работе.
Заключительная стадия очистки CLF представляет собой аффинную хроматографию лактоферрина верблюдиц на иммобилизованном лектине бодяги речной. Через колонку (1,5х12 см) лектин-сефарозы, уравновешенную трис-НCl буфером, пропускали весь объем полученной на предшествующей стадии, фракции. Далее колонку промывали 1 М раствором хлорида натрия, забуференного трис-НCl буфером, а затем элюировали, связанный на колонке CLF 0,1 М раствором лактозы в боратном буфере рН = 9,0. Полученный элюат диализовали и концентрировали до приемлемого объёма (26,0 мл).
В табл. 2 приведены сведения сравнительного исследования выделения лактоферрина верблюдиц методом гепарин-сефарозной хроматографии (1 способ) и аффинной хроматографии с лектином бодяги речной (2 способ). Анализ полученных результатов показал, что аффинная хроматография на лектине бодяги речной не только значительно упростила и сократила время выделения и очистки лактоферрина верблюдиц, но и достоверно повысила выход целевого продукта с 38,5 % до 49,3 %. Также возросла степень чистоты препарата с 92,1 % до 98,3 %. Объективно эти цифры подтверждает электрофорез в полиакриламидном геле (рис. 4). На препарате видно наличие белковых примесей в лактоферрине, полученном гепарин-сефарозной хроматографией.
Таблица 2
Сравнительный анализ способов выделения лактоферрина верблюдиц
|
Стадии очистки |
1 способ |
2 способ |
||||
|
Общий белок (мг) |
CLF мг |
Выход CLF % |
Общий белок (мг) |
CLF мг |
Выход CLF % |
|
|
Исходный сливной препарат молока |
32205,75 |
1280,6 |
100 |
32451,0 |
1267,9 |
100 |
|
безжировая фракция молока верблюдиц |
30716,00 |
1232,5 |
96,24 |
31021,00 |
1229,0 |
96,93 |
|
диализ безжировой фракции молока верблюдиц |
27272,05 |
1098,0 |
85,74 |
– |
– |
– |
|
гепарин-сефарозная хроматография |
518,65 |
493,0 |
38,5 |
– |
– |
– |
|
Термическая обработка |
– |
– |
– |
15076,2 |
1123,4 |
88,6 |
|
Аффинная хроматография на лектине бодяги речной |
– |
– |
– |
637,86 |
626,3 |
49,3 |
|
Степень очистки |
26,43 |
38,6 |
||||
|
Чистота препарата |
92,1 |
98,3 |
||||
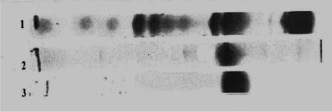
Рис. 4. Электрофорез в полиакриламидном геле. 1 – исходная безжировая фракция молока верблюдиц; 2 – лактоферрин верблюдиц, полученный гепарин-сефарозной хроматографией; 3 – лактоферрин верблюдиц, полученный аффинной хроматографией на лектине бодяги речной
Таким образом, разработан новый способ выделения лактоферрина молока верблюдов, основанный на характерных для лактоферрина молока верблюдов свойствах высокой термостабильности и аффинности к лектину бодяги речной. Способ прост в исполнении и позволяет получить высокоочищенный препарат лактоферрина молока верблюда с высоким выходом целевого продукта.
Библиографическая ссылка
Насибулин Р.Р., Николаев А.А. РАЗРАБОТКА СПОСОБА ВЫДЕЛЕНИЯ ЛАКТОФЕРРИНА ВЕРБЛЮДА // Международный журнал прикладных и фундаментальных исследований. 2021. № 6. С. 11-16;URL: https://applied-research.ru/ru/article/view?id=13223 (дата обращения: 11.02.2026).

