Синтез супрамолекулярных систем (СМС) на основе глицирама (GC) и аминокислот является актуальным и перспективным подходом для получения препаратов с улучшенными и полезными свойствами [1–4]. В работе [5] указывается, что нет принципиальной разницы, когда СМС образует глицирризиновая кислота (GA) или ее моноаммонийная соль – глцирам (GC). Поэтому мы в равной степени рассматривали СМС обеих молекул. Сочетание GA и GC с различными аминокислотами дает препараты с очень полезными свойствами.
Так, показано [6], что комплекс GA и Arg обладает выраженным гепатопротекторным действием, и поэтому он входит в состав различных биологически активных композиций. Сочетание соли GA с аминокислотами аргинином, орнитином и гистидином оказывает более высокий лечебный эффект, чем свободная GA [7, 8].
В работе [9–11] изучена антиоксидантная активность GA и аминокислот: L-триптофана, L-метионина, L-цистеина, ДL-карнитина, природных полифенолов и их СМС. Авторы отмечают, что СМС, полученные на основе GA, оказывали более эффективное антиоксидантное действие, чем отдельно взятые соединения.
Комплексообразование [12] обеспечивает защиту базового препарата от быстрого метаболизма в организме, улучшает его транспорт через биологические мембраны, позволяет пролонгировать эффект действующего вещества за счет повышения аффинности к рецептору органа-мишени.
Исследование супрамолекулярного комплекса между GC и L-Glu представляло интерес с нескольких точек зрения:
- СМС GC и Glu еще не изучена. Такие системы интересны с точки зрения природы сил, которые удерживают компоненты вместе, обуславливая изменения свойств исходных продуктов, главным образом повышая их растворимость в воде, следовательно, повышая биодоступность [13]. L-Glu, в отличие от большинства аминокислот, обладает плохой растворимостью в воде [12];
- представляет интерес синтез комплекса в твердой фазе, поскольку он имеет ряд преимуществ и является более перспективным для таких систем, чем синтез в жидкой фазе [14]. Кроме этого, основанием для выбора твердофазного синтеза послужило то, что в работе [5] с помощью рентгеноструктурного анализа изучено строение кристаллов GC. Авторы констатируют, что молекулы GC расположены относительно друг друга таким образом, что образуют каналы и полости, что, на наш взгляд благоприятствует внедрению в них фармаконов;
- СМС GCи L-Glu представляет интерес с биологичесой точки зрения. Известно, что L-Glu является энергетическим материалом для ткани мозга. Это связано с ее способностью окисляться в митохондриях через стадию образования кетоглутаровой кислоты с выходом энергии, запасаемой в виде АТФ. L-Glu обладает хорошими нейропротекторными свойствами.
Хорошо известно, что GC является сильным противовоспалительным средством. Кроме того, в работе [15] показано, что глицирам стимулирует восстановление как гранулоцитарного, так и эритроидного ростка костномозгового кроветворения. Стимулирующий эффект глицирама связан с его активирующим влиянием на функцию клеток кроветворного микроокружения. Поэтому сочетание таких полезных свойств исходных соединений – GC и L-Glu в одной супрамолекулярной системе представляет значительный практический интерес.
Цель исследования супрамолекулярного комплекса моноаммонийной соли глицирризиновой кислоты (глицирама) с L-глутаминовой кислотой основывается на свойствах супрамолекулярных соединений, которые достаточно устойчивы, но при определенных условиях способны распадаться на исходные вещества, при этом растворимость плохо растворимого компонента значительно повышается, обуславливая его большую биодоступность.
Материалы и методы исследования
Твердофазный синтез. Навеску GC и Glu брали в мольном соотношении 1:1. Механохимическую обработку проводили в планетарной мельнице РМ-200 (Retsch) в течение 3–5 мин.
ИК-спектры исходных соединений и комплекса сняты на ИК-Фурье-спектрометре Agilent Cary 600, прессованные в KBr.
УФ-спектры изучены на спектрофотометре ПЭ-5400. Приготовленные растворы GC и L-Glu, c концентрацией 10-4 М, брали в соотношениях GC:L-Glu 1:9, 2:8, 3:7, 4:6, 5:5, 6:4, 7:3, 8:2, 9:1 при постоянном объеме. Смешивание водных растворов компонентов комплекса для съемки УФ-спектров производили на орбитальном мультишейкере Multi PSU-20 в течение 40 мин при комнатной температуре.
Рентгеновский порошковый дифракционный анализ используется для подтверждения физической фазы продукта. Рентгеноструктурные исследования проводились с использованием рентгеновского дифрактометра XPERT-PRO (λ = 1,541874 Å). Образец порошка отсканирован в диапазоне 2th15-800 40kv/30mA, шаг 2th 0,020 при комнатной температуре.
Испытания синтезированных комплексов на биологическую активность проведены на высокогорном полигоне Туя-Ашуу (3500 м, Кыргызстан) в условиях гипоксии [16].
Гипоксия представляет собой универсальный патологический процесс, сопровождающий и определяющий развитие различных патологий. Известно, что наиболее чувствительны к дефициту кислорода головной мозг, эндотелий сосудов, миокард, почки – т.е. ткани, менее приспособленные к анаэробному способу получения энергии.
Опыты проводились на половозрелых крысах-самцах весом 220–260 г в количестве 36 крыс. Эксперимент описан в работе [16].
Результаты исследования и их обсуждение
Анализ ИК-спектров
ИК-спектр GC (KBr, ν, см-1): 3197 (OH, NH), 2837 (CH), 1717 (C=O), 1699,8 (C=O), 1647,7 (C11=O, C=C), 1589 (СОО-), 1456 (СН2, СН3), 1418 (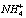 ), 1387,6 (CH), 1362 (CH), 1212 (CH), 1165 (С-О-С, С-ОН), 1040,6 (С-О-С, С-ОН), 981 (=CH).
), 1387,6 (CH), 1362 (CH), 1212 (CH), 1165 (С-О-С, С-ОН), 1040,6 (С-О-С, С-ОН), 981 (=CH).
ИК-спектр Glu (KBr, ν, см-1): 3064 (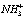 ), 2741 (ОН, NН, CH), 1699 (СООН неионизованная), 1636 (аминокислотная полоса I, NH3+), 1558,7 (СОО-), 1506 (аминокислотная полоса II, NH3+), 1419 (СОО-), 1349,6 (СН), 1310 (СН), 1256 (СН), 1232 (СН), 1212 (СН), 1149 (СН), 1126 (СН), 1073 (С-О-С, С-ОН), 1051 (С-О-С, С-ОН), 945 (ОН), 911 (ОН).
), 2741 (ОН, NН, CH), 1699 (СООН неионизованная), 1636 (аминокислотная полоса I, NH3+), 1558,7 (СОО-), 1506 (аминокислотная полоса II, NH3+), 1419 (СОО-), 1349,6 (СН), 1310 (СН), 1256 (СН), 1232 (СН), 1212 (СН), 1149 (СН), 1126 (СН), 1073 (С-О-С, С-ОН), 1051 (С-О-С, С-ОН), 945 (ОН), 911 (ОН).
ИК-спектр комплекса GC:Glu (1:1), (KBr, ν, см-1): 3051 (OH, NH), 1699 (СООН), 1636,9 (аминокислотная полоса I), 1615 (СОО-), 1516 (аминокислотная полоса II), 1420 (СОО-), 1349 (СН), 1310 (СН), 1254 (СН), 1231 (СН), 1151 (СН), 1126 (СН), 1053 (С-О-С, С-ОН), 946 (ОН), 913 (ОН).
Дикарбоновые моноаминокислоты, к которым относится L-Glu, содержат в своём составе протонированную аминогруппу, ионную форму карбоксила, участвующую в образовании цвиттер-ионной формы аминокислоты, а также недиссоциированную форму карбоксила.
Взаимодействие GC с Glu вызывает в ИК-спектрах сдвиги ряда полос поглощения. В образовании комплекса GC и L-Glu участвуют группы СОО – и 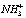 аминокислоты, что подтверждается смещением аминокислотной полосы I на 1 см-1, аминокислотной полосы II на 10 см-1 в длинноволновую область. При образовании комплекса GC и L-Glu в его ИК-спектре наблюдается уменьшение интенсивности частот поглощения симметрических валентных колебаний групп СОО –. Значительные изменения претерпевают валентные колебания
аминокислоты, что подтверждается смещением аминокислотной полосы I на 1 см-1, аминокислотной полосы II на 10 см-1 в длинноволновую область. При образовании комплекса GC и L-Glu в его ИК-спектре наблюдается уменьшение интенсивности частот поглощения симметрических валентных колебаний групп СОО –. Значительные изменения претерпевают валентные колебания 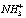 аминокислоты: широкая полоса с вершиной в области 3011,4 см-1 в аминокислоте смещается в область 3051,4 см-1 в комплексе, что свидетельствует об образовании водородных связей. Неионизованные карбоксильные группы, как GC, так L-Glu, остаются без изменения, следовательно, они не принимают участия во взаимодействии. Значительные изменения претерпевают связи (С-О-С, С-ОН) в GC – их интенсивность сильно уменьшается, следовательно, они также участвуют в образовании водородных связей с аминогруппой цвиттер-иона.
аминокислоты: широкая полоса с вершиной в области 3011,4 см-1 в аминокислоте смещается в область 3051,4 см-1 в комплексе, что свидетельствует об образовании водородных связей. Неионизованные карбоксильные группы, как GC, так L-Glu, остаются без изменения, следовательно, они не принимают участия во взаимодействии. Значительные изменения претерпевают связи (С-О-С, С-ОН) в GC – их интенсивность сильно уменьшается, следовательно, они также участвуют в образовании водородных связей с аминогруппой цвиттер-иона.
Такие изменения спектральных данных можно объяснить электростатическими взаимодействиями цвиттер-ионной формы аминокислоты с ионизованной карбоксильной группой, а также другими функциональными группами GC, содержащими атом кислорода [17].
Анализ УФ-спектров
Из УФ-спектров изомолярных серий GC и L-Glu определено соотношение компонентов, при котором образуется комплекс. Состав комплекса определен методом изомолярных серий [18]. Изомолярные кривые, полученные для смесей GCcL-Glu, приведены на рис. 1 и 2. Наличие изобестической точки (рис. 1) свидетельствует об образовании только одного типа комплекса между веществами.
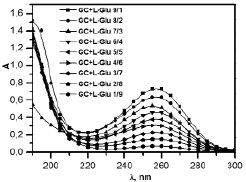
Рис. 1. УФ-спектры поглощения растворов GC и L-Glu в изомолярных соотношениях при рН 7,2
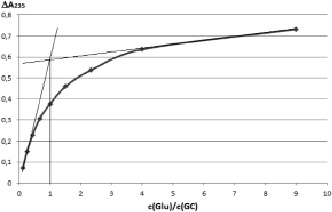
Рис. 2. Зависимость изменения оптической плотности DА от соотношения компонентов изомолярной серии при l = 235 нм (с(Glu) = 10-4M, c(GC) = 10-4M, pH 7,2)
Для компонентов комплексов получено молярное соотношение 1:1 (рис. 2).
Анализ рентгенофазовых спектров

Рис. 3. Дифрактограммы GC; Glu; GC+L-Glu
Из сравнения дифрактограмм исходных соединений GC,L-Glu и дифрактограммы комплекса GC+L-Glu можно видеть снижение интенсивности рефлексов GC, а также снижение интенсивности и уширение рефлексов L-Glu, что может свидетельствоать о значительной потере кристалличности L-Glu. Данный эффект может быть связан с молекулярным диспергированием L-Glu в твердую фазу комплексообразователя с образованием комплексов.
Выводы из биологических испытаний
L-Glu в комплексе с GC оказывают выраженное нейропротекторное действие по сравнению с исходными компонентами. Клетки мозга и кардиомиоциты были с более выраженными ядрами и цитоплазмой. Хорошо сохранилась поперечная исчерченность миофибрилл сердечной ткани. Пирамидальные клетки и клетки нейроглии хорошо выражены. Данная картина возможна из-за митохондриальной активности и аккумулирования АТФ в этих клетках за счет препаратов L-Glu в комплексе с GC.
Заключение
Проведенные исследования позволили установить, что при твердофазном синтезе между GC и L-Glu образуется супрамолекулярный комплекс с соотношением компонентов 1:1, удерживаемый за счет электростатических взаимодействий, за счет образования водородных связей между компонентами и изменения их кристаллической структуры. Комплекс обладал более выраженным нейропротекторным эффектом в условиях гипоксии, по сравнению с исходными соединениями, и может представить интерес для практического использования.
Библиографическая ссылка
Джуманазарова A.C., Матаипова А.К., Маметова A.C., Абдуллаева Ж.Д. ИССЛЕДОВАНИЕ СУПРАМОЛЕКУЛЯРНОГО КОМПЛЕКСА МОНОАММОНИЙНОЙ СОЛИ ГЛИЦИРРИЗИНОВОЙ КИСЛОТЫ (ГЛИЦИРАМА) С L-ГЛУТАМИНОВОЙ КИСЛОТОЙ // Международный журнал прикладных и фундаментальных исследований. 2021. № 7. С. 66-70;URL: https://applied-research.ru/ru/article/view?id=13251 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13251

