Жизненный цикл клетки многоклеточного организма состоит из эмбриональной фазы, включающей многочисленные этапы пролиферации и дифференцировки оплодотворённой яйцеклетки, фазы функционирования взрослой дифференцированной клетки и фазы запрограммированной клеточной гибели. Покоящиеся терминально дифференцированные клетки имеют тенденцию быть сильно поляризованными, в то время как более пластичные типы клеток (стволовые клетки, эмбриональные клетки и раковые клетки) имеют тенденцию быть относительно деполяризованными [1]. Мембранный потенциал растёт в процессе дифференцировки и достигает максимума у взрослой дифференцированной клетки, а затем падает в процессе гибели по типу апоптоза [1, 2]. Если влияние ионного состава цитоплазмы на экспрессию различных генов интенсивно исследовалось уже много лет [1, 3], то влияние ионного состава внешней среды на различные фазы жизненного цикла клетки детально не исследовалось. Целью работы было исследование влияния активности неорганических ионов на разных этапах жизненного цикла клетки.
Материалы и методы исследования
В наших экспериментах определялось влияние различных культуральных сред на процессы пролиферации, дифференцировки и апоптоза [4]. В экспериментах использовалась культура клеток нейробластомы мыши NIE-115 (клон С-1300), способной к обратимой дифференцировке и спонтанной регрессии.
Основные компоненты используемых сред представлены в таблице.
Основные компоненты используемых сред
|
Номера сред |
Молярность, Σ[сi], мОсм |
рН |
[Na+], mM |
[K+], mM |
[Ca2+], mM |
Аминокислоты, мМ |
Углеводы, мМ |
|
1* |
408 |
8,2 |
185 |
5,40 |
4,30 |
11,2 |
6,6 |
|
2** |
350 |
7,5 |
160 |
5,40 |
1,80 |
11,2 |
6,6 |
|
3 |
408 |
7,5 |
185 |
5,40 |
4,30 |
11,2 |
6,6 |
|
4 |
350 |
6,8 |
160 |
5,40 |
1,80 |
11,2 |
6,6 |
|
5 |
350 |
7,5 |
160 |
5,40 |
1,80 |
11,2 |
6,6 |
|
6 |
350 |
8,2 |
160 |
5,40 |
1,80 |
11,2 |
6,6 |
|
7 |
354 |
7,6 |
150 |
5,80 |
1,30 |
33,6 |
10,00 |
|
8 |
323 |
6,8 |
137 |
5,35 |
1,26 |
0,00 |
5,56 |
|
9 |
323 |
7,4 |
137 |
5,35 |
1,26 |
0,00 |
5,56 |
|
10 |
323 |
8,2 |
137 |
5,35 |
1,26 |
0,00 |
5,56 |
|
11 |
214 |
7,5 |
90 |
5,00 |
2,00 |
0,97 |
11,1 |
*К среде DMEM добавлено 10 % сыворотки, 25 мМ NaCl и 2,5мМ CaCl2.
**К среде DMEM добавлено 10 % сыворотки.
Через сутки после культивирования на среде № 2 (таблица) клетки переводили на одну из сред, представленных в таблице. Плотность посева в стандартных пластиковых флаконах составляла 1х104 клеток на см2. Степень морфологической дифференцировки определяли как долю клеток, образующих отростки, длина которых более чем в два раза превышала диаметр клетки. Время дифференцировки определяли как время воздействия среды, за которое доля дифференцированных клеток достигала 70 ± 10 % %. Время жизни определяли как время, за которое гибель клеток достигала 85 ± 10 % %.
Результаты исследования и их обсуждение
Значительные различия, представленные на рис. 1, были зарегистрированы при изменении кислотности среды от pH 7,5 до pH 8,2.
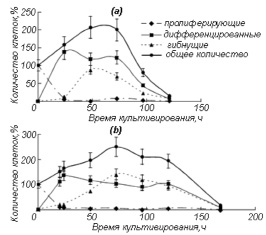
Рис. 1. Изменение количества клеток нейробластомы мыши N1Е-115, выращенных в среде № 2, при замене среды (в точке t = 0 на оси времени): а – на среду № 5 (DMEM, pH 7.5; время дифференцировки – 24 ч, время жизни – 120 ч), б – на среду № 6 (DMEM, pH 8.2; время дифференцировки – 20 ч, время жизни – 168 ч)
В среде № 5 при рН7,5 время дифференцировки составило 24 ч, а время жизни – 120 ч, а в среде № 6 время дифференцировки практически не изменилось, а время жизни увеличилось почти в полтора раза. Зависимости времени дифференцировки и времени жизни от содержания ионов Na+ в культуральной среде представлены на рис. 2.
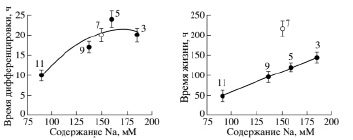
Рис. 2. Зависимость периода дифференцировки (слева) и продолжительности жизни (справа) от концентрации Nа + в среде. Цифры рядом с точками данных соответствуют номерам сред, перечисленным в таблице
Эксперименты показали, что как время дифференцировки, так и время жизни минимальны при низких концентрациях ионов Nа+ в среде. Время дифференцировки при увеличении концентрации ионов Nа+ в среде от 100 mM до 200 mM может изменяться практически в два раза, а время жизни – почти в три раза. При изменении кислотности внешней среды от рН 7,5 до pH 8.2 время дифференцировки уменьшилось от 24 ч до 20 ч, а время жизни увеличилось с 120 ч до 168 ч.
Наши эксперименты показали значительные изменения как времени дифференцировки, так и времени жизни при изменении рН внешней среды и при изменении содержания ионов натрия. В последних публикациях рассматриваются четыре типа переносчиков ионов, регулирующих содержание ионов Na+ и рН у глиальных клеток. Это обменники Na+/H+ (NHE), обменники Na+/Ca2+ (NCX), котранспортеры Na+-K+-Cl- (NKCC) и котранспортеры Na+-HCO3- (NBC) [5, 6]. Обменники Na+/H+ (NHE) влияют на апоптоз, рост раковых клеток, инвазию и миграцию глиомы. Ингибирование Na+/H+ обменников способствует увеличению выживаемости в моделях глиомы на животных [6]. Клетки глиомы с нокдауном обменника демонстрировали значительно более медленный рост, чем контрольные клетки [7]. Сверхэкспрессия обменника усиливала пролиферацию и миграцию клеток глиобластомы [8]. Cубъединица альфа1 Na+/K+-АТФазы экспрессируется в большинстве глиобластом активнее, чем в нормальных тканях мозга [9]. Показано, что деполяризация усиливает пролиферацию мезенхимальных стволовых клеток, полученных из жировой ткани, а гиперполяризация усиливает дифференцировку этих клеток [10].
Самые последние исследования клеток глии in vivo подтвердили низкое содержание ионов Na+ во внутриклеточной среде [Na+]i ≈ 10 мМ, но высокие концентрации ионов натрия Na+ во внеклеточной среде и в крови [Na+]o ≈ 150 мМ [11]. В клетках глиомы крысы in vivo концентрация [Na+]i и его содержание в крови [Na+]b не отличались от нормальной ткани, а уровень натрия во внеклеточной среде [Na+]o был занижен. Это означает, что эндотелиальные клетки, окружающие опухоль, изменяют проницаемость гематоэнцефалического барьера для ионов Na+. В этих условиях клетки глиомы деполяризованы относительно нормальных глиальных клеток, что свидетельствует о готовности к пролиферации [11]. Утверждается, что изменения содержания ионов натрия Na+ в крови, в межклеточной среде или в цитоплазме in vivo могут рассматриваться как важный онкологический биомаркер [11].
Проведённые эксперименты показали, что при изменении кислотности внеклеточной среды от pH 8,2 до pH 7,5 время дифференцировки практически не изменилось, а время жизни уменьшилось почти в полтора раза. По-видимому, закисление цитоплазмы посредством активности Na+/H+ обменников способствует пролиферации раковых клеток и устойчивости лекарственным препаратам [12]. Закисление цитоплазмы астроцитов ствола мозга активирует котранспорт Na+/HCO3-, который приносит Na+ внутрь клетки. Повышение [Na+]i активирует обменник Na+/Ca2+, что приводит к поступлению ионов Ca2+ в цитоплазму [13].
Это означает, что изменения рН не влияют на экспрессию генов, ответственных за процессы дифференцировки, однако высокие рН могут блокировать экспрессию генов, ответственных за апоптоз.
Наши эксперименты показали, что как время дифференцировки, так и время жизни минимальны при низких концентрациях ионов Nа+ в среде. При увеличении концентрации ионов Nа+ в среде от 100 mM до 200 mM время дифференцировки увеличивалось практически в два раза, а время жизни – почти в три раза.
Учитывая условия водно-осмотического равновесия и известное уравнение Гольдмана для потенциала на плазматической мембране [14], можно заключить, что низкому содержанию ионов Nа+ в среде будет соответствовать низкое содержание ионов Nа+ в цитоплазме. Это означает, что при низком содержании ионов Nа+ в среде клетка гиперполяризуется. В такой клетке экспрессируются гены, ответственные за процессы дифференцировки, и гены, ответственные за апоптоз. При высоком содержании ионов Nа+ в среде клетка деполяризуется и экспрессируются гены, ответственные за процессы пролиферации [1]. Основные результаты наших исследований на клетках нейробластомы недавно были подтверждены на культивируемых эпителиальных раковых клетках. Для оценки влияния неорганических ионов на пролиферацию, дифференцировку и апоптоз использовали различные культуральные смеси, в которых проницаемые ионы (Na+, Cl- и K+) заменялись непроницаемыми ионами (N-метил-D-глюкамин (NMDG), глюконат, холин, SO42-). Значения мембранных потенциалов клеток оценивали как с помощью patch clamp, так и с помощью чувствительного к напряжению красителя [15].
Таким образом, на первых этапах жизненного цикла при пролиферации и начальной дифференцировке у клеток регистрируется низкое значение мембранного потенциала, высокое содержание ионов Nа+ и благодаря работе Na+/H+ обменников, цитоплазма слегка защелочена. У взрослой дифференцированной клетки регистрируется высокое значение мембранного потенциала, низкое содержание ионов Nа+ и слегка закисленная цитоплазма.
На последних этапах жизни клетки развивается апоптоз или некроз, регистрируются низкие значения мембранного потенциала, высокое содержание ионов Nа+. Апоптоз приводит к ингибированию Na+/H+ обменников и закислению цитоплазмы. Полученные результаты позволяют надеяться, что подбор культуральных сред поможет увеличивать выход продукции при выращивании различных клеток самых разных организмов. На уровне организма полученные результаты могут способствовать подбору препаратов, влияющих на рост или гибель конкретных клеток.
Библиографическая ссылка
Смолянинов В.В., Потапова Т.В., Мякишева С.Н., Асланиди К.Б. ЖИЗНЕННЫЙ ЦИКЛ КЛЕТКИ И АКТИВНОСТЬ НЕОРГАНИЧЕСКИХ ИОНОВ // Международный журнал прикладных и фундаментальных исследований. 2021. № 10. С. 27-30;URL: https://applied-research.ru/ru/article/view?id=13287 (дата обращения: 11.02.2026).

