Стимулированные макрофаги продуцируют активные формы кислорода (АФК) за счет активации НАДФН-оксидазы, которая собирается на плазматической мембране из цитозольных белковых компонентов [1]. Помимо бактерицидного эффекта АФК участвуют в передаче сигналов макрофагов, которые контролируют дифференцировку, активацию, поляризацию и гибель моноцитов и макрофагов [2, 3]. Популяции макрофагов являются гетерогенными, что связано с их возможностью поляризоваться в различные функциональные фенотипы в зависимости от внешних сигналов, при этом ключевое значение имеют АФК, что дает возможность воздействия на этот процесс при помощи антиоксидантов [4]. Избыточная продукция макрофагальных АФК может вызвать поражение ткани [5], при новой коронавирусной инфекции этот процесс имеет большое патогенетическое значение [6]. Таким образом, изучение радикал-продуцирующей активности макрофагов имеет большое теоретическое и практическое значение.
Для определения уровня продукции активных форм кислорода давно используется метод хемилюминесценции в присутствии люминола [7]. В качестве стимулов макрофагов предложены форбол-12-миристат-13-ацетат [8], N-формилметионил-лейцил-фенилаланин (фМЛФ) [9]. Макрофагальные активные формы кислорода представлены прежде всего супероксидным анион-радикалом и пероксидом водорода, а также митохондриальными АФК [10]. Хемилюминесцентные методы широко используются для оценки продукции АФК нейтрофилами. В подавляющем большинстве случаев используется одностадийная стимуляция, хотя двухстадийная стимуляция (ФМА и фМЛФ) позволяет значительно повысить чувствительность и информативность хемилюминометрической методики [11].
Цель исследования – изучить возможности одностадийной и двухстадийной стимуляции для изучения радикал-продуцирующей функции культивированных макрофагов и предложить параметры, характеризующие указанную функцию.
Материалы и методы исследования
Получение культуры макрофагов человека. Первичная культура моноцитов-макрофагов была получена из крови трех практически здоровых доноров (Д.1, Д.2, Д.3) в возрасте 40 ± 3 лет. Кровь была отобрана из локтевой вены после 12 ч голодания в вакуумные пробирки с гепарином лития (12–30 МЕ). Форменные элементы крови осаждали центрифугированием при 1600 об/мин (центрифуга Beckman GRP, США) с последующим отделением плазмы. Клетки суспендировали в изотоническом фосфатном буферном растворе (рН 7,4). Лейкоцитарную фракцию выделяли в градиенте плотности фиколла (ПанЭко, плотность 1,077 г/см3), центрифугируя в течение 30 мин при 1600 об/мин. Полученные клетки трижды отмывали фосфатным буферным раствором (1600 об/мин, 10 мин) и суспендировали в среде X-Vivo 10 (Lonza, Бельгия). Количество клеток подсчитывали в камере Горяева. Клетки рассаживали на стекла в чашки Петри (105 клеток на 1 см2 поверхности) и выдерживали в СО2-инкубаторе (5 % СО2, 95 % воздуха) при температуре 37 °C и 100 % влажности не менее 12 ч. После удаления неадгезировавших клеток оставшиеся моноциты-макрофаги инкубировали в течение суток в среде X-Vivo 10 в СО2-инкубаторе. Полученную клеточную культуру трехкратно промывали фосфатным буферным раствором и суспендировали (106 клеток в 1 мл) в растворе Хенкса (рН 7,4), содержащем 2 ммоль/л HEPES.
Хемилюминесцентный метод оценки радикал-продуцирующей функции макрофагов. Для изучения радикал-продуцирующей функции макрофагов использовали различные протоколы в присутствии люминола как активатора. № 1 – спонтанная хемилюминесценция, № 2 – хемилюминесценция, стимулированная форбол-12-миристат-13-ацетатом (ФМА), № 3 – хемилюминесценция, стимулированная N-формилметионил-лейцил-фенилаланином (фМЛФ), № 4 – последовательная стимуляция ФМА и фМЛФ.
Регистрацию хемилюминесценции проводили на хемилюминометре Lum-1200 («ДИСофт, Россия), позволяющем одновременно проводить анализ в 12 кюветах. В кювету, содержащую раствор Хенкса, стабилизированный HEPES (450 мкл) и люминол (конечная концентрация 45 мкМ) (все реагенты Sigma-Aldrich, США) помещали 100 мкл культуры макрофагов (100 тыс. клеток) и регистрировали спонтанную хемилюминесценцию в течение 10 мин, затем вносили 50 мкл дистиллированной воды (протокол № 1), или ФМА (50 нг/мл) (протокол № 2), или фМЛФ, (10 мкМ) (протокол № 3), или праймирующий стимул ФМА (50 нг/мл) (протокол № 4). После 15 мин инкубации в кювету № 4 вносили второй стимул фМЛФ (10 мкМ). Хемилюминограммы регистрировали не менее 450 мин. Макрофаги одного донора анализировали одновременно по четырем протоколам в трех повторах. Рассчитывали амплитуду ответа (максимальное значение хемилюминесценции) и светосумму сигнала (площадь под кривой), пропорциональную количеству АФК, продуцируемых макрофагами.
Результаты исследования и их обсуждение
Спонтанная хемилюминесценция в присутствии люминола характеризует базальную (фоновую) радикал-продуцирующую активность макрофагов, при этом свечение отражает прежде всего продукцию пероксида водорода. Хемилюминограммы приведены на рис. 1.
Из данных следует, что спонтанная хемилюминесценция развивается в течение длительного времени (более 7 ч), хемилюминограмма имеет вид кривой с максимумом, причем кинетика для разных доноров различается. Для количественной оценки этой функции целесообразно проводить интегрирование всей кривой и вычислять как общие, так и удельные (деленные на число макрофагов) показатели (табл. 1).
Таблица 1
Параметры, рассчитываемые из хемилюминограммы: амплитуда ответа Iсп, светосумма Sсп, рассчитанная за 450 мин, и соответствующие удельные величины I*сп, S*сп. Приведены средние из трех параллельных измерений
|
№ пробы |
Число макрофагов в кювете, ×10–4, кл |
Iсп, ×10–3, имп/с |
Sсп, ×10–3, имп/с |
Iсп*, ×10–3, имп/с |
Sсп*, ×10–3, имп/с |
|
1 |
10,0 |
0,76 |
8201 |
0,01 |
82,0 |
|
2 |
100,0 |
1,98 |
14337 |
0,02 |
14,3 |
|
3 |
25,0 |
2,72 |
31680 |
0,11 |
126,7 |
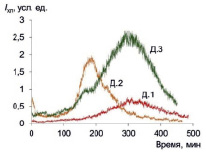
Рис. 1. Спонтанная хемилюминесценция культивируемых макрофагов трех доноров в присутствии люминола
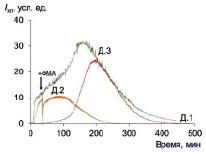
Рис. 2. ФМА-индуцированная хемилюминесценция макрофагов трех доноров; стрелкой показан момент внесения стимула
ФМА-стимулированная хемилюминесценция так же, как и спонтанная, развивается в течение примерно такого же длительного времени, но характеризуется на 1–2 порядка большей интенсивностью (рис. 2, табл. 2).
Таблица 2
Параметры, рассчитываемые из хемилюминограммы: амплитуда ответа IФМА, светосумма SФМА, рассчитанная за 450 мин, соответствующие удельные величины I*ФМА, S*ФМА, а также коэффициенты усиления по отношению к спонтанной активности. Приведены средние из трех параллельных измерений
|
№ пробы |
Число макрофагов, ×10–4, кл |
IФМА, ×10–3, имп/с |
SФМА, ×10–3, имп/с |
IФМА*, ×10–3, имп/с |
SФМА*, ×10–3, имп/с |
КФМА/сп= SФМА/Sсп |
|
1 |
10,0 |
24,82 |
186902 |
2,48 |
18690 |
22,8 |
|
2 |
100,0 |
10,97 |
83414 |
0,11 |
834 |
5,8 |
|
3 |
25,0 |
32,77 |
365509 |
1,31 |
14620 |
11,5 |
Полный ответ на фМЛФ развивается в течение такого же времени, как и спонтанный ответ (порядка 400 мин), однако пиковое значение достигается несколько быстрее (за 100–200 мин) (рис. 3). Кинетика ответа на фМЛФ аналогична кинетике ответа на ФМА, однако интенсивность ответа в несколько раз меньше (табл. 3).
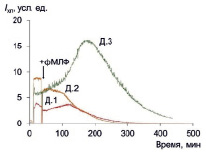
Рис. 3. ФМЛФ-индуцированная хемилюминесценция макрофагов трех доноров; стрелкой показан момент внесения стимула
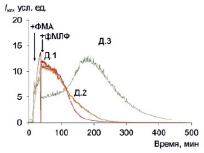
Рис. 4. Хемилюминесценция макрофагов трех доноров с двухстадийной последовательной стимуляцией ФМА+фМЛФ; стрелками показаны моменты внесения стимулов
Таблица 3
Параметры, рассчитываемые из хемилюминограммы: амплитуда ответа IфМЛФ, светосумма SфМЛФ, рассчитанная за 450 мин, соответствующие удельные величины I*фМЛФ, S*фМЛФ, а также коэффициенты усиления по отношению к спонтанной активности. Приведены средние из трех параллельных измерений
|
№ пробы |
Число макрофагов, ×10–4, кл |
IфМЛФ, ×10–3, имп/с |
SфМЛФ, ×10–3, имп/с |
IфМЛФ*, ×10–3, имп/с |
SфМЛФ*, ×10–3, имп/с |
КфМЛФ/сп= SфМЛФ/Sсп |
|
1 |
10,0 |
4,07 |
37034 |
0,41 |
3703 |
4,5 |
|
2 |
100,0 |
9,09 |
57961 |
0,09 |
579 |
4,0 |
|
3 |
25,0 |
18,71 |
200292 |
0,75 |
8011 |
6,3 |
Хемилюминограммы ответа макрофагов с двойной последовательной стимуляцией приведены на рис. 4. Применение второго стимула приводит не приводит к увеличению амплитуды и светосуммы ответа (табл. 4). Коэффициенты усиления ФМА и фМЛФ сопоставимы по порядку величины, а двойная стимуляция даже приводит к снижению ответа по сравнению с одностадийной стимуляцией.
Таблица 4
Параметры, рассчитываемые из хемилюминограммы: амплитуда ответа IФМА+фМЛФ, светосумма SФМА+фМЛФ, рассчитанная за 450 мин, соответствующие удельные величины IФМА+фМЛФ*, SФМА+фМЛФ*, а также коэффициенты усиления по отношению к спонтанной активности. Приведены средние из трех параллельных измерений
|
№ пробы |
Число макрофагов, ×10–4, кл |
IФМА+фМЛФ, ×10–3, имп/с |
SФМА+фМЛФ, ×10–3, имп/с |
IФМА+фМЛФ*, ×10–3, имп/с |
SФМА+фМЛФ*, ×10–3, имп/с |
КФМА+фМЛФ/сп= SФМА+фМЛФ/Sсп |
|
1 |
10,0 |
12,13 |
113114 |
1,18 |
8095 |
|
|
2 |
100,0 |
11,48 |
74462 |
0,11 |
744 |
5,2 |
|
3 |
25,0 |
14,50 |
152069 |
0,58 |
6082 |
4,8 |
К основным результатам работы можно отнести следующие факты: 1) ответ на единичные стимулы ФМА или фМЛФ характеризуется аналогичной кинетикой и сопоставимыми интенсивностями; 2) двухстадийная стимуляция не имеет преимуществ перед одностадийной.
Такой отклик макрофагов отличается от ответа нейтрофилов на стимулы, где ответ на ФМА и фМЛФ характеризуется различной кинетикой, а двойная последовательная стимуляция в присутствии люминола приводила к значительному (на порядки) увеличению интенсивности ответа нейтрофилов по сравнению с единичным стимулом ФМА или фМЛФ [12]. Усиление ответа на рецепторный стимул (фМЛФ) является результатом праймирования первым стимулом ФМА, который проникает в клетку путем диффузии и стимулирует протеинкиназный путь сборки НАДФН-оксидазы [13]. В макрофагах иные механизмы праймирования и активации [14], что приводит к различиям в ответе на стимулы и в кинетике этого ответа.
В работе для анализа активности макрофагов предложены протоколы, которые были ранее разработаны для анализа функциональной активности нейтрофилов. Одновременная реализация этих протоколов позволит провести анализ в идентичных условиях, что даст возможность адекватно сравнить радикал-продуцирующую активность нейтрофилов и культивируемых макрофагов, полученных из одной пробы крови. В перспективе целесообразно применить описанные протоколы для изучения активности моноцитов крови в сравнении с активностью культивируемых макрофагов.
Заключение
Предложен протокол оценки радикал-продуцирующей функции культивируемых макрофагов с использованием метода кинетической хемилюминесценции с единичным стимулом (ФМА или фМЛФ) в присутствии люминола. В качестве аналитического параметра целесообразно использовать площадь под кривой хемилюминесценции, регистрируемой не менее 450 мин.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации, тема № 0400-2020-008.
Библиографическая ссылка
Созарукова М.М., Проскурнина Е.В. ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ КУЛЬТИВИРУЕМЫХ МАКРОФАГОВ: ПРИМЕНЕНИЕ СТИМУЛИРОВАННОЙ КИНЕТИЧЕСКОЙ ХЕМИЛЮМИНЕСЦЕНЦИИ // Международный журнал прикладных и фундаментальных исследований. 2021. № 10. С. 31-35;URL: https://applied-research.ru/ru/article/view?id=13288 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13288

