Гетероциклические соединения широко распространены в природе. Они являются структурной основой витаминов, алкалоидов, входят в состав природных пигментов. Особое значение приобретают гетероциклические соединения с пяти- и шестичленными циклами, содержащими в своей структуре атомы азота. Пиперидиновый цикл входит в качестве структурного элемента в природные и синтетические физиологически активные соединения [1–3]. Было установлено, что наиболее интересными являются производные оксосоединения пиперидина гамма-пиперидоны, которые приобрели большое значение для синтеза многих анальгетиков [4, 5]. К соединениям пиперидинового ряда относится промедол, который обладает сильнейшими анальгетическими свойствами. Также к соединениям пиперидинового ряда относятся многие соединения, обладающие нейролептическими свойствами, проявляющие успокаивающее действие с уменьшением реакции на внешнее возбуждение. Наиболее распространенным нейролептиком является галоперидол, он обладает антипсихотической активностью, подавляет бред и галлюцинации, оказывает лечебный эффект при шизофренических психозах, депрессиях и других тяжелых психических заболеваниях.
Цель исследования – синтез новых гетероциклических производных пиперидинового ряда и изучение реакций нуклеофильного присоединения по карбонильной группе; прогнозировании биологической активности и их сравнительный анализ.
И всё же, несмотря на всестороннее исследование соединений пиридинового ряда, оксимированные производные пиперидиновых кетонов практически малоизучены. Обзор литературы по синтезу гетероциклических оксимов показал [5, 6], что оксимы алифатических, ароматических и тетрациклических кетонов проявляют антибактериальную, противовоспалительную, анальгетическую, противогрибковую [7, 8], гербицидную и ростовую активность [9, 10].
В связи с этим интересно было синтезировать 2,6-ди-(п-N,N диметиламинофенил)-3-изопропил-пиперидин-4-он (I) и на его основе оксим, гидразон, семикарбазон, фенилгидразон, тиосемикарбазон; подобрать оптимальные условия синтеза, выделить и идентифицировать синтезированные соединения, провести биологический скрининг.
Материалы и методы исследования
Были разработаны методы синтеза физиологически активных соединений: синтез 2,6-ди-(п-N,Nдиметиламинофенил)-3-изопропилпиперидин-4-она и его производные: оксим, гидразон, фенилгидразон, семикарбазон , тиосемикарбазон.
ИК-спектры синтезированных соединений были получены на спектрофотометре ИКС-29, Specord M-80 c программой «SoftSpectra». Температура плавления измерялась на микронагревательном столике «Baetuis». Контроль за ходом реакций и индивидуальностью веществ осуществляли методом тонкослойной хроматографии (ТСХ) на незакрепленном слое окиси алюминия. Пятна проявляли парами йода во влажной камере [5, 6].
Доэкспериментальный прогноз биологической активности проводили с использованием компьютерной системы PASS [11].
Синтез 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропил-пиперидин-4-она
Реакцию совместной конденсации проводили в круглодонной трехгорлой колбе объемом 500 мл, снабженной термометром, мешалкой и обратным холодильником. В колбу помещают 42 мл 4-метилпентанона-2 (плотность = 0,8032 г/см3), 100 г пара – N,N-диметиламинобензальдегида, 50 г ацетата аммония в 200 мл этилового спирта. Смесь нагревают при температуре 40–45 °С в течение 36 ч, периодически перемешивая. По окончании реакции реакционную смесь охлаждают до комнатной температуры и оставляют на сутки для кристаллизации, предварительно отделив нижний слой. Выпавшие кристаллы отфильтровывают под вакуумом на воронке Бюхнера, промывают изопропиловым спиртом и высушивают. Перекристаллизовывают из ацетона [6]. Выход: 75 г (58 %) кристаллического вещества желтого цвета 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропилпиперидин-4-он. Т.пл., = 28–30 °С, Rf = 0,60 в системе гексан: диоксан (20:1). ИК – спектр, см-1: 1673,9 (C = O), 3385,9 (N-H), 1364,3 i(C3H7). Вычислено, %: N = 11,08. Найдено, %: N = 10,80.
Синтез оксима 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропил-пиперидин-4-она
В трехгорлой круглодонной колбе, снабженной термометром, мешалкой и обратным холодильником, в 10 мл абсолютизированного этилового спирта растворяют 0,38 г 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропилпиперидин-4-она и 0,07 г солянокислого гидроксиламина (в отношении 1:1). Реакционную смесь кипятят в течение 8 ч, периодически перемешивая. Ход реакции и индивидуальность вещества контролируют методом тонкослойной хроматографии на незакрепленном слое окиси алюминия в системе гексан : диоксан (20:1). По окончании реакции реакционную смесь охлаждают до комнатной температуры и оставляют на трое суток для кристаллизации. Выпавшие кристаллы отфильтровывают, промывают этиловым спиртом и высушивают. Перекристаллизовывают из ацетона [6]. Выход 0,3 г (84 %) белого цвета кристаллического оксима 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропилпиперидин-4-она. Т.пл., = 80–82 °С, Rf = 0,48 в системе гексан: диоксан (20:1).
ИК-спектр, см-1: 3242,0 (N-OH), 3390,0 (N-H), 1620,1 (C=N).
При получении других производных исходного кетона: гидразона, фенилгидразона, семикарбазона и тиосемикарбазона – использовались аналогичные методики и схемы синтеза как для получения оксима.
Результаты исследования и их обсуждение
Литературные данные показывают, что пиперидоны, имеющие ароматические заместители в С2 и С6 положениях, обладают биологической активностью. В частности, оксимы и тиосемикарбазоны 2,6-диарилпиперидин-4-онов проявляют анальгезирующую, местную анестезирующую и противогрибковую активность [7, с. 4]. Например, в статье [8, с. 145] указывается, что хлоренилфенилметиловый эфир оксима 1,3,5 триметил-2,6-дифенилпиперидин-4-она проявляет антибактериальную активность против Bacillus subtilis. Следует отметить, что его активность оказалась выше известного применяемого на практике лекарства стрептомицин.
Схема получения исходного кетона 2,6-ди-(п-N,N-диметиламинофенил)-3-изопро- пилпиперидин-4-она представлена ниже.
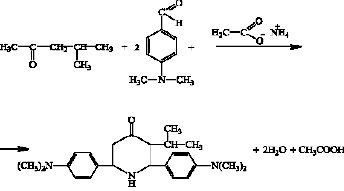
Для доказательства структуры полученного соединения был снят ИК-спектр поглощения. В области 1673,9 см-1 наблюдаются характеристические полосы поглощения для колебаний связи (C=O), в области 3385,9 см-1 характерные для (N-H) связи и в области 1364,3 см-1 характерные для колебаний i(C3H7) изопропильного радикала.
Реакция получения оксима проводилась в среде абсолютизированного этилового спирта при температуре его кипения. Ход синтеза и чистота выделенного оксима контролировались методом тонкослойной хроматографии на незакрепленном слое окиси алюминия в системе гексан – диоксан (20:1), для оксима 2,6-ди-(п-N,N-диметиламинофенил-3-изопропилпиперидин-4-она, Rf = 0,48.
На ИК-спектре оксима наблюдаются полосы поглощения в области 3390,0 см-1 характерные для колебаний (N-H) связи, в области 1350,0 см-1 характерные для колебаний i(C3H7) связи, в области 1620,1 см-1 характерные для (C=N) связи и в области 3242,0 см-1 характерные для колебаний (N-OH) связи. Появление характеристических полос поглощения некоторых функциональных групп (N-ОH, N – N, C = S) однозначно свидетельствует о прохождении реакции по карбонильной группе исходного кетона.
Были синтезированы производные исходного кетона: оксим, гидразон, фенилгидразон, семикарбазон и тиосемикарбазон. Некоторые физико-химические характеристики 2,6-ди-(п-N,N-диметиламино-фенил-3-изопропилпиперидин-4-она и его производных приведены в табл. 1.
Таблица 1
Некоторые физико-химические характеристики полученных веществ
|
Название соединения |
Т пл. °С |
Rf |
Выход % |
N % (выч./найд) |
Характеристические частоты ИК-спектров поглощения (см-1) |
||||
|
С = О |
N- ОH |
N – N |
C = S |
||||||
|
1. 2. 1 3. 1 |
2,6-ди-(п-N,Nдиметилами-нофенил)-3-изопропил-пиперидин-4-он |
28–30 |
0,60 |
58,0 |
11,08/ 10,80 |
1 11673,9 |
– |
– |
– |
|
4. 5. 2 |
Оксим2,6-ди-(п-N,Nди-метиламинофенил)-3-изо-пропилпиперидин-4-она |
80–82 |
0,48 |
84,0 |
– /– |
– |
3242,0 |
– |
– |
|
6. 7. 3 |
Гидразон2,6-ди-(п-N,Nди- метиламинофенил)-3-изо-пропилпиперидин-4-она |
95–96 |
0,42 |
48,0 |
– / – |
– |
– |
1560,8 |
– |
|
8. 9. 4 |
Фенилгидразон 2,6-ди- (п-N,Nдиметиламинофенил) -3-изопропилпиперидин-4-она |
90,0 |
0,55 |
74,0 |
– / – |
– |
– |
1557,2 |
– |
|
Семикарбозон 2,6-ди- (п-N,Nдиметиламинофенил) -3-изопропилпиперидин-4-она |
68,0 |
0,26 |
43,0 |
– /– |
1554,9 |
||||
|
Тиосемикарбазон 2,6-ди- (п-N,Nдиметиламинофе-нил)-3-изопропилпипери-дин-4-она |
74,0 |
0,38 |
39,0 |
– /– |
1558,1 |
1368,3 |
|||
В настоящее время поиск новых лекарственных средств преимущественно основан на скрининге in vitro огромных массивов химических веществ по отношению к сравнительно небольшому числу желаемых видов биологической активности. Свойства выявленных таким путем основных структурных фрагментов в последующем формируются путем синтеза и исследования их аналогов. При этом многие виды биологической активности, присущие изучаемым веществам, остаются неизученными в связи с ограниченными возможностями для их экспериментального тестирования, что требует тщательного отбора потенциально перспективных соединений. При этом значительная часть новых соединений выходит из поля зрения фармакологов и попадает в разряд неперспективных для медицины и ветеринарии. Как правило, к ним затем и не возвращаются. Поэтому актуальным представляется поиск путей целенаправленной химической модификации молекулярной структуры известных лекарственных препаратов и новых физиологически активных соединений, обладающих ценными фармакологическими свойствами. Несмотря на то, что производные гамма-пиперидонов хорошо изучены, остается много вопросов, связанных с их структурными особенностями и физико-химическими характеристиками, которые могут играть существенную роль в их активности. Структурные особенности молекул можно оценить с помощью расчетных методов. Такой отбор может быть осуществлен на основе компьютерного прогноза биологической активности химических соединений. В последнее время и физико-химические свойства становится возможным оценить непосредственно из структурной формулы соединения с помощью так называемых дескрипторов. Сравнение структурных и физико-химических параметров синтезированных веществ, полученных из расчетов, может помочь оценить вклад той или иной физико-химической характеристики в проявляемую активность и глубже понять механизм действия препарата.
Компьютерная система PASS [11] позволяет на основании структуры соединения количественно оценить вероятность наличия у него активности (Ра) и неактивности (Рi) различных видов биологической активности. С помощью данной программы мы оценили активность соединений известных как производные 2,6-ди-(п-N,N-диметиламино-фенил)-3-изопропилпиперидин-4-она: оксим, гидразон, фенилгидразон, семикарбазон и тиосемикарбазон.
Для указанных соединений с помощью программы PASS оценены разные виды биологической активности (табл. 2). В табл. 2 приведен перечень синтезированных производных исходного кетона, представляющих интерес для здравоохранения как новые биологически активные соединения. Как можно видеть, программа PASS показывает замечательную прогностическую способность. С изменением радикалов при атоме азота гетероциклического соединения, такие виды активности, как антивирусная, антимикобактериальная, антигельминтная, антитуберкулезная, увеличиваются при общем снижении токсичности. Средняя точность прогноза составляет около 94 % [11]. Химическая структура представлена в PASS в виде оригинальных MNA дескрипторов (Mulilevel Neighbourhoods of Atoms). MNA дескрипторы имеют универсальный характер и с достаточно хорошей точностью описывают разнообразные зависимости «химическая структура – реакционная способность – биологические свойства».
Таблица 2
Расчет компьютерного прогноза биологической активности синтезированных соединений в процентах
|
№ |
Название соединения |
Противоэкземная |
Рак печени (CYP2H) |
Лечение феномена Рейно |
Ноотропная |
Противовирусная (грипп А) |
Аналептическая |
Дерматологическая |
Вазопротекторная |
|
1 |
2,6-ди-(п- N,Nдиметилами-нофенил)-3-изопропил-пиперидин-4-он |
70,3 |
71,3 |
31,9 |
69,3 |
25,9 |
53,2 |
40,8 |
51,1 |
|
2 |
Оксим 2,6-ди-(п-N,Nди-метиламинофенил)-3-изо-пропилпиперидин-4-она |
32,5 |
60,9 |
29,1 |
31,6 |
0 |
30,6 |
19,3 |
0 |
|
3 |
Гидразон2,6-ди-(п-N,Nди- метиламинофенил)-3-изо-пропилпиперидин-4-она |
29,9 |
60,7 |
29,3 |
0 |
0 |
36,1 |
0 |
26,4 |
|
4 |
Фенилгидразон 2,6-ди- (п-N,Nдиметиламинофенил)-3- изопропилпиперидин-4-она |
0 |
60,5 |
28,9 |
0 |
0 |
34,0 |
0 |
27,2 |
|
5 |
Семикарбазон 2,6-ди- (п-N,Nдиметиламинофенил)-3- изопропилпиперидин-4-она |
00 0 |
51,0 |
28,9 |
0 |
20,8 |
0 |
0 |
66,0 |
|
6 |
Тиосемикарбазон 2,6-ди- (п-N,Nдиметиламинофе-нил)-3-изопропилпипери-дин-4-она |
0 |
48,5 |
24,9 |
34,3 |
57,8 |
0 |
0 |
26,2 |
В работе был выполнен расчет компьютерного прогноза биологической активности 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропилпиперидин-4-он и пяти синтезированных на его основе веществ с помощью программы PASS, согласно выше описанной методике.
При поиске базовых структур лекарственных веществ, обладающих существенной новизной, из массива исследуемых веществ следует отбирать те, для которых выполняется условие 0,5 < Pa < 0,7. В этом случае при подтверждении прогноза экспериментально высока вероятность новизны анализируемой структуры [11]. В настоящей работе нами была проведена оценка биологического скрининга исходного кетона и его производных с использованием компьютерной системы PASS.
При анализе результатов было установлено, что у всех синтезированных нами соединений с высокой степенью вероятности (Ра = 0,485–0,713) выражена противоопухолевая активность. По данным прогноза (Ра = 0,703–0,299) они обладают противоэкземной активностью и ноотропным действием (Ра = 0,693–0,316) , могут быть эффективными при плохой свертываемости крови, кислородном голодании организма, кровообращении и при лечении лейкемии.
Для оксима 2,6-ди-(п-N,N-диметил- аминофенил)-3-изопропил-пиперидин-4-она Pa > 0,605 была спрогнозирована антицеребральная активность, показана возможность использования для лечения детского церебрального паралича (ДЦП). Для семикарбазона 2,6-ди-(п-N,-диметиламинофенил)-3-изопропилпипериди-4-она Pa > 0,66 была спрогнозирована вазопротекторная активность. Показана возможность использования для лечения геморроя и варикоза. Также для тиосемикарбазона 2,6-ди- (п-N,N-диметил- аминофенил)-3-изопропилпиперидин-4-она Pa > 0,578 была спрогнозирована противовирусная активность, установлена возможность использования его для лечения гриппа. Данные расчета компьютерного прогнозирования биологической активности приведены в табл. 2.
Заключение
1. Были разработаны методы синтеза физиологически активных соединений: синтез 2,6-ди-(п-N,Nдиметиламинофенил)-3-изопропилпиперидин-4-она и производные на его основе: оксим, гидразон, фенилгидразон, семикарбазон, тиосемикарбазон. Определены некоторые физико-химические характеристики синтезированных соединений.
2. Индивидуальность и структура синтезированных веществ подтверждены элементным анализом, методом ИК-спектроскопии, методом ТСХ.
3. По программе PASS вероятность противоопухолевой активности выражена у почти у всех синтезированных соединений, но наиболее высока у 2,6-ди-(п-N,N-диметиламинофенил)-3-изопропилпиперидин-4-она. У семикарбазона наиболее высока вероятность вазопротекторной активности.
Библиографическая ссылка
Сарымзакова Р.К., Ибрагимова А.А., Сарымзакова Б.К., Хаперская Л.С., Медетбекова Ж.М. ЦЕЛЕНАПРАВЛЕННЫЙ СИНТЕЗ, КОМПЬЮТЕРНЫЙ ПРОГНОЗ И РЕЗУЛЬТАТЫ БИОЛОГИЧЕСКОГО СКРИНИНГА ПРОИЗВОДНЫХ ГАММА-ПИПЕРИДОНОВ // Международный журнал прикладных и фундаментальных исследований. 2021. № 10. С. 125-130;URL: https://applied-research.ru/ru/article/view?id=13304 (дата обращения: 23.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13304

