Исследование в области виртуального скрининга занимает длительное время, что негативно сказывается на проведении поиска новых потенциальных лекарственных средств. Одним из путей реализации цели виртуального скрининга является построение количественной зависимости «структура – активность».
Точное предсказание биологической активности больших наборов разнообразных соединений является чрезвычайно сложной задачей. Исследования в моделировании биологической активности помогают сделать вычислительный прогноз, они необходимы для открытия новых лекарств. Каждая функциональная зависимость биологической активности от структуры принимает заранее определенную функциональную форму, основанную на теории, для взаимосвязи между переменными, характеризующими комплекс, которые также включают параметры, соответствующие экспериментальным или имитационным данным, и их прогнозируемое сродство к привязке. Неотъемлемая проблема этого функционального подхода заключается в том, что он приводит к плохой предсказуемости для тех соединений, которые не соответствуют допущениям моделирования. Более того, стратегии повторной выборки, такие как перекрестная проверка, все еще систематически не используются для защиты от чрезмерного соответствия калибровочных данных при оценке параметров модели «структура – активность» [1].
Проведение компьютерного моделирования в области исследования зависимости «структура – активность» является актуальным, позволяет создавать прогнозные модели молекулярных систем, как, например, прогнозирования биологической активности. При проведении исследований количественной зависимости биологической активности от структуры необходимо учитывать параметры, оказывающие влияние на проникновение веществ в организм. К таким параметрам относятся липофильность, численно обозначается константой липофильности (log P) и ионизация с помощью констант ионизации (кислотности (рКа) и основности (рКв)).
Исследование соединений ряда производных антраниловой кислоты (а. к.) позволяет обнаружить вещества с противомикробной [2, 3], противовоспалительной и анальгетической активностями. Выделены а. к. из морских грибов Penicillium paneum SD-44 с антимикробной активностью [4].
Исследование зависимости «структура – активность» по прогнозированию противомикробной активности по отношению к E. coli позволит проводить целенаправленный синтез веществ с выраженной противомикробной активностью. Использование при прогнозировании фармакокинетических параметров: logP, pKa и рКв – позволяет проводить построение моделей биологической активности с учётом особенностей всасывания и распределения соединений в организме [5].
Цель данной работы связана с количественным моделированием антимикробной активности по отношению к E. coli (АМА К.П.) от структуры «структура – активность» с использованием констант липофильности (log P рассч) и констант ионизации (pKa рассч и pKв рассч).
Объектом проводимого исследования являются N-замещенные производные антраниловой кислоты (18 соединений).
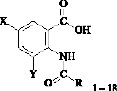
X = Br, Y = H, R = C6H5 (1); X = Br, Y = H, R = 2–OCH3C6H4 (2); X = Br, Y = H, R = 3–NO2C6H4 (3); X = Br, Y = H, R = 4–BrC6H4 (4); X = Br, Y = H, R = CH2C6H5 (5); X = I, Y = H, R = CH = CHCOOH (6); X = I, Y = H, R = C2H4Cl (7); X = I, Y = H, R = C3H6Cl (8); X = I, Y = H, R = 3–NO2C6H4 (9); X = I, Y = H, R = 4–BrC6H4 (10); X = I, Y = H, R = 4–CH3C6H4 (11); X = I, Y = H, R = CH2C6H5 (12); X = Br, Y = Br, R = CH2C6H5 (13); X = Br, Y = Br, R = CH2CH2CH2Cl (14); X = Br, Y = H, R = CH2CH2CH2Cl (15); X = Br, Y = H, R = адамантил (16); X = Br, Y = Br, R = адамантил (17); X = I, Y = H, R = адамантил (18)
Материалы и методы исследования
Математическое регрессионное моделирование проводили программой Statistica 6.
Теоретические значения log Pрассч, pKa рассч и pKв рассч 24 соединений получены с использованием программы AK_QSAR (logP, pKa, pKb) [6] (табл. 1, 3).
Результаты исследования и их обсуждение
Определены экспериментальные значения противомикробной активности (E. coli) 18 соединений из ряда N-замещенных антраниловых кислот [7]. Для изучаемых производных определены различные значения МПК, от 2 до 1500 мкг/мл (табл. 1). Полученный результат по противомикробной активности: МПК (мкг/мл) переводили в логарифм: log(1/МПК) E. coli [8] для выравнивания полученных экспериментальных результатов и получения дескриптора биологической активности – антимикробная активность по кишечной палочке (log АМА К.П.).
Известно много программ прогнозирования констант липофильности, например программа Ligand Scout, которую использовали для изучения структуры производных N-замещённых антраниловых кислот (рис. 1).
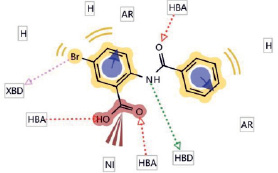
Рис. 1. Диаграмма соединения 1, гидрофобные области показаны жёлтым цветом
В результате изучения структуры N-замещённого производного антраниловой кислоты определены гидрофобные фрагменты: атом галогена (бром) и два ароматических кольца. Далее проводили квантово-химические расчёты и полученные результаты использовали при проведении прогноза свойств программой AK_QSAR (logP, pKa, pKв).
Таблица 1
МПКэксп. (E. coli), log АМА К.П. эксп., log P рассч, pKa рассч., pKв рассч. N-замещенных антраниловых кислот (18 соединений)
|
№ |
МПКэксп. (E. coli), мкг/мл |
log АМА К.П. эксп. |
logPрассч |
pKaрассч |
pKврассч |
|
1 |
62 |
-1,792 |
2,57 |
5,84 |
13,51 |
|
2 |
2 |
-0,301 |
3,06 |
6,42 |
12,98 |
|
3 |
250 |
-2,398 |
1,70 |
7,18 |
12,89 |
|
4 |
500 |
-2,699 |
2,58 |
5,51 |
13,75 |
|
5 |
250 |
-2,398 |
1,31 |
5,11 |
14,33 |
|
6 |
500 |
-2,699 |
0,25 |
6,91 |
12,43 |
|
7 |
500 |
-2,699 |
1,07 |
6,76 |
12,68 |
|
8 |
250 |
-2,398 |
1,04 |
6,25 |
13,14 |
|
9 |
250 |
-2,398 |
1,66 |
7,33 |
12,81 |
|
10 |
250 |
-2,398 |
2,63 |
5,52 |
13,60 |
|
11 |
62 |
-1,792 |
2,60 |
6,59 |
12,99 |
|
12 |
250 |
-2,398 |
1,31 |
5,18 |
14,28 |
|
13 |
1500 |
-3,176 |
1,55 |
5,16 |
13,78 |
|
14 |
1000 |
-3,000 |
1,13 |
6,16 |
13,06 |
|
15 |
1000 |
-3,000 |
1,04 |
6,18 |
13,19 |
|
16 |
1000 |
-3,000 |
2,02 |
3,51 |
14,47 |
|
17 |
1500 |
-3,176 |
1,99 |
3,26 |
14,63 |
|
18 |
1500 |
-3,176 |
2,02 |
3,58 |
14,42 |
С помощью программного комплекса AK_QSAR (logP, pKa, pKв) рассчитаны значения log P рассч, pKa рассч и pKв рассч 18 соединений (табл. 1).
Рассчитанные значения log P рассч находятся в интервале от 0,25 у соединения 6 до 3,06 (соединение 2). Значения pKaрассч (констант кислотности) находятся в пределах от 3,26 (соединение 17) до 7,33, для соединения 9. Константы основности (pKврассч) в интервале от 12,43 у соединения 6 до 14,63, для соединения 17.
Выполнены исследования зависимости биологической активности от структуры «структура – активность», в качестве изучаемой активности использовали log АМА К.П. эксп. Взаимосвязь структурных дескрипторов (log P рассч, pKa рассч, pKв рассч) с log АМА К.П. эксп. изучали множественным линейным регрессионным анализом программой Statistica 6.
По результатам проведённого анализа было получено свыше 25 уравнений, из которых выбрали два наиболее значимых для прогнозирования log АМА К.П. эксп. (табл. 2).
Таблица 2
Уравнения множественной линейной регрессии зависимости log АМА К.П. от logPрассч, pKaрассч, pKврассч
|
№ |
Уравнение регрессии |
R |
F |
S |
Q2LOO |
|
1 |
log АМА К.П. рассч. = – 8,197 + 0,600×logPрассч. + 0,411×pKaрассч. + 0,171×pКврассч. |
0,769 |
6,76 |
0,48 |
0,30 |
|
2 |
log АМА К.П. рассч. = – 5,397 + 0,608×logPрассч. + 0,322×pKaрассч. |
0,766 |
10,70 |
0,47 |
0,33 |
Значимость полученных уравнений регрессии проверяли значениями коэффициента множественной регрессии (R), среднеквадратической ошибки (S), критерия Фишера (F) и Q2LOO.
Коэффициент множественной регрессии зависимости структурных параметров от log АМА К.П. эксп. лежит в диапазоне 0,766–0,769. Критерий Фишера составляет от 6,76 до 10,70. Ошибка прогнозирования находится в диапазоне 0,47–0,48. Оценка с использованием программы Statographics, по значению коэффициента детерминации предсказаний Q2LOO по уравнению 2, выше и равна 0,33.
Проведена валидация уравнения 2, для расчёта АМА К.П. на примерах шести соединений 19–24 из ряда N-замещенных антраниловых кислот (табл. 3).
Таблица 3
log Pрассч, pKaрассч, pKврассч, log АМА К.П. рассч., log АМА К.П. эксп. N-замещенных антраниловых кислот (6 соединений)
|
№ |
log P рассч |
pKa рассч |
pKв рассч |
log АМА К.П. рассч. |
МПК рассч. (E.coli), мкг/мл |
log АМА К.П. эксп. |
МПК эксп. (E.coli), мкг/мл |
|
19 |
2,55 |
5,58 |
13,68 |
-2,05 |
111 |
-2,39 |
250 |
|
20 |
1,02 |
6,53 |
13,01 |
-2,67 |
464 |
-2,09 |
125 |
|
21 |
0,66 |
6,64 |
11,30 |
-2,85 |
713 |
-2,09 |
125 |
|
22 |
2,57 |
5,68 |
13,62 |
-2,00 |
100 |
-1,19 |
15,6 |
|
23 |
1,05 |
5,51 |
13,30 |
-2,98 |
953 |
-3,00 |
1000 |
|
24 |
1,00 |
5,90 |
13,07 |
-2,89 |
768 |
-2,39 |
250 |
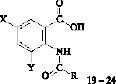
X = Br, Y = H, R = 2–фурил (19); X = I, Y = H, R = C3H7 (20); X = I, Y = H, R = C6H5 (21); X = I, Y = H, R = 4–ClC6H4 (22); X = Br, Y = Br, R = CH2Cl (23); X = Br, Y = H, R = CH2Cl (24)
Результаты определения АМА К.П. эксп. соединений 19–24 приведены в табл. 3.
Оценку точности прогнозирования МПКE. coli по полученному уравнению 2, проводили с использованием коэффициента корреляции (Rпрогн.) прогнозируемых значений (log АМА К.П. рассч.) с экспериментальными (log АМА К.П. эксп.) (табл. 3), при этом log АМА К.П. переводили в МПК (10log АМА К.П.).
На рис. 2 приведена линейная диаграмма с Rпрогн. = 0,758.
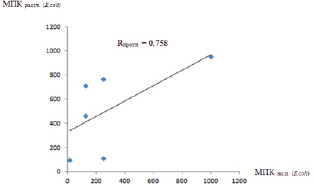
Рис. 2. Линейная диаграмма зависимости коэффициента корреляции прогнозируемых значений с экспериментальными (Rпрогн.)
Заключение
Проведены математические исследования в области количественного моделирования антимикробной активности с использованием зависимости предложенного дескриптора биологической активности log АМА К.П. от log P рассч, pKa рассч, pKв рассч N-замещенных производных антраниловой кислоты.
Из найденных двух уравнений регрессионного моделирования log АМА К.П. выделено уравнение 2 с наибольшими значениями статистических параметров, характеризующих значимость модели.
Проверка на выборке из шести соединений показала хорошие результаты с коэффициентом корреляции экспериментальных данных с рассчитанными, равным 0,758.
Высокие результаты проверки позволяют предложить использование найденной количественной модели «структура – активность» для математического моделирования противомикробной активности при поиске соединений лидеров с антимикробной активностью в отношении E. coli производных антраниловой кислоты.
Библиографическая ссылка
Андрюков К.В. КОЛИЧЕСТВЕННОЕ МОДЕЛИРОВАНИЕ «СТРУКТУРА – АКТИВНОСТЬ» ПРОТИВОМИКРОБНОЙ АКТИВНОСТИ ПО ОТНОШЕНИЮ К E. COLI С ИСПОЛЬЗОВАНИЕМ КОНСТАНТ ЛИПОФИЛЬНОСТИ И ИОНИЗАЦИИ N-ЗАМЕЩЕННЫХ АНТРАНИЛОВЫХ КИСЛОТ // Международный журнал прикладных и фундаментальных исследований. 2021. № 12. С. 71-75;URL: https://applied-research.ru/ru/article/view?id=13333 (дата обращения: 13.03.2026).
DOI: https://doi.org/10.17513/mjpfi.13333

