При наблюдении содержания тяжелых металлов в жидком состоянии необходимо принимать во внимание особенности проведения анализа, для того чтобы получить результаты с наименьшей погрешностью. Тяжёлые металлы можно отнести к существенно загрязняющим веществам, за которыми необходимо осуществлять контроль во всех средах. Они могут причинять человеку вред, вызывая ряд возможных заболеваний, представляя собой угрозу для всего населения. Именно из-за этого определение содержания ионов тяжелых металлов является актуальной задачей. При выборе метода анализа необходимо, чтобы метод был обеспечен высокими метрологическими характеристиками измерения, экспрессностью анализа, низкими пределами обнаружения и малой трудоемкостью [1].
Цель настоящей работы заключалась в исследовании параметров, которые могут быть положены в основу экспрессного способа определения тяжелых металлов в водных растворах, с использованием инверсионной вольтамперометрии.
Для достижения поставленной цели нами были решены следующие задачи:
- в области количественного определения тяжелых металлов в водных растворах был проведен сравнительный анализ литературных данных
- подобран оптимальный метод определения концентраций ионов тяжелых металлов в водных растворах, на основе инверсионной вольтамперометрии;
- определены и оптимизированы основные вольтамперометрические характеристики количественного определения концентрации тяжелых металлов на приборе ABC – 1.1 в стандартных образцах;
- в рамках экологического мониторинга проведено исследование количественного определения меди, кадмия, цинка и свинца в образцах природных вод озера п. Приозерный.
Определение концентраций тяжелых металлов проводили в стандартных растворах, приготовленных из ГСО и в образцах природных вод по известной методике [2] на полярографе ABC-1.1. Статистическую обработку результатов анализа проводили с использованием программы Mathcad.
При проведении сравнительного анализа литературных данных по способам количественного определения концентрации тяжелых металлов, нами установлено, что одним из эффективных является метод тонкослойной хроматографии [3] путем сорбции металлов на пластинках после предварительного экстракционного отделения хлороформом веществ – детергентов, масел и других соединений, мешающих проведению хроматографического процесса. Метод заключается в том, что тяжелые металлы предварительно концентрируют путем двукратной экстракции в виде диэтилдитиокарбаминатных комплексов хлороформом. Затем раствор карбаминатов упаривают, растворяют. Однако из-за непостоянства тонкослойной хроматографии – разделения элементов требует нанесение свидетелей. Способ является трудоемким, длительным, к тому же в качестве подвижной фазы используется для анализа токсичный экстрагент – бензол [4].
Для того, чтобы произвести анализ на определение содержания тяжелых металлов, можно использовать такой метод, как многоэлементный атомно-эмиссионный способ с индуктивно связанной плазмой [5]. Этот метод имеет кардинальный ряд своих недостатков, которыми пренебречь нельзя, а именно: высокая трудоемкость, так как для понижения пределов обнаружения и увеличения избирательности определения применяют сочетание предварительного концентрирования элементов и их дальнейшего определения, значительное разнообразие проб, присутствием в них примесей, которые препятствуют определению. Сопутствующие вещества, наличие которых модифицируется в широком диапазоне, значительным образом могут видоизменить итог определения.
В процессе наблюдений содержания ионов тяжелых металлов в исследуемой работе [6] можно отметить, что как высокоэффективные способы выявления фоновых концентраций металлов в разнообразных звеньях экосистемы применяют методы атомной абсорбции и рентгенофлуоресцентного анализа. Используемая методика в способе процесса концентрирования определяемых металлов является важнейшим этапом анализа и может включать в себя две стадии – концентрирование элементов из раствора методом упаривания пробы до влажных солей и дальнейшее осаждение металлов из минерализата на ДЭТАТА фильтре. Однако недостатком данных методов является сложность пробоподготовки и высокая стоимость оборудования, необходимого для анализирования.
Для оценки содержания тяжелых металлов в водных объектах, а именно природных водах, элементах биологической матрицы, к тому же Cd и Hg в донных осадках, применяется способ атомно-абсорбционной спектрометрии [7]. Способ сформирован на поглощении электромагнитного излучения свободными атомами в невозбужденном состоянии или поглощении УФ или видимого излучения атомами газов. Первый вариант требует значительных временных затрат. Второй наиболее распространен, так как позволяет с высокой точностью распознать множество разнообразных ионов металла за один этап анализа [8]. Однако данный метод отличается сложностью аппаратурного оформления и высокими экономическими затратами на анализ.
В литературном источнике [9] изложен метод спектроскопии аналитического определения ионов Cu2+, Pb2+ и Cd2+в пробе, включающей взаимодействие с цинконом, первоначально нанесенным на высокоосновной анионит JRA-400 из буферной среды. Кроме того, обработку пробы рекомендуют вести при pH 4,0–9,0 в течение 5 мин. Величину светового потока измеряют при определенной длине волны, соответствующей ионам тяжелых металлов. Длительность и сложность пробоподготовки делают этот способ непривлекательным при использовании в рамках экологического мониторинга.
Воздействие электрохимического окисления [10, 11] поверхности на аналитический сигнал неорганических ионов, в том числе ионов металла в методе инверсионной вольтамперометрии, буквально не изучено. Таким образом, наиболее подходящим методом, для определения концентрации тяжелых металлов в исследуемых растворах является способ инверсионной вольтамперометрии. Метод заключается в предварительном накоплении анализируемого вещества на рабочем электроде, в процессе электролиза, при определенном потенциале в системе. Далее происходит анодное растворение с линейно изменяющимся потенциалом [12].
Основное и наиболее важное преимущество инверсионного вольтамперометрического метода анализа состоит в том, что стадию предварительного концентрирования вещества и дальнейшую стадию регистрации аналитического сигнала можно проводить в одном и том же растворе. Вдобавок бесспорно выделяют ряд других достоинств метода, которыми являются:
- возможность анализирования огромного количества неорганических ионов (более 40), помимо этого и многих других органических веществ;
- наиболее низкие пределы обнаружения, которые могут достигать для определенных элементов (например, Cd, Bi, Tl, Pb, Sb, Ni) и органических соединений уровня концентрации 10-9–10-10 М;
- высокая избирательность и хорошие метрологические характеристики;
- легкодоступность программно-аппаратного комплекса и автоматизации аналитических определений;
- относительно низкая стоимость прибора для ИВА и достаточно простая работа на нем.
В качестве прибора для реализации ИВА нами был выбран полярограф ABC -1.1. Он включает в себя программно-аппаратный комплекс, который состоит из микропроцессорного измерительного блока (полярографа) и персонального компьютера (далее ПК) с установленной программой «AVS» на нем. Электрохимическая ячейка (ЭХЯ) для проведения измерений, состоящая из измерительного (рабочего) электрода, вспомогательного электрода (стеклоуглеродная ячейка), электродом сравнения и вал привода вращения измерительного электрода.
Потому как в состав прибора входит методика «4 элемента», предназначенная для совместного установления концентраций меди, кадмия, свинца и цинка в водных растворах, нами были изучены основные вольтамперометрические характеристики их определения: время накопления на электроде, величина добавки, стабилизация пиков вольтамперных кривых. Уточнены потенциалы накопления элемента на электроде и развертки.
В данном исследовании использовались реактивы квалификации о.с.ч. или х.ч. Для приготовления растворов пользовались бидистиллированной водой. Применяли растворы ГСО № 7255-96Сu (II), № 7252-96 Pb (II), № 7472-98 Cd (II), № 7256-96 Zn (II), содержащие 1 г/дм3 ионов металлов. Растворы солей, содержащих ионы Cu (II), Pb (II), Cd (II), Zn (II) в меньших концентрациях, готовили последовательным разбавлением исходных растворов Сu (II), Pb (II), Cd (II) фоновым раствором.
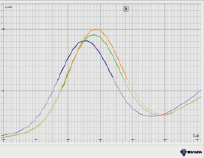
Нами были проведены измерения вольтамперометрических кривых в исходном растворе с точно известной концентрацией Cu (II), Pb (II), Cd (II), Zn (II) 20 мкг/л при различном времени предварительного накопления 20 с, 40 с, 60 с, 80 с и 100 с. Полученные данные представлены на рис. 1.
Концентрация определяемого иона прямо пропорциональна времени накопления данного вещества на поверхности электрода. В подавляющем большинстве источников [13] указывается, что оно может варьироваться в широких пределах от 30 с до 15 мин. При строгой периодичности воспроизведения измерений и фиксации времени накопления – его значения не приводят к искажению прямо пропорциональной зависимости между величиной тока окисления и концентрации определяемого иона.
Однако при различных временах накопления указанная прямо пропорциональная зависимость искажается, что обусловлено влиянием таких факторов, как диффузионный ток, примеси, избыточное перенапряжение ионов водорода и кислорода на поверхности электрода.
В связи с этим на предварительной стадии требуется выбрать оптимальное время накопления. Для оптимизации данного процесса исходим из того, что прямая пропорциональность между концентрацией определяемого иона и временем накопления сохраняется в том случае, если прирост последующего пика предельного тока окисления в мкА не превышает 30 % от предыдущего. Таким образом, нами выбрано оптимальное время накопления 60 с по каждому элементу (рис. 1).
При исследовании стабилизации пиков вольтамперных кривых нами была изучена зависимость высоты пика от объема и концентрации добавки. Рекомендуемые концентрации добавки приведены в табл. 1.
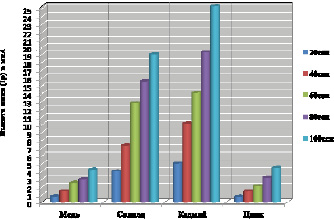
Рис. 1. Зависимость предельного тока окисления от времени накопления анализируемого иона
Таблица 1
Объемы и концентрации добавок
|
Диапазон концентраций в анализируемой пробе, мкг/дм3 |
Концентрация раствора, мг/дм3 |
Рекомендуемый объем добавок, см3 |
|
От 0,3 до 2,00 вкл. |
1,00 |
0,01–0,05 |
|
От 2,00 до 50,0 вкл. |
10,0 |
0,01–0,25 |
Таким образом, было установлено, что при исходной концентрации иона Ме (II) 1–2 мкг/л стабилизация пика наблюдается при объеме добавки 0,025 мл и концентра-ции 1000 мкг/л. При исходной концентрации иона Ме (II) 10–50 мкг/л стабилизация пика наблюдается при объеме добавки 0,05 мл и концентрации 10000 мкг/л. Границы пика устанавливали по методу «полуволны». Метод состоит в том, что при нахождении точки минимума на графике, которая не всегда является параллельной оси x, считаем расстояние от минимума к максимуму, после данное расстояние делим пополам, эта часть и является полуволной кривой. Примеры вольтамперометрических кривых представлены на рис. 2.
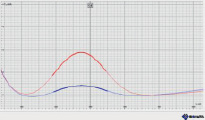
а) б)
Рис. 2. Вольтамперные кривые при определении Cd (II): а) исходная концентрация 20 мкг/л, добавка 0,05 мл с концентрацией 10000 мкг/л; б) исходная концентрация 2 мкг/л, добавка 0,025 мл с концентрацией 1000 мкг/л
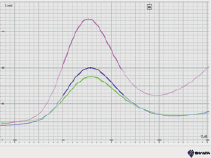
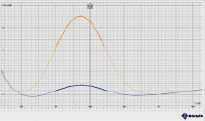
а) б)
Рис. 3. Вольтамперные кривые при определении Zn (II): а) в присутствии ионов меди (II); б) при предварительной экстракции ионов меди (II)
Таблица 2
Вольтамперометрические характеристики определения Cu (II), Pb (II), Cd (II), Zn (II) в водных растворах
|
Параметры |
Cu (II) |
Pb (II) |
Cd (II) |
Zn (II) |
|
Напряжение U, мВ |
-950 |
-1400 |
-950 |
-1000 |
|
Время накопления, с |
60 (варьируется) |
60 (варьируется) |
40 (варьируется) |
80 (варьируется) |
|
Время успокоения, с |
10 |
10 |
10 |
10 |
|
Циклы |
3 |
3 |
3 |
3 |
|
Диапазон |
2 |
2 |
2 |
2 |
|
Начальное напряжение (U1), мВ |
-1400 мВ |
-1400 мВ |
-1400 мВ |
-1400 мВ |
|
Конечное напряжение (U2), мВ |
+100 мВ |
+100 мВ |
+100 мВ |
+100 мВ |
|
Частота развертки, Гц |
75 |
75 |
75 |
75 |
|
Скорость, об/мин |
1000 |
1000 |
1000 |
1000 |
При установлении вольтамперометрической зависимости силы тока от потенциала наблюдается смещение потенциала элемента, что можно объяснить мешающим влиянием ионов Cu (II). В связи с этим перед определением ионов цинка (II) необходимо удалить из раствора ионы Cu (II). Для удаления ионов меди мы использовали метод экстракции с дитизоном. Медь связывается раствором дитизона в четыреххлористом углероде, который далее отделяем экстракцией. Примеры вольтамперометрических кривых при определении концентрации цинка (II) представлены на рис. 3.
На основании проведенных исследований нами определены оптимальные вольтамперометрические характеристики определения Cu (II), Pb (II), Cd (II), Zn (II) в водных растворах (табл. 2).
Предложенную методику использовали в рамках экологического мониторинга при исследовании природных вод. Нами было проведено определение концентраций ионов Cu2+, Zn2+, Pb2+ и Cd2+ в образцах природных вод озера п. Приозерный. Расчет концентрации каждого металла в анализируемом растворе производится по формуле, заложенной в программе прибора полярограф ABC – 1.1.
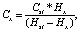
где Hst – высота пика элемента в растворе со стандартной добавкой;
Hx – высота пика элемента в исследуемом растворе;
Cst – концентрация добавки, мкг/дм3.
В ходе определения были вычислены концентрации тяжелых металлов (табл. 3).
Таблица 3
Концентрации тяжелых металлов
|
Тяжелые металлы |
С1, мкг/л |
С2, мкг/л |
Сср, мкг/л |
|
Медь |
1,48 ± 0,02 |
1,51 ± 0,02 |
1,49 ± 0,02 |
|
Свинец |
3,99 ± 0,05 |
4,03 ± 0,05 |
4,01 ± 0,05 |
|
Цинк |
2,86 ± 0,04 |
2,89 ± 0,04 |
2,88 ± 0,04 |
|
Кадмий |
43,45 ± 0,35 |
43,73 ± 0,35 |
43,59± 0,35 |
В соответствии с СанПиН 1.2.3685-21 было установлено превышение концентрации кадмия в 43,59 раза по сравнению с ПДК кадмия (II) – 0,001 мг/л.
Таким образом, поставленная цель исследования достигнута – установлены оптимальные вольтамперометрические характеристики определения ионов тяжелых металлов в водных объектах, а именно природных водах. Так же показано, что метод инверсионной вольтамперометрии может быть использован в рамках экологического мониторинга природных сред.
Библиографическая ссылка
Дедкова Д.А., Лукашов С.В. ИССЛЕДОВАНИЕ ПАРАМЕТРОВ ВОЛЬТАМПЕРОМЕТРИЧЕСКОГО ОПРЕДЕЛЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ВОДНЫХ РАСТВОРАХ // Международный журнал прикладных и фундаментальных исследований. 2021. № 12. С. 82-87;URL: https://applied-research.ru/ru/article/view?id=13335 (дата обращения: 11.02.2026).
DOI: https://doi.org/10.17513/mjpfi.13335

